- Introducción
- Métodos
- Inclusión y exclusión de pacientes
- Aprobaciones del protocolo estándar y consentimientos de los pacientes
- Programa de examen
- Estadísticas
- Resultados
- Frecuencia de IDNA en pacientes con SPI
- Características clínicas de los pacientes de SPI con IDNA en comparación con NID
- Características clínicas de los pacientes con SPI con IDNA en comparación con IDA
- Características hematológicas en los sujetos de control
- Discusión
- Características clínicas de la IDNA en el SPI
- ¿Es el IDNA un estadio temprano anterior al IDA en el SPI?
- Acceso y diagnóstico del IDNA en el SPI
- Conclusión
- Declaración de disponibilidad de datos
- Declaración de ética
- Contribuciones de los autores
- Financiación
- Conflicto de intereses
- Agradecimientos
- Material suplementario
- Abreviaturas
Introducción
El síndrome de las piernas inquietas (SPI) es un trastorno neurológico común (1), y la deficiencia de hierro juega un papel clave en su patogénesis (2, 3). La deficiencia de hierro es común en el SPI y la anemia ferropénica (ADI) es una causa bien conocida de SPI secundario (4, 5), que se asocia con un riesgo seis veces mayor de padecer SPI en la población general (6). La deficiencia de hierro sin anemia (IDNA, también deficiencia de hierro no anémica) suele ser insidiosa, y recientemente ha atraído la atención por su prevalencia en todo el mundo y el reto que supone su diagnóstico y tratamiento (7). A pesar de la clara relación entre la importancia clínica del SPI en la población con ADI (6), la prevalencia y las características de la IDNA en el SPI no se han investigado sistemáticamente. Se desconoce si la IDNA representa un subgrupo del SPI y si la IDNA es un estadio temprano previo a la IDA en el SPI. En este estudio, nos proponemos investigar las características clínicas del SPI con IDNA en comparación con aquellos sin deficiencia de hierro (NID, también sin deficiencia de hierro) y con los pacientes con IDA en una cohorte consecutiva de pacientes chinos con SPI.
Métodos
Inclusión y exclusión de pacientes
Reclutamos continuamente a pacientes de nuestra Clínica de Especialistas en SPI y de la Clínica de Trastornos del Movimiento en el Departamento de Neurología, Hospital General de Shanghái, Facultad de Medicina de la Universidad Jiao Tong de Shanghái entre enero de 2017 y octubre de 2018. El SPI se diagnosticó según los criterios de diagnóstico del Grupo Internacional de Estudio del Síndrome de las Piernas Inquietas (RLSSG) de 2014 (1). Se excluyeron del estudio los pacientes con otros trastornos neurológicos, poca cooperación o deterioro cognitivo. Se reclutaron controles sanos sin anemia, emparejados por edad y género, durante el mismo período en el Centro de Exámenes de Salud de nuestro hospital. Los controles estaban libres de enfermedades neurológicas, incluido el SPI, mediante una entrevista cara a cara.
Aprobaciones del protocolo estándar y consentimientos de los pacientes
El estudio fue aprobado por la Junta de Revisión Institucional del Hospital General de Shangai y todos los pacientes y controles sanos incluidos en el estudio dieron su consentimiento por escrito.
Programa de examen
Los pacientes con SPI fueron evaluados como hemos descrito previamente (8). Brevemente, entrevistamos a los pacientes cara a cara en nuestra clínica ambulatoria. Los pacientes considerados positivos para el SPI fueron diagnosticados por dos neurólogos especializados en SPI. Registramos la información demográfica, los antecedentes, los síntomas, la medicación, los exámenes neurológicos y médicos generales y el MMSE de todos los pacientes reclutados. Se evaluó además un cuestionario semiestructurado que incluía la edad de inicio del SPI, los antecedentes familiares del SPI (definidos como «familiares de primer grado»), el tipo y la topografía de las sensaciones, y si los síntomas del SPI se correlacionaban con la variación estacional. La gravedad del SPI durante la semana anterior a la entrevista se evaluó mediante la escala internacional de calificación del SPI (IRLSRS) (9). Se realizaron exámenes como ecografía vascular, velocidades de conducción nerviosa, electromiografía, etc., si estaban clínicamente indicados para excluir posibles imitaciones del SPI, como polineuropatías periféricas, estasis venosa, claudicación vascular, artritis reumatoide, etc. También se excluyeron los sujetos con antecedentes de medicación con neurolépticos u otros medicamentos que los autores consideraron posiblemente relacionados con el SPI en los tres meses anteriores. Se excluyeron aquellos con comorbilidades notables que se asociaban con el SPI secundario como la insuficiencia renal crónica, el embarazo, la enfermedad de Parkinson, la neuropatía periférica, la apoplejía y la ataxia. Se evaluaron los análisis de sangre para la hemoglobina y el estado del hierro periférico, incluyendo la ferritina sérica, el hierro, la transferrina y la capacidad total de fijación del hierro (TIBC). La saturación de transferrina (TSAT) se calculó como hierro sérico/TIBC × 100. El nivel normal de hemoglobina se definió como mujeres ≥ 113 g/L y hombres ≥ 131 g/L según el valor normal en nuestro hospital. La ADI se define como ferritina sérica <75 μg/L (o ferritina ≥ 75 μg/L pero TSAT <20%) con un nivel de hemoglobina normal (10, 11). La ADI se diagnostica cuando la hemoglobina <113 g/L (mujeres) o <131 g/L (hombres), así como la ferritina sérica <75 μg/L (o ferritina sérica ≥ 75 μg/L pero TSAT <20%).
Estadísticas
Los datos se analizaron con el programa SPSS 21.0 para Windows (IBM Co., USA). Todos los datos se presentan como medias ± desviaciones estándar. Dado que la mayoría de las variables no tenían una distribución normal, se utilizó la prueba de Kruskal-Wallis para las comparaciones de una sola variable entre tres grupos, y la prueba post-hoc de Mann-Whitney cuando P < 0,05. Las diferencias en las proporciones se analizaron mediante la prueba de chi-cuadrado de Pearson o la prueba exacta de Fisher cuando fue apropiado. P < 0,05 se consideraron significativas. Teniendo en cuenta los efectos potenciales del tratamiento farmacológico sobre el síntoma del SPI y otras características, se calcularon todos los datos dos veces en el total de pacientes con SPI y en los pacientes con SPI sin medicación, respectivamente.
Resultados
En este estudio se inscribieron de forma continua un total de 196 pacientes con SPI primario sin anemia (SPI IDNA y SPI NID), de los cuales 66 eran varones (33,7%) y 130 mujeres (66,3%). La edad media era de 53,0 ± 13,5 años. El 65,8% (129/196) de los pacientes con SPI no tomaban medicamentos para el SPI (109 no tomaban medicamentos y 20 no tomaban medicamentos durante más de 2 semanas en el momento de la entrevista). También se incluyeron 26 pacientes de SPI con IDA (22 sin medicación). Excluimos a cinco pacientes anémicos de SPI (Hb <113 g/L para las mujeres y Hb <131 g/L para los hombres) que no tenían evidencia de deficiencia de hierro (ferritina sérica ≥ 75 μg/L así como TIBC ≥ 20%, ferritina sérica media como 236,1 ± 119,3 μg/L). Ninguno de los pacientes con IDA tenía signos de infección, y las causas de IDA RLS se enumeran (Tabla 1). Además, recogimos 63 sujetos de control sanos, incluyendo 22 sujetos masculinos (34,9%) y 41 sujetos femeninos (65,1%), y la edad media del grupo de control fue de 51,0 ± 12,0 años (la edad media de 51,0 ± 10,4 y 51,0 ± 12,8 para hombres y mujeres, respectivamente). No hubo diferencias significativas tanto en el género (SPI frente a control: 66,3 frente a 65,1% para las mujeres, P > 0,05) como en la edad (SPI frente a control: 53,0 ± 13,5 frente a 51,0 ± 12,0, P > 0,05) entre los pacientes con SPI y los controles. Se muestra información demográfica detallada de los pacientes con SPI en cada grupo (Tabla 2).
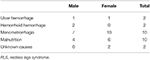
Tabla 1. Posibles causas de deficiencia de hierro en pacientes con SPI anémico.
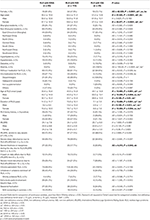
Tabla 2. Información demográfica y características clínicas de los pacientes con SPI con IDNA, NID e IDA.
Frecuencia de IDNA en pacientes con SPI
De los 196 pacientes con SPI (130 mujeres, 66 hombres) sin anemia ni otras comorbilidades, 83 (42,3%) tenían deficiencia de hierro. La prevalencia de IDNA en las mujeres (58,5%, 76/130) es mucho mayor que en los hombres (10,6%, 7/66) en esta cohorte de pacientes con SPI sin anemia (Tabla 2), con un riesgo relativo de 5,51 (intervalo de confianza del 95% 2,70-11,27, p < 0,0001).
Características clínicas de los pacientes de SPI con IDNA en comparación con NID
En los pacientes femeninos de SPI sin anemia, el grupo de IDNA tenía una edad más joven tanto en el momento de la entrevista como en el del inicio del SPI en comparación con el grupo de NID (p < 0,01; Tabla 2). Aunque no hubo diferencias en cuanto a la gravedad del SPI según la IRLSRS, encontramos más pacientes con cansancio o somnolencia grave/muy grave durante el día en el grupo IDNA en comparación con el grupo NID (32,5 frente al 17,7%, P < 0,05; Tabla 2). No hubo diferencias en cuanto a los antecedentes familiares, la gravedad, la lateralidad, la localización y la fluctuación estacional del SPI entre el grupo IDNA y el NID, ni en los hombres ni en las mujeres. El grupo de SPI con IDNA presentó una ferritina sérica más baja (hombres y mujeres, P < 0,0001), así como valores de transferrina y TIBC más altos (mujeres, P < 0,0001) en comparación con el grupo de SPI con NID (Figura 1, Tabla 3).
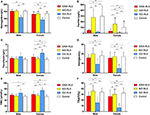
Figura 1. Los parámetros hematológicos y de hierro por grupo y género (A) Hemoglobina. (B) Ferritina. (C) Transferrina. (D) Hierro. (E) TIBC. (F) TSAT. **P < 0,01, *P < 0,05, prueba de Kruskal-Wallis y prueba post-hoc de Mann-Whitney. Datos comparados entre SPI IDNA (n = 83), SPI NID (n = 113), SPI IDA (n = 26) y controles (n = 63). ##P < 0,01, #P < 0,05, prueba U de Mann-Whitney. Datos comparados entre hombres y mujeres en cada grupo de SPI IDNA, SPI NID, SPI IDA y controles. La deficiencia de hierro se definió como nivel de ferritina <75 μg/L, o ferritina 75 μg/L, sin embargo TSAT <20%. ADI: anemia ferropénica; ANI: ferropénica sin anemia; SNI: no ferropénico; SPI: síndrome de las piernas inquietas; TIBC: capacidad total de fijación del hierro; TSAT: saturación de transferrina.
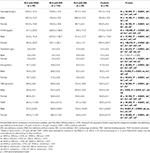
Tabla 3. Datos hematológicos de los pacientes con SPI con IDNA, NID, IDA y controles.
Después de excluir a los pacientes con SPI que recibían medicación para el SPI, el grupo de SPI con IDNA seguía mostrando tasas más altas de cansancio/sueño diurno grave/muy grave en comparación con el grupo de SPI con NID, aunque no a un nivel significativo (35 frente a 18,8%, P = 0,078). Otras características entre el SPI con IDNA y el SPI con NID fueron similares (Tabla Suplementaria 1).
Características clínicas de los pacientes con SPI con IDNA en comparación con IDA
El grupo con IDA tenía parámetros metabólicos del hierro en suero más gravemente alterados que el grupo con IDNA, incluyendo una ferritina más baja (hombre, P < 0.05; mujer, P < 0,0001), transferrina más alta (mujer, P < 0,0001), hierro más bajo (hombre, P < 0,05; mujer, P < 0,0001), TIBC más alto (mujer, P < 0,0001), y TSAT más bajo (hombre, P < 0,05; mujer, P < 0,0001) en suero (Figura 1, Tabla 3). El SPI IDNA tuvo una mayor duración de la enfermedad (P < 0,01 en los hombres, P < 0,05 en las mujeres) y una menor edad de inicio (sólo significativa en los hombres con P < 0,05) que el SPI IDA. No hubo diferencias en cuanto a los antecedentes familiares positivos, la gravedad (IRLSRS), la lateralidad, la localización y la fluctuación estacional del SPI entre el SPI IDNA y el SPI IDA, ni en los hombres ni en las mujeres con SPI (Tabla 2). Los resultados fueron similares después de excluir a los pacientes de SPI con medicamentos para el SPI (Tabla suplementaria 1).
Características hematológicas en los sujetos de control
Los criterios de diagnóstico de la deficiencia de hierro son diferentes entre la población general y los pacientes de SPI (como se discute más adelante). Según el valor de corte de nuestro hospital para la deficiencia de hierro en la población general (20 μg/L), encontramos que ninguno de los sujetos masculinos del grupo de control tenía deficiencia de hierro, mientras que cuatro sujetos de control femeninos mostraron deficiencia de hierro (dos sujetos con ferritina sérica <20 μg/L, y dos sujetos con ferritina ≥ 20 μg/L pero TSAT <20%). No hubo diferencia significativa de la prevalencia de la deficiencia de hierro en los controles entre los hombres (0%, 0/22) y las mujeres (9,8%, 4/41; P = 0,288). Las pruebas hematológicas sobre la hemoglobina y los parámetros de hierro en el grupo de control fueron más similares con el grupo de SPI NID en comparación con el grupo IDNA o IDA (Figura 1, Tabla 3).
Discusión
La fisiopatología del SPI primario y secundario no se conoce bien. La deficiencia de hierro en el cerebro tiene un papel fundamental en la patogénesis del SPI, y las condiciones caracterizadas por la deficiencia sistémica de hierro, como la anemia y el embarazo, se asocian con una mayor prevalencia de los síntomas del SPI (2, 3, 5, 6). La ADI es una comorbilidad reconocida asociada al SPI secundario (4-6, 12). La IDNA es más insidiosa, y sus características son menos conocidas en los pacientes de SPI.
Características clínicas de la IDNA en el SPI
En general, las mujeres son más susceptibles de padecer SPI (1, 13, 14). Además, las mujeres en edad fértil presentan una mayor deficiencia de hierro que los hombres de la población general (15). En este estudio sobre pacientes con SPI sin anemia, también encontramos una importante discriminación dependiente del sexo. Las mujeres con SPI tienen un riesgo mucho mayor de padecer IDNA que los hombres con SPI (riesgo relativo de 5,51, p < 0,0001). Un menor número de pacientes varones con SPI padecían deficiencia de hierro, con o sin anemia. En los controles, aunque sin significación estadística, encontramos que el 9,8% de los sujetos femeninos sufrían deficiencia de hierro, mientras que ninguno de los sujetos masculinos lo hacía. La deficiencia de hierro es poco común en el género masculino, por lo que si los pacientes varones con SPI tienen deficiencia de hierro, deben realizarse consultas adicionales para evaluar causas secundarias como hemorragias crónicas y malnutrición debida a trastornos gastrointestinales.
Cuando se compara con el grupo de SPI «normal» de NID, el grupo de SPI de IDNA mostró una edad de inicio del SPI más temprana y una edad más joven en la entrevista en las mujeres, pero no en los hombres (Tabla 2). En un estudio anterior, encontramos que el SPI de inicio temprano demostró una historia familiar de SPI más positiva y parámetros de hierro periféricos más alterados (ferritina sérica más baja, y valores de transferrina y TIBC séricos más altos) en comparación con el SPI de inicio tardío (8). Recientemente, hemos encontrado que el IDNA en el SPI predice algunos factores genéticos en comparación con el NID en el SPI (datos no publicados). Un potencial subtipo en asociación con los antecedentes genéticos, la deficiencia de hierro, y el SPI de inicio temprano, merece mayor investigación. La fatiga, la debilidad, la dificultad para concentrarse, la disminución de la memoria, así como el bajo rendimiento laboral, son síntomas inespecíficos que a menudo se asocian con la deficiencia de hierro (7, 16). Allen et al. (6) informaron previamente de que los enfermos de ADI con SPI mostraban más cansancio, peor calidad del sueño y menor energía diurna en comparación con los pacientes de ADI sin SPI. Encontramos que los pacientes de SPI con IDNA eran también más propensos a sufrir manifestaciones de cansancio severo/muy severo o somnolencia durante el día debido al SPI en comparación con los pacientes de SPI con NID (punto de corte en 75 μg/L, 32,5 vs. 17,7%, P < 0,05, Tabla 2). Cuando se analizó de nuevo sólo en los pacientes con SPI sin medicación, los pacientes con SPI con NID seguían mostrando una tendencia de mayor susceptibilidad al cansancio o la somnolencia diurnos severos/muy severos, aunque sin alcanzar una significación estadística (35 frente a 18,8%, P = 0,078, Tabla suplementaria 1). En este estudio no se encontró ninguna diferencia de cansancio o somnolencia diurnos severos/muy severos entre el SPI IDNA y el SPI IDA (Tabla 2). El agotamiento de las reservas de hierro, a lo largo de un continuo que va desde la IDA hasta la IDNA, se asocia con la disminución de la actividad de las enzimas dependientes del hierro, la reducción de la capacidad oxidativa celular, así como la disminución de la eficiencia energética (17-19). Cuando utilizamos una definición más estricta para el IDNA (valor de corte de la ferritina sérica fijado en 50 μg/L), seguimos encontrando que más pacientes con SPI IDNA sufrían de cansancio o somnolencia severa/muy severa durante el día en comparación con los pacientes con SPI NID (32,3 vs. 19,8%), sin embargo esto no fue significativo (P > 0,05; Tabla Suplementaria 2). El movimiento periódico de las piernas durante el sueño (PLMS) está estrechamente relacionado con el SPI, y el locus dentro del gen BTBD9 está correlacionado con el riesgo tanto del PLMS como del SPI (20, 21). Notablemente, sólo evaluamos la calidad del sueño utilizando el subítem 4 de la IRLSRS, y no realizamos una evaluación detallada del estado del sueño utilizando la medida de la polisomnografía (PSG). En consecuencia, no se disponía de datos de PLMS ni de otros parámetros relacionados con el sueño, que pueden contribuir significativamente al cansancio o la somnolencia diurnos. Por lo tanto, la asociación entre el cansancio o la somnolencia diurnos y el IDNA requiere una investigación más profunda. No encontramos diferencias significativas en la gravedad del SPI entre el grupo de IDNA y el de NID. La deficiencia periférica de hierro aumenta el riesgo de prevalencia del SPI en estudios clínicos anteriores (6). La reducción de las concentraciones de hierro en suero disminuye globalmente los niveles de hierro en el cerebro, y el tratamiento con hierro beneficia a los pacientes con SPI con niveles bajos de hierro periférico (10). No obstante, numerosos pacientes con SPI sin deficiencia sistémica de hierro siguen mostrando un déficit cerebral específico de hierro (22). Estudios en roedores informaron que el estado del hierro sérico no estaba correlacionado con los niveles regionales de hierro en el cerebro, por lo que puede estar relacionado de forma limitada con las características del SPI (23, 24).
¿Es el IDNA un estadio temprano anterior al IDA en el SPI?
La deficiencia de hierro puede clasificarse en dos niveles, IDNA e IDA, según el valor de medición de la hemoglobina. En este estudio, los pacientes del SPI con IDA tenían los niveles más bajos de hemoglobina, ferritina y hierro, así como los valores más altos de transferrina y TIBC en comparación con el SPI IDNA y el SPI NID (Figura 1, Tabla 3). Aunque no hubo diferencias significativas en los niveles de hemoglobina entre el SPI de IDNA y el SPI de NID (tanto en los pacientes de SPI masculinos como en los femeninos), la hemoglobina sérica en los pacientes de SPI de IDNA fue inferior en comparación con los controles (sólo en las mujeres, P < 0,05, Figura 1, Tabla 3). Además, los valores de los parámetros de hierro en el grupo de IDNA RLS estaban entre los del grupo de NID RLS o el grupo de control y el grupo de IDA RLS (Figura 1, Tabla 3). Estos resultados son coherentes con el punto de vista de IDNA es una deficiencia de hierro más leve antes del desarrollo de la anemia. Cabe destacar que se considera que los parámetros de hierro sérico reflejan el estado de hierro periférico principalmente en los eritrones (25), mientras que el almacenamiento de hierro en otros órganos (como el hígado, el cerebro, etc.) debe validarse en los sujetos con IDNA.
No obstante, las causas y características del SPI con IDNA y el SPI con IDA no son totalmente similares. En este estudio, la mayoría de los pacientes con SPI con ADI presentaban notables comorbilidades asociadas a la malnutrición o a la pérdida crónica excesiva de sangre, incluyendo hemorragia del tracto alimentario, hemorragia de las hemorroides y menorragia (Tabla 1), lo que coincide con el estudio anterior (12). Cabe señalar que la menorragia es una causa común de ADI en las mujeres en edad reproductiva, que puede ser posterior a fibromas uterinos, adenomiosis y otros trastornos ginecológicos. La desnutrición puede ser secundaria a trastornos gastrointestinales, a una dieta vegetariana y a ideas erróneas sobre la imagen corporal de las mujeres jóvenes. Por lo tanto, la deficiencia de hierro en la mayoría de los pacientes con SPI IDA en este estudio son «deficiencia absoluta de hierro». En cambio, los pacientes de SPI con IDNA suelen carecer de comorbilidades notables. Las causas del SPI con IDNA son insidiosas y el IDNA en el SPI generalmente pertenece al ámbito del SPI primario (4) asociado a la «deficiencia funcional de hierro». Sin embargo, no podemos excluir ninguna causa secundaria insidiosa en los pacientes con SPI con IDNA, que puede conducir a un suministro inadecuado de hierro en el organismo.
En comparación con el SPI con IDNA, los pacientes con IDA tenían una edad de inicio del SPI más avanzada, así como una duración más corta del SPI tanto en el hombre como en la mujer (más significativa en el hombre; Tabla 2), lo que concuerda con el punto de vista de que el SPI secundario suele tener una edad de inicio más avanzada (26). Según nuestra experiencia, estos pacientes con SPI de la ADI con causas notables (como la pérdida aguda de sangre) suelen presentar una duración más corta de la enfermedad y una recuperación o alivio más rápidos cuando se corrigen los trastornos comórbidos tratables y se restablece el estado del hierro. Por lo general, no requieren una terapia a largo plazo para el SPI, que es algo diferente de los pacientes con SPI primario. Son necesarios futuros estudios longitudinales para confirmar los efectos del tratamiento con suplementos de hierro en pacientes con SPI con ADI. Otros estudios sobre el SPI comórbido del embarazo (27) y la uremia (28) informaron de una mejora tras el parto y el trasplante renal, lo que sugiere que los cambios en los factores metabólicos asociados pueden desencadenar el SPI en sujetos susceptibles (5).
Por lo tanto, hay heterogeneidad tanto en el SPI con ADI como en el SPI con IDNA. Aunque generalmente se considera que el IDNA es un estadio temprano previo a la anemia (7), es posible que el SPI IDNA no sea simplemente un estadio prodrómico previo al SPI IDA.
Acceso y diagnóstico del IDNA en el SPI
Aunque la biopsia de médula ósea se considera el mejor indicador del estado del hierro, rara vez se realiza debido a los riesgos potenciales de infección o sangrado en el lugar de la biopsia (29). Los indicadores de laboratorio del estado del hierro más utilizados son la ferritina, que refleja las reservas de hierro en los tejidos o la adecuación del hierro disponible para la eritropoyesis (30). Aunque la ferritina sérica es un marcador sensible para evaluar el almacenamiento total de hierro en el cuerpo, otras condiciones como el estado inflamatorio, la edad y la función renal pueden ser factores de confusión, aumentando los niveles de ferritina sérica (31). La ferritina y la transferrina son también reactantes de fase aguda, y el nivel de ferritina podría aumentar y los niveles de transferrina disminuir en una condición inflamatoria (32). Por lo tanto, incluso una ferritina sérica ≥ 75 μg/L y un TSAT <20% podrían tener una deficiencia de hierro real (11, 33).
Un punto de corte de la concentración de ferritina sérica de <30 μg/L es el más sensible y específico para identificar una posible deficiencia de hierro en la población general (17, 18), y el IDNA se clasifica como una persona con niveles de hemoglobina normales con niveles de ferritina sérica disminuidos (<20 μg/L) (34, 35). Los laboratorios clínicos suelen fijar el límite inferior del rango de referencia para la ferritina sérica en 10-20 μg/L en la población común (36) (el límite inferior se fija en 20 μg/L en nuestro hospital). Para definir la deficiencia de hierro en trastornos crónicos, como la insuficiencia cardíaca y la enfermedad renal crónica, se suelen utilizar niveles umbral de ferritina sérica significativamente más altos (7, 17). Los criterios de evaluación para definir la deficiencia de hierro en el SPI también son diferentes a los de los controles sanos, aunque el valor de corte exacto de la ferritina para significar IDNA en el SPI aún no ha alcanzado un consenso. Estudios recientes sugieren que los pacientes con SPI deben considerarse deficientes en hierro cuando su concentración de ferritina es inferior a 75 μg/L (10, 11, 27). Sin embargo, estudios anteriores determinaron mayoritariamente la concentración de ferritina por debajo de 50 μg/L como «estado de hierro bajo» en el SPI (37, 38). Dado que no se dispone de datos sobre las descripciones de los diferentes puntos de corte, comparamos las características del SPI IDNA y del SPI NID utilizando tanto 75 como 50 μg/L como valores de corte de la ferritina para la deficiencia de hierro. Encontramos que cuando se utiliza 50 μg/L como línea de corte inferior de la ferritina, el 33,2% (65/196) de los pacientes con SPI cumplen los criterios de IDNA. Los resultados fueron bastante similares para los dos umbrales utilizados, excepto que el aumento del cansancio o la somnolencia grave/muy grave durante el día en el SPI IDNA en comparación con el SPI NID no fue significativo cuando el valor de corte de la ferritina se fijó en 50 μg/L (Tabla 2, Tabla suplementaria 2).
Nuestro estudio tuvo algunas limitaciones: En primer lugar, se trataba de un estudio transversal y la falta de datos longitudinales hacía difícil identificar la evolución de los síntomas del SPI y los efectos del tratamiento. Además, puede haber un sesgo de recuerdo. En segundo lugar, se trata de un estudio de un solo centro, ya que aproximadamente una cuarta parte de los pacientes eran residentes locales de Shanghai y la mayoría de los pacientes procedían del este de China. Teniendo en cuenta el vasto territorio de China y los posibles factores ambientales, puede haber un sesgo de selección. En tercer lugar, no realizamos mediciones de PSG para evaluar el estado detallado del sueño en los pacientes con SPI y los controles. En cuarto lugar, alrededor de un tercio de los pacientes con SPI de este estudio recibían tratamiento con dopaminérgicos y/o gabapentina enacarbil (sólo un paciente recibía tratamiento con suplementos de hierro), lo que puede influir en las características clínicas. Sin embargo, volvimos a calcular todos los datos en pacientes con SPI sin medicación y sacamos la misma conclusión. Dicho esto, nuestro estudio tiene algunas ventajas. Estudiamos en detalle el espectro clínico del SPI y excluimos otras comorbilidades o imitaciones del SPI. Entrevistamos a cada paciente cara a cara, y excluimos cuidadosamente a aquellos pacientes con SPI atípico durante el seguimiento. Ha habido estudios limitados sobre las características del IDNA en el SPI, exploramos las características clínicas detalladas del IDNA en pacientes chinos consecutivos con SPI.
Conclusión
El IDNA es frecuente en los pacientes con SPI especialmente en las mujeres y tiene algunas características clínicas especiales. El IDNA tenía una edad más joven tanto en la entrevista como en el momento del inicio del SPI en comparación con el NID en pacientes femeninos con SPI. La IDNA no es muy frecuente en pacientes masculinos con SPI y los hombres con deficiencia de hierro deben ser evaluados para detectar trastornos comórbidos. Las características de los pacientes de SPI con IDNA son diferentes de las del SPI con IDA. El SPI con IDNA representa un importante y olvidado problema de salud pública que merece más atención clínica y debe ser abordado en la estrategia de tratamiento. Se recomienda el cribado regular de los parámetros de hierro periférico, incluso en pacientes con un recuento sanguíneo normal, para un tratamiento adecuado y oportuno.
Declaración de disponibilidad de datos
Los conjuntos de datos generados para este estudio están disponibles previa solicitud al autor correspondiente.
Declaración de ética
Los estudios con participantes humanos fueron revisados y aprobados por la Junta de Revisión Institucional del Hospital General de Shanghai. Los pacientes/participantes dieron su consentimiento informado por escrito para participar en este estudio.
Contribuciones de los autores
X-YZ concepción/diseño/ejecución del proyecto/redacción del manuscrito. T-TW: ejecución del proyecto/recopilación e interpretación de datos/redacción del manuscrito. H-MW y JS: medición en el laboratorio. XL, L-YN, T-JC y M-YQ: ejecución del proyecto/recopilación e interpretación de los datos. TL y WO: revisión crítica del manuscrito en busca de contenido intelectual importante. Y-CW: concepción/diseño/supervisión del proyecto, revisión crítica del manuscrito por contenido intelectual importante. Todos los autores: preparación del manuscrito.
Financiación
Este trabajo fue patrocinado por la Comisión Municipal de Planificación de Shanghái del Fondo de Ciencia e Investigación (201740017), el Plan de Innovación de Investigación Clínica del Hospital General de Shanghái (CTCCR-2018C02), el Programa Interdisciplinario de la Universidad Jiao Tong de Shanghái (YG2015QN21), y la Fundación Nacional de Ciencias Naturales de China (No. 81671251).
Conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
Agradecimientos
Agradecemos a todos los pacientes y sujetos de control sanos que participaron en este estudio. Agradecemos al personal del Centro de Examen Físico del Hospital General de Shanghái. También agradecemos al Departamento de Bioinformática y Bioestadística, Escuela de Ciencias de la Vida y Biotecnología, Universidad Jiao Tong de Shanghái, a Yue Zhang por la consulta estadística.
Material suplementario
El material suplementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fneur.2020.00298/full#supplementary-material
Abreviaturas
CI, intervalo de confianza; IRLSSG, International Restless Legs Study Group; MMSE, Mini-Mental State Examination; NID, sin deficiencia de hierro; SPI, síndrome de piernas inquietas; ADI, anemia por deficiencia de hierro; IDNA, deficiencia de hierro sin anemia; IRLSRS, International Restless Legs Syndrome Rating Scale; TIBC, capacidad total de fijación del hierro; TSAT, saturación de transferrina.
1. Allen RP, Picchietti DL, García-Borreguero D, Ondo WG, Walters AS, Winkelman JW, et al. Criterios de diagnóstico del síndrome de las piernas inquietas/enfermedad de Willis-Ekbom: criterios de consenso actualizados del Grupo Internacional de Estudio del Síndrome de las Piernas Inquietas (RLSSG): historia, fundamento, descripción e importancia. Sleep Med. (2014) 15:860-73. doi: 10.1016/j.sleep.2014.03.025
CrossRef Full Text | Google Scholar
2. Connor JR, Boyer PJ, Menzies SL, Dellinger B, Allen RP, Ondo WG, et al. El examen neuropatológico sugiere una adquisición de hierro cerebral alterada en el síndrome de las piernas inquietas. Neurología. (2003) 61:304-9. doi: 10.1212/01.WNL.0000078887.16593.12
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Allen RP, Earley CJ. El papel del hierro en el síndrome de las piernas inquietas. Mov disord. (2007) 18(22 Suppl):S440-8. doi: 10.1002/mds.21607
CrossRef Full Text | Google Scholar
4. Trenkwalder C, Allen R, Hogl B, Clemens S, Patton S, Schormair B, et al. Comorbilidades, tratamiento y fisiopatología en el síndrome de las piernas inquietas. Lancet Neurol. (2018) 17:994-1005. doi: 10.1016/S1474-4422(18)30311-9
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Trenkwalder C, Allen R, Hogl B, Paulus W, Winkelmann J. Síndrome de piernas inquietas asociado a enfermedades graves: una revisión sistemática y un nuevo concepto. Neurology. (2016) 86:1336-43. doi: 10.1212/WNL.0000000000002542
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Allen RP, Auerbach S, Bahrain H, Auerbach M, Earley CJ. La prevalencia y el impacto del síndrome de piernas inquietas en pacientes con anemia por deficiencia de hierro. Am J Hematol. (2013) 88:261-4. doi: 10.1002/ajh.23397
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Soppi ET. Deficiencia de hierro sin anemia: un desafío clínico. Clin Case Rep. (2018) 6:1082-6. doi: 10.1002/ccr3.1529
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Zhu XY, Wu TT, Wang HM, Ni LY, Li X, Liu Y, et al. Características clínicas y subtipos del síndrome de piernas inquietas en la población china: un estudio de 359 pacientes. Sleep Med. (2019) 59:15-23. doi: 10.1016/j.sleep.2019.01.053
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Walters AS, LeBrocq C, Dhar A, Hening W, Rosen R, Allen RP, et al. International Restless Legs Syndrome Study, Validation of the International Restless Legs Syndrome Study Group rating scale for restless legs syndrome. Sleep Med. (2003) 4:121-32. doi: 10.1016/S1389-9457(02)00258-7
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Allen RP, Picchietti DL, Auerbach M, Cho YW, Connor JR, Earley CJ, et al. International Restless Legs Syndrome Study, Evidence-based and consensus clinical practice guidelines for the iron treatment of restless legs syndrome/Willis-Ekbom disease in adults and children: an IRLSSG task force report. Sleep Med. (2018) 41:27-44. doi: 10.1016/j.sleep.2017.11.1126
CrossRef Full Text | Google Scholar
11. Trenkwalder C, Winkelmann J, Oertel W, Virgin G, Roubert B, Mezzacasa A, et al. Carboximaltosa férrica en pacientes con síndrome de piernas inquietas y deficiencia de hierro no anémica: un ensayo aleatorio. Mov Disord. (2017) 32:1478-82. doi: 10.1002/mds.27040
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Mehmood T, Auerbach M, Earley CJ, Allen RP. Respuesta al hierro intravenoso en pacientes con anemia ferropénica (ADI) y síndrome de piernas inquietas (enfermedad de Willis-Ekbom). Sleep Med. (2014) 15:1473-6. doi: 10.1016/j.sleep.2014.08.012
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Thomas K, Watson CB. Síndrome de las piernas inquietas en las mujeres: una revisión. J Womens Health. (2008) 17:859-68. doi: 10.1089/jwh.2007.0515
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Ohayon MM, O’Hara R, Vitiello MV. Epidemiología del síndrome de piernas inquietas: una síntesis de la literatura. Sleep Med Rev. (2012) 16:283-95. doi: 10.1016/j.smrv.2011.05.002
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Umbreit J. Deficiencia de hierro: una revisión concisa. Am J Hematol. (2005) 78:225-31. doi: 10.1002/ajh.20249
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Sawada T, Konomi A, Yokoi K. Iron deficiency without anemia is associated with anger and fatigue in young Japanese women. Biol Trace Elem Res. (2014) 159:22-31. doi: 10.1007/s12011-014-9963-1
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Camaschella C. Iron-deficiency anemia. N Engl J Med. (2015) 372:1832-43. doi: 10.1056/NEJMra1401038
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Lopez A, Cacoub P, Macdougall IC, Peyrin-Biroulet L. Iron deficiency anaemia. Lancet. (2016) 387:907-16. doi: 10.1016/S0140-6736(15)60865-0
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Haas JD, Brownlie T. Iron deficiency reduced work capacity: a critical review of the research to determine a causal relationship. J Nutr. (2001) 131:676S-88S; discusión 688S-90S. doi: 10.1093/jn/131.2.676S
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Stefansson H, Rye DB, Hicks A, Petursson H, Ingason A, Thorgeirsson TE, et al. A genetic risk factor for periodic limb movements in sleep. N Engl J Med. (2007) 357:639-47. doi: 10.1056/NEJMoa072743
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Li G, Tang H, Wang C, Qi X, Chen J, Chen S, et al. Asociación de BTBD9 y MAP2K5/SKOR1 con el síndrome de piernas inquietas en la población china. Sleep. (2017) 40:zsx028. doi: 10.1093/sleep/zsx028
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Earley CJ, Connor J, García-Borreguero D, Jenner P, Winkelman J, Zee PC, et al. Altered brain iron homeostasis and dopaminergic function in Restless Legs Syndrome (Willis-Ekbom Disease). Sleep Med. (2014) 15:1288-301. doi: 10.1016/j.sleep.2014.05.009
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Erikson KM, Pinero DJ, Connor JR, Beard JL. Regional brain iron, ferritin and transferrin concentrations during iron deficiency and iron repletion in developing rats. J Nutr. (1997) 127:2030-8. doi: 10.1093/jn/127.10.2030
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Yin L, Unger EL, Jellen LC, Earley CJ, Allen RP, Tomaszewicz A, et al. Systems genetic analysis of multivariate response to iron deficiency in mice. Am J Physiol Regul Integr Comp Physiol. (2012) 302:R1282-96. doi: 10.1152/ajpregu.00634.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Hallberg L, Hulthen L. Perspectives on iron absorption. Blood Cells Mol Dis. (2002) 29:562-73. doi: 10.1006/bcmd.2002.0603
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Shukla G, Gupta A, Pandey RM, Kalaivani M, Goyal V, Srivastava A, et al. ¿Qué características diferencian el síndrome de piernas inquietas unilateral del bilateral? A comparative observational study of 195 patients. Sleep Med. (2014) 15:714-9. doi: 10.1016/j.sleep.2014.01.025
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Picchietti DL, Hensley JG, Bainbridge JL, Lee KA, Manconi M, McGregor JA, et al. International Restless Legs Syndrome Study, Consensus clinical practice guidelines for the diagnosis and treatment of restless legs syndrome/Willis-Ekbom disease during pregnancy and lactation. Sleep Med Rev. (2015) 22:64-77. doi: 10.1016/j.smrv.2014.10.009
CrossRef Full Text | Google Scholar
28. Winkelmann J, Stautner A, Samtleben W, Trenkwalder C. Curso a largo plazo del síndrome de piernas inquietas en pacientes en diálisis después del trasplante de riñón. Mov Disord. (2002) 17:1072-6. doi: 10.1002/mds.10231
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Bain BJ. Bone marrow biopsy morbidity: review of 2003. J Clin Pathol. (2005) 58:406-8. doi: 10.1136/jcp.2004.022178
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Baynes RD. Baynes RD. Assessment of iron status. Clin Biochem. (1996) 29:209-15. doi: 10.1016/0009-9120(96)00010-K
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Wish JB. Wish JB. Assessing iron status: beyond serum ferritin and transferrin saturation. Clin J Am Soc Nephrol. (2006) 1(1 Suppl):S4-8. doi: 10.2215/CJN.01490506
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Tietz NW, Rinker AD, Morrison SR. ¿Cuándo es un hierro sérico realmente un hierro sérico? El estado de las mediciones de hierro sérico. Clin Chem. (1994) 40:546-1. doi: 10.1093/clinchem/40.4.546
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Mackie S, Winkelman JW. Ferritina normal en un paciente con deficiencia de hierro y SPI. J Clin Sleep Med. (2013) 9:511-3. doi: 10.5664/jcsm.2680
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Leonard AJ, Chalmers KA, Collins CE, Patterson AJ. Comparación de dos dosis de hierro elemental en el tratamiento de la deficiencia de hierro latente: eficacia, efectos secundarios y capacidad de cegamiento. Nutrients. (2014) 6:1394-405. doi: 10.3390/nu6041394
PubMed Abstract | CrossRef Full Text | Google Scholar
35. D’Adamo CR, Novick JS, Feinberg TM, Dawson VJ, Miller LE. Un suplemento dietético derivado de los alimentos que contiene una dosis baja de hierro mejoró los marcadores del estado del hierro entre las mujeres con deficiencia de hierro no anémica. J Am Coll Nutr. (2018) 37:342-9. doi: 10.1080/07315724.2018.1427158
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Goodnough LT, Nemeth E, Ganz T. Detección, evaluación y manejo de la eritropoyesis con restricción de hierro. Blood. (2010) 116:4754-61. doi: 10.1182/blood-2010-05-286260
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Lee CS, Lee SD, Kang SH, Park HY, Yoon IY. Comparación de las eficacias de hierro oral y pramipexole para el tratamiento de pacientes con síndrome de piernas inquietas con ferritina sérica baja. Eur J Neurol. (2014) 21:260-6. doi: 10.1111/ene.12286
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Tilma J, Tilma K, Norregaard O, Ostergaard JR. Síndrome de piernas inquietas de inicio temprano en la infancia: síntomas y efecto del tratamiento con hierro oral. Acta Paediatr. (2013) 102:e221-6. doi: 10.1111/apa.12173
PubMed Abstract | CrossRef Full Text | Google Scholar
.