Michael D. Ober, MD
Christina M. Klais, MD
Emmett T. Cunningham Jr., MD, PhD, MPH
New York City
A makulaödéma az extracelluláris folyadék kóros felhalmozódását jelenti a retinán belül, elsősorban a külső plexiform és a belső nukleáris rétegben, a vér-retina gátak meghibásodására adott nem specifikus válaszként. A ME gyakori oka a látásvesztésnek diabetes mellitusban, retinavénás elzáródásban, uveitisben szenvedő betegeknél és intraokuláris műtétet követően. Ritkábban fordul elő vitreoretinalis trakció, choroidalis neovaszkularizáció és számos más állapot esetén. A ME kezelésére számos stratégiát alkalmaztak, változó sikerrel. Ez a cikk áttekinti ennek a gyakori állapotnak a rendelkezésre álló kezelési lehetőségeit.
 |
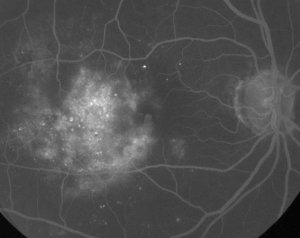 |
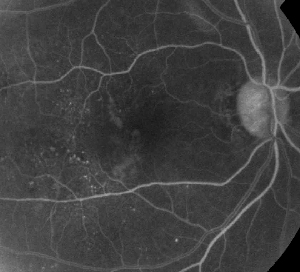
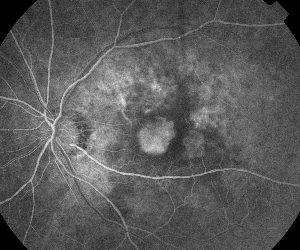
| 1. ábra. A. Nem proliferatív diabéteszes retinopátiában szenvedő beteg korai fázisú fluoreszcein angiográfiája. A mikroaneurizmák a fovea temporalis részén láthatók a legmarkánsabban a fovea avaszkuláris zónájában lévő fluoreszceinszivárgás mellett. | B. Ugyanezen beteg késői fázisú FA-ja, amely a fovealis avaszkuláris zónán belül és temporálisan diffúz szivárgást mutat, ami megfelel a diabéteszes makulaödémának. |
Diagnózis
A ME klinikai diagnózisa legjobban kontaktlencse és sztereoszkópos réslámpás fundus biomikroszkópia segítségével állítható fel. A ME jellemzően szabálytalan kiemelkedésként jelentkezik a retinán belül, gyakran intraretinalis lipid, mikroaneurizmák és/vagy vérzések szomszédságában, diabetes mellitus, érelzáródás vagy iszkémia miatt másodlagos esetekben. A retinán belüli folyadék a parafovealis retinára lokalizált cisztás terekben is felhalmozódhat, szomszédos érrendszeri eltérésekkel vagy azok nélkül. Ez a cisztás makulaödéma (CME) leggyakrabban gyulladás, lokalizált húzódás vagy műtét utáni következménye.
A fluoreszcein-angiográfia alapvető eszköz a ME diagnózisában. A normális szemben a fluoreszceint a vér-retinális gátak megakadályozzák abban, hogy a retinába jusson. ME-ben azonban a fluoreszcein molekulák elhagyják az intravaszkuláris teret, és bejutnak a retinába. Az érintett helyek a korai és középső képkockákon hiperfluoreszcenciát mutatnak, amely a későbbi képkockákon területben és intenzitásban növekszik (lásd az 1. ábrát). Az FA nemcsak az ödémát emeli ki a könnyű vizualizáció és a kezelés lokalizálása érdekében, hanem a későbbi összehasonlításhoz állandó felvételt is készít. A ME-re egy négyfokozatú kvantitatív skálát dolgoztak ki, ahol a 0. fokozat nem jelent perifoveális hiperfluoreszcenciát, az 1. fokozat nem teljes perifoveális hiperfluoreszcenciát, a 2. fokozat enyhe 360 fokos hiperfluoreszcenciát, a 3. fokozat közepes 360 fokos hiperfluoreszcenciát, ahol a hiperfluoreszcens terület körülbelül 1 korongátmérő átmérőjű, és a 4. fokozat súlyos 360 fokos hiperfluoreszcenciát, ahol a hiperfluoreszcens terület körülbelül 1,5 korongátmérőjű.1,2 Bár az FA érzékeny eszköz a ME jelenlétének azonosítására, viszonylag kevés információt nyújt a folyadék anatómiai eloszlásáról, azaz a diffúz vs. cisztás vs. szubretinális eloszlásról, valamint a szivárgás időbeli súlyosságáról. Az FA nem nyújt kvantitatív információt a retina megvastagodásáról. Ezért nem meglepő, hogy összességében ez a kétdimenziós FA-alapú osztályozási rendszer rosszul korrelál a látással.3,4
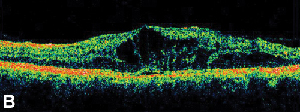
Az optikai koherencia tomográfia (OCT III, Carl Zeiss) egy érintésmentes, nem invazív képalkotó eljárás, amely hasznos kiegészítést nyújt a ME diagnosztizálásában. Közeli infravörös fénysugarat (830 nm) irányít a retina felszínére merőlegesen, és elemzi a visszaverődések tulajdonságait. A készülék 1,5 másodperc alatt egyetlen lineáris, nagy felbontású keresztmetszeti képet készít. Ezek a képek képesek megjeleníteni és még mérni is az ödémás területeken található megvastagodott, cisztás retinát. Hasznos a vitreoretinális határfelület tulajdonságainak vizualizálásában is, és hatékonyan demonstrálja, ha az üvegtesti vontatás szerepet játszik a ME kialakulásában (lásd a 2. ábrát).
Egy tanulmány 84 uveitishez másodlagos ME-ben szenvedő szem vizsgálatához használta az OCT-t, amely további előnye volt, hogy az esetek 41, illetve 20 százalékában feltárta vagy megerősítette az epiretinalis membránok és a szerózus retinaleválás jelenlétét.5 A tanulmány mérsékelt korrelációt talált a retina vastagsága és a csökkenő látásélesség között, bár a korreláció mértéke tanulmányonként változó, más kutatók gyenge,6 mérsékelt,7 és erős8,9,10 korrelációról számoltak be különböző statisztikai módszerek alkalmazásával különböző betegpopulációkban, beleértve a diabéteszes retinopátiában, uveitisben és CME-ben szenvedő betegeket.
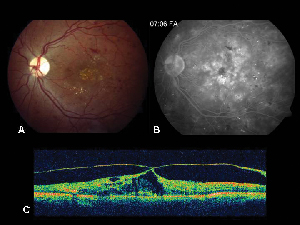
2. ábra. A. Színes fundusfelvétel egy nem proliferatív diabéteszes retinopátiában szenvedő beteg bal szeméről, a foveában és a fovea körül lipidexsudációval. B. A késői fázisú FA makulaödémát mutat a központi makulában. C. Az optikai koherencia tomográfia kimutatja a rendellenes vitreoretinális határfelületet, valamint a makulaödémát.
Egy másik csoport arról számolt be, hogy az OCT ugyanolyan hatékony, mint a FA a ME kimutatásában, és jobb, mint a FA a folyadék axiális eloszlásának leírásában.6 Az OCT képes azonosítani néhány, FA-val nem látható ME-vel rendelkező beteget is, mint például a krónikus CME bizonyos eseteiben, ahol az FA-val legjobban látható aktív szivárgás fajtája minimális vagy akár hiányzik is, vagy amikor a szemfenék vizsgálatát a médiumi opacitások jelenléte veszélyezteti, mint például asteroid hyalosisban szenvedő betegeknél.11
A retina vastagságelemző (RTA, Talia Technology, Izrael) egy hasonló, érintésmentes képalkotó technika, amely lehetővé teszi a retina vastagságának számszerűsítését. A készülék 16 párhuzamos keresztmetszeti letapogatást készít a retina 3×3 négyzet mm-es területén egy 0,3 másodperc alatt beadott ferdén irányított zöld fényimpulzus (540 nm) visszaverődésének elemzésével. Mind az OCT, mind az RTA kiváló pontosságot mutatott a retina vastagságának egyedi méréseiben, és a technológiák közvetlen összehasonlítása statisztikailag szignifikáns korrelációt mutatott a méréseik között. Bár az RTA előnye a gyors felvétel és a talán kevesebb artefaktum, úgy tűnik, hogy kevésbé hatékony a retina vastagságának mérésében, mint az OCT a médium opacitások jelenlétében.12
Egy másik vizsgálatban 30 egészséges szemen hasonlították össze a foveális vastagságot RTA-val és OCT-vel. Az egészséges szemek átlagos foveális vastagságát 181 µm-t, illetve 153 µm-t mértek az RTA és az OCT esetében. A szerzők arra a következtetésre jutottak, hogy az RTA esetenként hamisan magas értékeket produkál, és ezért az OCT-hez képest csökkent a megbízhatósága.13 Ezzel szemben egy enyhe, nem proliferatív diabéteszes retinopátiában szenvedő betegek elemzése azt mutatta, hogy az RTA érzékenyebb volt az OCT-nél a retina megvastagodásának területeinek azonosításában a diabéteszes ME kezdeti szakaszában.14
 |
 |
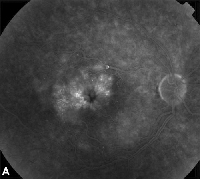
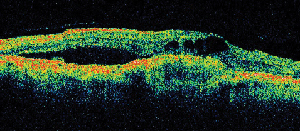
| 3. ábra. A. Késői fázisú fluoreszcein-angiogram egy cisztoid makulaödémás betegről. | B. Optikai koherencia tomográfia, amely a nagy cisztás tereket mutatja a foveánál. |
Kezelések -gyógyszeres
A szürkehályogműtétet követő ME leggyakoribb kezelése a topikus nem-szteroid gyulladáscsökkentő gyógyszerek (lásd a 3. ábrát). Ezek a szerek az intraokuláris prosztaglandinszint csökkentésére irányulnak, amely szerepet játszik a ME patogenezisében. Kettős maszkolású, randomizált, aktív és placebo-kontrollált vizsgálatokban, amelyekben szürkehályogműtéten átesett betegek vettek részt, a helyileg alkalmazott 1% indometacin, 0,03% flurbiprofen, 0,5% ketorolak és 0,1% diklofenak szemészeti készítmények gyulladáscsökkentő hatásáról számoltak be.15,16 A 0,1%-os diklofenak és a 0,5%-os ketorolak szemészeti oldatok azonban az egyetlen helyileg alkalmazott NSAID, amelyet az élelmiszer- és gyógyszerhatóság kifejezetten erre a javallatra engedélyezett. A helyi kortikoszteroidot és NSAID cseppeket kombináló terápia nagyobb hatékonyságúnak bizonyult a ME kezelésében, mint bármelyik gyógyszer önmagában.16 Bár az FDA nem hagyta jóvá, a helyi NSAID-okat gyakran alkalmazzák a szürkehályogműtét előtt a posztoperatív ME megelőzésére.
Az orális acetazolamidot alkalmanként alkalmazzák a gyulladásos állapotok és a retinitis pigmentosa következtében fellépő ME kezelésében, különösen akkor, ha a helyi NSAID-ok és a kortikoszteroidok nem használnak. Több prospektív, maszkolt, keresztirányú vizsgálatban hasonlították össze az acetazolamidot és a placebót különböző okok miatt ME-ben szenvedő betegeknél. Egy ötciklusos crossover vizsgálat 41 beteggel reprodukálható választ talált, amelyet a ME részleges vagy teljes megszűnéseként jellemeztek, az örökletes vagy gyulladásos retinabetegségben szenvedő betegek több mint felénél, de a primer retinális érbetegségben szenvedő betegeknél nem volt válasz.17 Az 500 mg/nap vagy szájon át szedhető acetazolamid hatékonyabbnak bizonyult a 250 mg/naposnál a ME kezelésében olyan betegeknél, akiknek a ME másodlagos RP miatt volt.18 Ez a vizsgálat 12 kezelt betegből 10-nél észlelt javulást.
Egy másik csoport arra a következtetésre jutott, hogy az 55 év alatti, krónikus iridocyclitisnek tulajdonított ME-ben szenvedő betegek inkább reagáltak 500 mg acetazolamidra b.i.d., mint az idősebb betegek.19 Egy nemrégiben végzett vizsgálat szerint az acetazolamid a diabetes okozta ME kezelésében is hatékony lehet.20
A kortikoszteroidok erős gyulladáscsökkentők, amelyeket gyakran alkalmaznak az ME kezelésében. Többféle hatásmechanizmusuk van, beleértve a vér-retinális gát stabilizálását és a pro-inflammatorikus mediátorok gátlását. A beadási módok közé tartozik a helyi, a periocularis injekció, az intravitreális injekció, valamint a szájon át és intravénás beadás. Bár az orális és intravénás kortikoszteroidok minden bizonnyal elérik a terápiás szintet az üvegtesten belül, a szisztémás szövődmények további kockázatának teszik ki a betegeket, ezért általában a látást veszélyeztető uveitisben szenvedő, szisztémás betegségben szenvedő betegek számára vannak fenntartva. A lokális kortikoszteroid cseppek a biztonsági spektrum másik végén helyezkednek el, de a hátsó szegmentumba való bejutásuk korlátozott.
A sub-Tenon-injekciók alternatívát kínálnak a viszonylag nagy dózisú kortikoszteroidok szembe juttatására, a szisztémás szövődmények kisebb kockázata mellett.21 Bár randomizált, kontrollált vizsgálatok nem készültek, a sub-Tenon kortikoszteroid-injekciót évek óta hatékonyan alkalmazzák a makulaödéma kezelésében. A leggyakoribb technika egy rövid 25-ga tűt használ, amelyet a superotemporalis bulbáris kötőhártyán keresztül helyeznek a tenon alatti térbe, miközben a beteg inferonazálisan néz. A tűt a szemgolyó mentén hátrafelé haladva, a véletlen behatolás elkerülése érdekében oldalirányú mozdulatokkal mozgatják, amíg a tű el nem éri a kötőhártya belépési helyét, amikor a gyógyszert beadják. Egy jelentésben 20 egymást követő, látáscsökkenéssel járó intermedier uveitisben szenvedő beteg szerepelt, akiket 40 mg triamcinolon acetonid sub-Tenon injekciójával kezeltek.22 Bár nem minden betegnél mutatkozott ME az FA-n, 67 százalékuknál egy kezelést követően két látóvonallal javult a látás. Az eljárás kockázatai közé tartozik többek között a tartósan emelkedett szemnyomás, a szürkehályog, a ptosis és az intraokuláris penetráció.
A közelmúltban a triamcinolon acetonid (Kenalog, 4,0 mg) intravitreális injekciójának alkalmazása megnőtt, mivel hatásosan képes javítani a diabetes mellitus (lásd a 4. ábrát), retina vénás elzáródások, gyulladás és egyéb idiopátiás okok miatt refrakter ME-t.23-26 Az előzetes vizsgálatok a retina megvastagodásának drámai csökkenését, a fluoreszcein szivárgás csökkenését és a látásjavulást mutatják, amely egyes betegeknél jelentős lehet. Bár a hatás átmeneti, és általában három-hat hónapig vagy annál rövidebb ideig tart, a ME általában reagál az ismételt injekcióra. Az intravitreális kortikoszteroidok alkalmazása azonban a tartósan emelkedett intraokuláris nyomás 30-40 százalékos kockázatával és a műtétet igénylő szürkehályog körülbelül 10 százalékos kockázatával jár. A Nemzeti Szemészeti Intézet jelenleg betegeket vesz fel a SCORE (standard care vs. corticosteroid for retinal vein occlusion) vizsgálatba, amely a triamcinolon intravitreális injekcióit (1- és 4 mg-os dózisban) a standard ellátással (megfigyelés és/vagy rácslézeres kezelés) hasonlítja össze a vénaelzáródás következtében ME-ben szenvedő betegeknél. A vizsgálatban összesen 1260 beteget követnek nyomon, és a kezelést 36 hónapig folytatják.
ME előfordul az időskori makuladegenerációban is (lásd az 5. ábrát). Jelenleg vizsgálják a triamcinolon-acetonid intravitreális injekciójának fotodinamikus terápiával kombinált alkalmazását a neovaszkuláris AMD kezelésére (Visudyne with intravitreal Triamcinolone Acetonide, VisTA). Egy tanulmány hangsúlyozza a PDT alkalmazását megelőző intravitreális triamcinolon alkalmazásának fontosságát makulaödémában és CNV-ben szenvedő betegeknél.27 A szerzők elmélete szerint a verteporfin a gyógyszer fotoaktiválása után a cisztás intraretinális terekbe szivároghat, ami a szomszédos, normál retina fotoreceptorkárosodásához vezethet, míg a retinaödéma előzetes feloldása megelőzheti ezt a szövődményt. A kortikoszteroid előzetes adása a PDT által kiváltott intraokuláris VEGF-szint emelkedés tompítására is szolgálhat.
Az intravitreális injekciók maguk is a súlyos, potenciálisan vakító mellékhatások kis, de határozott kockázatával járnak, beleértve a fertőző endophthalmitist, retinaleválást, vérzést, okuláris hipertóniát, szürkehályogot és hipotóniát.28 Az intravitreális injekciókra vonatkozó, nemrégiben közzétett irányelvek megpróbálják meghatározni a legjobb gyakorlatot erre az egyre gyakrabban alkalmazott technikára. A konszenzusos testület ajánlásai az injekció beadása előtti megfontolásokkal foglalkoztak, beleértve az antibiotikumokat, a glaukóma értékelését, a kesztyűhasználatot és a már meglévő szemhéj-rendellenességek kezelését, valamint a túlzott szemhéjmanipuláció elkerülésének fontosságát az eljárás előtt és alatt. Az ajánlott periinjekciós kezelés magában foglalta a helyi és/vagy kötőhártya alatti érzéstelenítő, helyi povidon-jód és szemhéjspekulum használatát. A szerzők hangsúlyozták az injekciót követő IOP-ellenőrzés és közvetlen szemfenéki vizualizáció fontosságát a látóideg perfúziójának, a triamcinolon intravitreális elhelyezkedésének, valamint az injekcióval összefüggő vérzés vagy retinaleválás hiányának ellenőrzése érdekében. Hangsúlyozták továbbá a betegek felvilágosításának fontosságát a lehetséges szövődmények korai tüneteivel és az alapos utánkövetés fontosságát.29
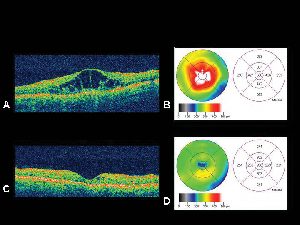
4. ábra. A. Egy diabéteszes makulaödémás szem optikai koherencia tomográfiás képe a megfelelő retina vastagságtérképpelB. az OCT által generált kép. C. OCT ugyanarról a betegről egy hónappal az intravitreális triamcinolon-acetonid injekciót követően, a megfelelő retina vastagságtérképpel. D. A makulaödéma megszűnése. A látásélesség a kezelést követően 20/200-ról 20/80-ra javult.
Számos vizsgálatokban vizsgálják a szem belsejében alkalmazható alternatív, hosszú távú kortikoszteroid adagoló eszközöket. Az egyik vizsgálatban egy műanyag szálba ágyazott fluocinolon acetonid pellet műtéti elhelyezését vizsgálják, amely három éven keresztül ellenőrzött szteroid-felszabadítást biztosít. A Bausch & Lomb és a Control Delivery Systems által Envision intravitreális implantátumként ismert, a pars planán keresztül helyezik be, és a szklerához varrják. Egy II/III. fázisú, randomizált, maszkolt vizsgálatban 80 betegnél hasonlították össze az Envision TD implantátumot a 0,5 vs. 2,0 mg fluocinolon acetonid és a lézeres fotokoagulációból vagy megfigyelésből álló standard ellátás között. Hat hónap elteltével a standard ellátáshoz képest a 0,5 mg-os implantátummal statisztikailag szignifikánsan csökkent a diabéteszes retinopátia ME-je és súlyossága. Ezenkívül nem volt különbség a súlyos nemkívánatos hatások gyakoriságában. A vizsgálat 2,0 mg-os ágát idő előtt leállították egy második vizsgálatban megfigyelt eredmények miatt, amelyben nem észleltek előnyt a 0,5 mg-hoz képest. Egy második vizsgálatba 278, nem fertőző hátsó uveitisben szenvedő beteget vontak be, akiket randomizáltak, hogy vagy 0,59 mg vagy 2,1 mg Retisert implantátumot kapjanak az érintett szembe, vagy kétoldali esetekben a súlyosabban érintett szembe. Két dózis és 34 hét elteltével az implantátummal ellátott szemekben szignifikánsan alacsonyabb volt a kiújulási arány (10 vs. 55,7 százalék, p<0,0001), és csökkent a szisztémás kortikoszteroid/immunszuppresszív terápia alkalmazása (59,0 százalék a kiinduláskor vs. 13,7 százalék 34 hét után), valamint a szubtenon- és lokális szteroid-használat. A látásélességben jelentős javulás következett be (p<0,05). A leggyakoribb nemkívánatos események közé tartozott a szürkehályog progressziója és a megnövekedett intraokuláris nyomás, amely 8,6 százalékban szűrési eljárást igényelt. (Jaffe G. Invest Ophthalmol Vis Sci. 2004; 44 ARVO E-Abstract #3369.)
Egy másik vizsgálatban az Allergan Posurdexe, egy bioerodálható dexametazon pellet szerepel, amelyet az üvegtestbe injektálnak, és amely 50-160 nap alatt szabadítja fel a gyógyszert. Egy II. fázisú vizsgálat eredményei azt mutatták, hogy mind a 350 µg-os, mind a 700 µg-os pellet szignifikánsan javította azon betegek arányát, akiknél a látás két vonallal vagy annál nagyobb mértékben javult (27,2 százalék és 35,7 százalék 350 µg és 700 µg esetében), valamint három vonallal vagy annál nagyobb mértékben (13 százalék és 19,4 százalék 350 µg és 700 µg esetében) 180 napon belül a placebóhoz képest. Eddig nem számoltak be a szürkehályog megnövekedett előfordulási gyakoriságáról, bár a betegek mintegy15 százalékánál IOP-növekedést észleltek.
Kezelések -Lézer
Legutóbb az Eyetech és a Pfizer Macugen készítményét vizsgálták egy randomizált, kettős maszkolású, multicentrikus, dózisfüggő, kontrollált II. fázisú vizsgálatban 172 diabéteszes ME-ben szenvedő betegnél. A vizsgálat három dózist (0,3 mg, 1,0 mg, 3,0 mg) vizsgált a hathetente három injekcióban adott látszatinjekcióval szemben. Míg a korábbi fókuszos/rácsos lézeres vizsgálatot végzőket arra kérték, hogy csak olyan betegeket vegyenek fel a vizsgálatba, akiknél a fókuszos/rácsos lézer legalább 12 héttel történő elhalasztását nyugodtan el tudják halasztani. További injekciókat és/vagy fokális/grid fotokoagulációt a vizsgáló belátása szerint adtak a 18. héttől a 30. hétig. A végső értékelésre a 36. héten került sor, hat héttel az utolsó tervezett injekció után. Összességében a Macugent kapó alanyok látási eredményei jobbak voltak, nagyobb valószínűséggel csökkent a retina centrális vastagsága, és kisebb valószínűséggel volt szükségük további lézeres kezelésre, mint a látszatbetegeknek.31 Jelenleg egy megerősítő III. fázisú vizsgálatot terveznek.
A fókuszos/grid lézeres fotokoaguláció továbbra is a diabéteszes ME kezelésének standardja. Az Early Treatment Diabetic Retinopathy Study kimutatta, hogy a rácsos lézerrel kezelt betegeknél a megfigyeléshez képest 50 százalékkal csökkent a mérsékelt látásvesztés, amelyet a látószög megduplázódásaként vagy háromvonalas látáscsökkenésként definiáltak.30 Bár a lézer pontos mechanizmusa, amellyel a ME-t csökkenti, nem ismert, úgy vélik, hogy elősegíti az RPE sejtek közötti szoros kötések kialakulását, valamint csökkenti a fotoreceptorok oxigénigényét és növeli a chorioidea oxigénperfúzióját.31 Az EDTRS a fókuszos lézeres fotokoagulációra alkalmas betegeket klinikailag jelentős ME-vel azonosította. Ezt úgy definiálták, hogy a következő három kritérium valamelyikének megfelelnek: 1) a foveától 500 µm-en belül elhelyezkedő retina megvastagodás; 2) a foveától 500 µm-nél kisebb távolságban lévő kemény exudátum, amely a szomszédos retina megvastagodásához társul; vagy 3) 1 korongátmérőjű vagy annál nagyobb ödémás terület, amelynek bármely része a foveától 1 korongátmérőnél kisebb távolságra van. Az EDTRS azonban nem tett különbséget a fokális ME között, amely a retina mikroaneurizmák melletti helyi megvastagodásának felel meg, és a diffúz ME között, amely a hátsó pólus általános megvastagodására utal. Az anekdotikus bizonyítékok azt mutatják, hogy a fokális diabéteszes ME jól reagál a fokális/rácsos lézerre, míg a diffúz változat gyakrabban sikertelen a lézeres kezelés és alternatív kezelést igényel.
 |
 |
| 5. ábra. A. Klasszikus subfovealis neovascularisatiót mutató korai fluoreszcein-angiogram. | B. A megfelelő optikai koherencia tomográfia a szubretinalis és intraretinalis folyadékfelhalmozódás területeit mutatja, valamint demonstrálja a neovaszkularizációt (nyíl). |
Kezelések -sebészet
A diabéteszes ME-ben szenvedő betegeknél a vitrectomia és a hátsó hyaloidális elválasztás előnyeiről beszámoló első csoport azt sugallta, hogy létezik a betegek egy alcsoportja, akiknél az üveghártya húzódása és a sekély makula leválása hozzájárul a retina megvastagodásához.32 Ezt később OCT-vel is megerősítették, ami e technika indikációinak pontosításához vezetett.33,34 A három legnagyobb sorozat35,36,37 a kevésbé invazív kezelésekre nem reagáló diabéteszes ME miatt vitrectomián átesett betegekről 59, 58, illetve 65 beteget elemzett. A betegek 47%-ának, 53%-ának, illetve 45%-ának legalább két vonallal javult a látása. Az utóbbiak a betegek kisebbségében kialakult súlyos posztoperatív szövődményekről számoltak be, köztük retinaleválás (1,5 százalék), rubeosis iridis (4,6 százalék) epiretinális membrán (13,8 százalék), visszatérő üvegtestvérzés(1,5 százalék) és foveális kemény exudátumlerakódás (4,6 százalék), míg a második csoportban feltárt szövődmények között 10,2 százalékban epiretinális membrán, a fakikus szemek 63,2 százalékában pedig szürkehályog szerepelt. Több más esetsorozat is hasonló eredményeket mutatott, azonban mindegyik nem volt randomizált, placebokontroll nélkül, és eltérő befogadási és kizárási kritériumokat alkalmaztak. Továbbá a műtéti technikák is eltérőek voltak, így a vitrectomia pontos indikációi a CME-ben szenvedő betegek esetében értelmezhetők.
AME továbbra is a látásvesztés egyik fő oka a rendelkezésre álló különféle kezelések ellenére. A lézeres fotokoaguláció továbbra is szerves részét képezi a cukorbetegség, iszkémia és érelzáródások okozta ME kezelésének. A helyi NSAID-ok és kortikoszteroidok jelenleg a posztoperatív ME ellenőrzésének elsődleges módszere, míg az acetazolamid továbbra is hatékony kezelési eszköz az uveitis és retinitis pigmentosa miatt másodlagos ME-ben szenvedő, kiválasztott betegeknél. Az intravitreális kortikoszteroidok szerepe a ME terápiájában egyre bővül, de a mellékhatások és a hatás időtartama továbbra is korlátozott. A sebészeti technikák tökéletesítése továbbra is új dimenziót ad a kevésbé invazív kezelésre nem reagáló ME-nek, míg a farmakoterápia és az okuláris gyógyszeradagolás fejlődése szerepet ígér a ME valamennyi okának és típusának megelőzésében és kezelésében.
Dr. Ober a Columbia University College of Physicians and Surgeons Edward S. Harkness Szemészeti Intézetének és a Manhattan Eye, Ear, and Throat Hospital LuEsther T. Mertz Retina Research Centerének üveghártya-sebészeti munkatársa. Elérhetősége: 210 East 64th St., 8th Fl, New York, NY 10021; e-mail: [email protected]; vagy (212) 605 3777 vagy fax: (212) 605 3795.
Dr. Klais a LuEsther T. Mertz Retina Research Center retina ösztöndíjasa. Vegye fel vele a kapcsolatot ugyanezen a címen, telefonon vagy faxszámon, vagy e-mailben a [email protected].
Dr. Cunningham a New York University, School of Medicine szemészeti klinikai professzora és az Uveitis Service igazgatója. Emellett az Eyetech Pharmaceuticals Inc. munkatársa.Keresse őt a következő címen: Vitreous-Retina-Macula Consultants of New York, 460 Park Ave., New York, N.Y. 10022, e-mailben: [email protected], vagy telefonon/faxon: (212) 861 9797.
1. Spaide RF, Yannuzzi LA, Sisco LJ. Krónikus cisztoid makulaödéma és a látásélesség előrejelzői. Ophthalmic Surg 1993;24:262-267.
2. Yannuzzi LA. Az afakikus cisztoid makulaödéma kezelésének perspektívája. Surv Ophthalmol 1984;28:540-553
3. Chang A, Spaide RF, Yannuzzi LA. Műtét utáni cisztoid makulaödéma. In: Guyer DR, Yannuzzi LA, Chang S, et al. Retina, Vitreous, Macula. Saunders. Philadelphia. 1999;1:239-255.
4. Nussenblatt RB, Kaufman SC, Palestine AG, et al. Macular thickening and visual acuity. Mérés cisztoid makulaödémás betegeknél. Ophthalmology 1987;94:1134-9.
5. Markomichelakis NN, Halkiadakis I, Pantelia E, et al. A makulaödéma mintázata uveitisben szenvedő betegeknél: minőségi és mennyiségi értékelés optikai koherencia tomográfiával. Ophthalmology 2004;111:946-53.
6. Antcliff RJ, Stanford MR, Chauhan DS, et al. Comparison between optical coherence tomography and fundus fluorescein angiography for the detection of cystoid macular edema in patients with uveitis. Ophthalmology 2000; 107:593-9.
7. Otani T, Kishi S, Maruyama Y. A diabéteszes makulaödéma mintázata optikai koherencia tomográfiával. Am J Ophthalmol 1999;127:688-93.
8. Hee MR, Puliafito CA, Wong C, et al. A makulaödéma kvantitatív értékelése optikai koherencia tomográfiával. Arch Ophthalmol 1995;113:1019-29.
9. Nussenblatt RB, Kaufman SC, Palestine AG, et al. Macular thickening and visual acuity. Mérés cisztoid makulaödémás betegeknél. Ophthalmology 1987;94:1134-9.
10. Ozdek SC, Erdinc MA, Gurelik G, et al. A diabéteszes makulaödéma optikai koherencia tomográfiás értékelése: összehasonlítás a fluoreszcein angiográfiás és klinikai leletekkel. Ophthalmologica 2005;219:86-92.
11. Browning DJ, Fraser CM. Optikai koherencia tomográfia a makulaödéma kimutatására asteroid hyalosis jelenlétében. Am J Ophthalmol 2004;137:959-961.
12. Polito A, Shah SM, Haller JA et al. A retina vastagságelemző és az optikai koherencia tomográfia összehasonlítása a foveális vastagság értékelésére makuláris betegségben szenvedő szemekben. Am J Ophthalmol 2002;134:240-51.
13. Neubauer AS, Priglinger S, Ullrich S, et al. A retinal thickness analyzerrel és optikai koherencia tomográfiával mért foveális vastagság összehasonlítása. Retina 2001;21:596-601.
14. Pires I, Bernardes RC, Lobo CL, Soares MA, Cunha-Vaz JG. Retina vastagsága enyhe, nem proliferatív retinopátiában szenvedő, 2-es típusú diabetes mellitusban szenvedő betegek szemében: a retina vastagságelemzéssel és optikai koherencia tomográfiával kapott mérések összehasonlítása. Arch Ophthalmol 2002 Oct;120(10):1301-6.
15. Flach AJ. Ciklooxigenáz-gátlók a szemészetben. Surv Ophthalmol 1992;36:259-284.
16. Heier JS, Topping TM, Baumann W, Dirks MS, Chern S. Ketorolac versus prednizolon versus kombinált terápia az akut pseudophakicus cisztoid makulaödéma kezelésében. Ophthalmology 2000;107:2034-8.
17. Cox SN, Hay E, Bird AC. A krónikus makulaödéma kezelése acetazolamiddal. Arch Ophthalmol 1988;106:1190-5.
18. Fishman GA, Gilbert LD, Fiscella RG, Kimura AE, Jampol LM. Acetazolamid a retinitis pigmentosa krónikus makulaödémájának kezelésére. Arch Ophthalmol 1989;107:1445-52.
19. Farber MD, Lam S, Tessler HH, Jennings TJ, Cross A, Rusin MM. A makulaödéma csökkentése acetazolamiddal krónikus iridocyclitisben szenvedő betegeknél: randomizált prospektív crossover vizsgálat. Br J Ophthalmol 1994;78:4-7.
20. Giusti C, Forte R, Vingolo EM, Gargiulo P. Hatékony-e az acetazolamid a diabeteses makulaödéma kezelésében? Egy kísérleti tanulmány. Int Ophthalmol 2001;24:79-88.
21. Jennings T, Rusin MM, Tessler HH, Cunha-Vaz JG. Kortikoszteroidok posterior sub-Tenon injekciója cisztoid makulaödémában szenvedő uveitises betegeknél. Jpn J Ophthalmol 1988;32:385-91.
22. Helm CJ, Holland GN. A triamcinolon acetonid hátsó subtenon injekciójának hatásai intermedier uveitisben szenvedő betegeknél. Am J Ophthalmol 1995;120:55-64.
23. Benhamou N, Massin P, Haouchine B, Audren F, et al. Intravitreális triamcinolon refrakter pseudophakicus makulaödéma kezelésére. Am J Ophthalmol 2003;135:246-9.
24. Jonas JB, Kreissig I, Degenring RF. Intravitreális triamcinolon acetonid a makulaödéma kezelésére központi retinavéna elzáródás esetén. Graefes Arch Clin Exp Ophthalmol. 2002;240:782-3.
25. 25. Martidis A, Duker JS, Greenberg PB, Rogers AH, et al. Intravitreális triamcinolon refrakter diabeteses makulaödéma kezelésére. Ophthalmology 2002; 109: 920-7.
26. 26. Scott IU, Flynn HW Jr., Rosenfeld PJ. Intravitreális triamcinolon acetonid idiopátiás cisztoid makulaödéma kezelésére. Am J Ophthalmol 2003;136:737-9.
27. 27. Freund KB, Klais CM, Eandi CM, et al. Sequenced Combined Intravitreal Triamcinolone and Indocyanine Green Angiography Guided Photodynamic Therapy for Retinal Angiomatous Proliferation. Arch Ophthalmol, In Press.
28. 28. Jager RD, Aiello LP, Patel SC, Cunningham ET Jr. Az intravitreális injekciózás kockázatai: átfogó áttekintés. Retina. 2004 Oct;24(5):676-98.
29. 29. Aiello LP, Brucker AJ, Chang S, et al. Evolving guidelines for intravitreal injections. Retina 2004 Oct;24(5 Suppl):S3-19.
30. .G.Jaffe, Fluocinolone Acetonide Uveitis Study Group. Fluocinolon acetonid intravitreális implantátum a szem hátsó szegmensét érintő Uveitis kezelésére. ARVO 2004, poszter #3369.
31. A Macugen diabéteszes retinopátia tanulmányozó csoport. Egy II. fázisú randomizált, kettős maszkolású vizsgálat a pegaptanib, egy érrendszeri endoteliális növekedési faktor ellenes aptamerrel diabéteszes makulaödéma kezelésére. Ophthalmology, In press.
32. 30. Fotokoaguláció diabéteszes makulaödéma kezelésére. Korai kezelésű diabéteszes retinopátia tanulmány 1. számú jelentése. Arch Ophthalmol 1985;103:1796-806.
33. Christoforidis JB, D’Amico DJ. A diabéteszes makulaödéma sebészi és egyéb kezelései: aktualizált adatok. Int Ophthalmol Clin 2004;44:139-60.
34. Lewis H, Abrams GW, Blumenkranz MS, Campo RV. Vitrectomia diabéteszes makulahúzódás és hátsó hyaloidális húzódással járó ödéma esetén. Ophthalmology 1992;99:753-9.
35. Kaiser PK, Riemann CD, Sears JE, Lewis H. Hátsó hyaloidális trakcióval összefüggő makuláris trakciós leválás és diabéteszes makulaödéma. Am J Ophthalmol 2001;131:44-9.
36. Lewis H. A vitrectomia szerepe a diabéteszes makulaödéma kezelésében. Am J Ophthalmol 2001;131:123-5.
37. Pendergast SD. Vitrectomia a feszes premacularis posterior hyaloiddal társuló diabéteszes makulaödéma esetén. Curr Opin Ophthalmol 1998;9:71-5.
38. Tachi N, Ogino N. Vitrectomia diffúz makulaödéma esetén diabéteszes retinopátia esetén. Am J Ophthalmol 1996;122:258-60.
39. Yamamoto T, Hitani K, Tsukahara I, Yamamoto S, et al. Early postoperative retinal thickness changes and complications after vitrectomy for diabetic macular edema. Am J Ophthalmol 2003;135:14-9.