A kobalt kémiai elemet az átmeneti fémek közé sorolják. George Brandt fedezte fel 1735-ben.

Adatok zónája
Besorolás:
 Adatok zónája
További részletek: Hő, energiák, oxidáció, reakciók,
A kobalt felfedezéseA kobaltvegyületeket már az ókor óta használják kék üveg és kerámia előállítására. Az elemet először George Brandt svéd kémikus izolálta 1735-ben. Kimutatta, hogy a kobalt elem jelenléte okozza a kék színt az üvegben, nem pedig a bizmut, ahogyan azt korábban gondolták. 1741 körül ezt írta: “Ahogyan hatféle fém van, úgy megbízható kísérletekkel azt is kimutattam… hogy hatféle félfém is van: egy új félfém, nevezetesen a kobalt regulus a higany, a bizmut, a cink, valamint az antimon és az arzén regulusai mellett.” A kobalt szó a német “kobold” szóból származik, ami koboldot vagy manót jelent. A kobalt alábbi képét Ben Mills készítette.
 HCl hozzáadása eltolja a kobalt-klorid oldat egyensúlyát és színét. A rózsaszínű Co2+ oldathoz adott HCl hatására a CoCl42- ionok kék színű oldata keletkezik. A reakció reverzibilis, és a Cl- koncentráció változásával a színek oda-vissza változnak.
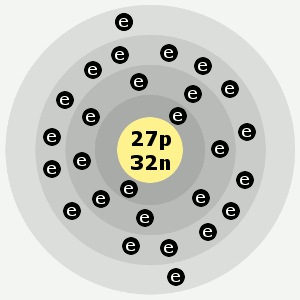
A kobalt elektronhéjai megjelenés és tulajdonságokKáros hatások: A kobalt és vegyületei bőrrel érintkezve enyhén, lenyelve pedig mérsékelten mérgezőnek minősülnek. Jellemzők: A kobalt kékesfehér, csillogó, kemény, rideg fém. Ferromágneses. A fém kémiailag aktív, számos vegyületet alkot. A kobalt az összes mágneses elem közül a legmagasabb hőmérsékletig mágneses marad (Curie-pontja 1121oC). A kobalt felhasználásaA kobaltot repülőgépmotorok alkatrészeinek ötvözeteiben és korrózió- és kopásálló ötvözetekben használják. A kobaltot széles körben használják akkumulátorokban és galvanizálásban. A kobaltsókkal kék és zöld színt kölcsönöznek üvegnek és kerámiának. A radioaktív 60Co-t a rák kezelésében használják. A kobalt számos élőlény számára nélkülözhetetlen, és a B12-vitamin egyik összetevője. A kobaltot szamárium-kobalt állandó mágnesekben is használják. Ezeket gitárhangszedőkben és nagysebességű motorokban használják. Bőség és izotópokBőség Földkéreg: 25 rész/millió tömegszázalék, 8 rész/millió mol Bőség Naprendszer: 4 rész/millió tömeg, 0,7 rész/millió mol Költség, tisztán: 21 $/100g Költség, ömlesztve: 4,40 $/100g Forrás: A természetben a kobalt szabad elemként nem fordul elő. Ásványi ércekben található. A kobalt fő ércei a kobaltit (CoAsS), az eritrit (a kobalt hidratált arzenátja), a glaukodot (Co,Fe)AsS és a skutterudit (Co,Ni)As3. A kobaltot általában a nikkel- és rézbányászat melléktermékeként állítják elő. Izotópok: A kobaltnak 22 izotópja van, amelyek felezési ideje ismert, tömegszámuk 50-től 72-ig terjed. A természetben előforduló kobalt egyetlen stabil izotópjából, az 59Co-ből áll. 
Cite this PageCite this PageOnline hivatkozáshoz, kérjük, másolja be az alábbiak egyikét: <a href="https://www.chemicool.com/elements/cobalt.html">Cobalt</a> vagy <a href="https://www.chemicool.com/elements/cobalt.html">Cobalt Element Facts</a> Az oldal tudományos dokumentumban való idézéséhez, kérjük, használja a következő MLA-konform idézést: "Cobalt." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/cobalt.html>. . |
