- Introduzione
- Metodi
- Inclusione ed esclusione dei pazienti
- Autorizzazioni protocollo standard e consensi dei pazienti
- Programma di esame
- Statistiche
- Risultati
- Frequenza di IDNA nei pazienti RLS
- Caratteristiche cliniche dei pazienti RLS con IDNA rispetto a NID
- Caratteristiche cliniche dei pazienti RLS con IDNA rispetto a IDA
- Caratteristiche ematologiche nei soggetti di controllo
- Discussione
- Caratteristiche cliniche dell’IDNA nella RLS
- Il IDNA è uno stadio iniziale prima dell’IDA nella RLS?
- Raccogliere e diagnosticare l’IDNA nella RLS
- Conclusione
- Data Availability Statement
- Ethics Statement
- Contributi degli autori
- Finanziamento
- Conflitto di interessi
- Riconoscimenti
- Materiale supplementare
- Abbreviazioni
Introduzione
La sindrome delle gambe senza riposo (RLS) è un disturbo neurologico comune (1), e la carenza di ferro gioca un ruolo chiave nella sua patogenesi (2, 3). La carenza di ferro è comune nella RLS e l’anemia da carenza di ferro (IDA) è una causa ben nota di RLS secondaria (4, 5), che è associata ad un aumento di sei volte del rischio di RLS nella popolazione generale (6). La carenza di ferro senza anemia (IDNA, anche carenza di ferro non anemica) è solitamente insidiosa, e recentemente ha attirato l’attenzione per la sua prevalenza mondiale e la sfida per la diagnosi e la gestione (7). Nonostante una chiara relazione tra significato clinico di RLS nella popolazione IDA (6), la prevalenza e le caratteristiche di IDNA in RLS non è stato studiato sistematicamente. Se IDNA rappresenta un sottogruppo di RLS e se IDNA è una fase iniziale prima di IDA in RLS è sconosciuto. In questo studio, ci proponiamo di indagare le caratteristiche cliniche di RLS con IDNA rispetto a quelli senza carenza di ferro (NID, anche carenza di ferro) e ai pazienti IDA in una coorte consecutiva di pazienti cinesi RLS.
Metodi
Inclusione ed esclusione dei pazienti
Abbiamo reclutato continuamente pazienti dalla nostra clinica specialistica RLS e dalla clinica dei disturbi del movimento del Dipartimento di Neurologia, Shanghai General Hospital, Shanghai Jiao Tong University School of Medicine tra gennaio 2017 e ottobre 2018. La RLS è stata diagnosticata secondo i criteri diagnostici dell’International Restless Legs Syndrome Study Group (RLSSG) del 2014 (1). I pazienti con altri disturbi neurologici, scarsa cooperazione o deterioramento cognitivo sono stati esclusi dallo studio. Nello stesso periodo sono stati reclutati controlli sani per età e sesso, senza anemia, nel Centro di esami sanitari del nostro ospedale. I controlli erano privi di malattie neurologiche tra cui RLS da intervista faccia a faccia.
Autorizzazioni protocollo standard e consensi dei pazienti
Lo studio è stato approvato dal Shanghai General Hospital Institutional Review Board e tutti i pazienti e controlli sani inclusi nello studio hanno dato il consenso scritto.
Programma di esame
I pazienti RLS sono stati valutati come abbiamo precedentemente descritto (8). In breve, abbiamo intervistato i pazienti faccia a faccia nel nostro ambulatorio. I pazienti considerati positivi per la RLS sono stati diagnosticati da due neurologi specializzati in RLS. Abbiamo registrato informazioni demografiche, storia, sintomi, farmaci, esami neurologici e medici generali, e MMSE per tutti i pazienti reclutati. Un questionario semi-strutturato è stato ulteriormente valutato, che comprendeva l’età di insorgenza della RLS, la storia familiare della RLS (familiarità definita come “parenti di primo grado”), il tipo e la topografia delle sensazioni, e se i sintomi della RLS erano correlati alla variazione stagionale. La gravità della RLS per 1 settimana prima dell’intervista è stata valutata utilizzando la International RLS rating scale (IRLSRS) (9). Esami come l’ecografia vascolare, velocità di conduzione nervosa, elettromiografia, ecc sono stati eseguiti se clinicamente indicato per escludere possibili mimici RLS come polineuropatie periferiche, stasi venosa, claudicazione vascolare, artrite reumatoide, e così via. Sono stati esclusi anche i soggetti con anamnesi di neurolettici o altri farmaci che gli autori hanno considerato possibilmente correlati alla RLS nei tre mesi precedenti. Abbiamo escluso quelli con comorbidità notevoli che sono stati associati con la RLS secondaria come l’insufficienza renale cronica, la gravidanza, il morbo di Parkinson, la neuropatia periferica, l’ictus e l’atassia. Sono stati valutati gli esami del sangue per l’emoglobina e lo stato del ferro periferico tra cui la ferritina sierica, il ferro, la transferrina e la capacità totale di legare il ferro (TIBC). La saturazione della transferrina (TSAT) è stata calcolata come ferro sierico/TIBC × 100. Il livello di emoglobina normale è stato definito come donne ≥ 113 g/L e uomini ≥ 131 g/L secondo il valore normale nel nostro ospedale. IDNA è definito come ferritina sierica <75 μg/L (o ferritina ≥ 75 μg/L ma TSAT <20%) con livello di emoglobina normale (10, 11). L’IDA è diagnosticata quando l’emoglobina <113 g/L (donne) o <131 g/L (uomini), così come la ferritina sierica <75 μg/L (o ferritina sierica ≥ 75 μg/L ma TSAT <20%).
Statistiche
I dati sono stati analizzati utilizzando SPSS 21.0 per Windows (IBM Co., USA). Tutti i dati sono presentati come media ± deviazioni standard. Poiché la maggior parte delle variabili non erano normalmente distribuite, il test di Kruskal-Wallis è stato utilizzato per i confronti di singole variabili tra tre gruppi, e post-hoc Mann-Whitney quando P < 0,05. Le differenze nelle proporzioni sono state analizzate dal test chi-quadrato di Pearson o dal test esatto di Fisher quando appropriato. P < 0,05 sono stati considerati significativi. Considerando i potenziali effetti della terapia farmacologica sul sintomo RLS e altre caratteristiche, abbiamo calcolato tutti i dati due volte nel totale dei pazienti RLS e nei pazienti RLS senza farmaci, rispettivamente.
Risultati
Abbiamo continuamente arruolato un totale di 196 pazienti RLS primari senza anemia (IDNA RLS e NID RLS) in questo studio, compresi 66 pazienti maschi (33,7%) e 130 pazienti donne (66,3%). L’età media era di 53,0 ± 13,5 anni. Il 65,8% (129/196) dei pazienti RLS non stavano assumendo farmaci per la RLS (109 drug-naïve, e 20 senza farmaci per più di 2 settimane al momento dell’intervista). Abbiamo anche incluso 26 pazienti RLS con IDA (22 drug-naïve). Abbiamo escluso cinque pazienti RLS anemici (Hb <113 g/L per le donne e Hb <131 g/L per gli uomini) che non avevano prove di carenza di ferro (ferritina sierica ≥ 75 μg/L così come TIBC ≥ 20%, ferritina sierica media come 236.1 ± 119.3 μg/L). Nessuno dei pazienti RLS con IDA aveva segni di infezione, e le cause di IDA RLS sono stati elencati (Tabella 1). Inoltre, abbiamo raccolto 63 soggetti di controllo sani, tra cui 22 soggetti di sesso maschile (34,9%) e 41 soggetti di sesso femminile (65,1%), e l’età media del gruppo di controllo era di 51,0 ± 12,0 anni (l’età media di 51,0 ± 10,4 e 51,0 ± 12,8 per maschi e femmine, rispettivamente). Non ci sono state differenze significative sia nel sesso (RLS vs. controllo: 66,3 vs. 65,1% per le donne, P > 0,05) e l’età (RLS vs. controllo: 53,0 ± 13,5 vs. 51,0 ± 12,0, P > 0,05) tra i pazienti RLS e controlli. Informazioni demografiche dettagliate dei pazienti con RLS in ogni gruppo sono mostrati (Tabella 2).
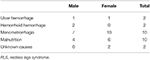
Tabella 1. Possibili cause di carenza di ferro in pazienti anemici RLS.
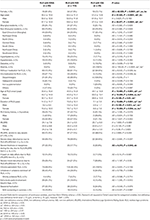
Tabella 2. Informazioni demografiche e caratteristiche cliniche dei pazienti RLS con IDNA, NID e IDA.
Frequenza di IDNA nei pazienti RLS
Dei 196 pazienti RLS (130 donne, 66 uomini) senza anemia o altre comorbidità, 83 (42,3%) avevano carenza di ferro. Prevalenza di IDNA nelle donne (58.5%, 76/130) è molto più alto che negli uomini (10.6%, 7/66) in questa coorte di pazienti RLS senza anemia (Tabella 2), con un rischio relativo di 5.51 (95% intervallo di confidenza 2.70-11.27, p < 0.0001).
Caratteristiche cliniche dei pazienti RLS con IDNA rispetto a NID
Nelle pazienti RLS di sesso femminile senza anemia, il gruppo IDNA aveva un’età più giovane sia all’intervista che all’esordio della RLS rispetto al gruppo NID (P < 0.01; Tabella 2). Anche se non vi era alcuna differenza sulla gravità della RLS da IRLSRS, abbiamo trovato più pazienti con grave / molto grave stanchezza o sonnolenza durante il giorno nel gruppo IDNA rispetto al gruppo NID (32,5 vs 17,7%, P < 0,05; Tabella 2). Non c’era alcuna differenza per quanto riguarda la storia familiare, la gravità, la lateralità, la posizione e la fluttuazione stagionale di RLS tra IDNA e gruppo NID, né negli uomini né nelle donne. Il gruppo IDNA RLS ha presentato più bassa ferritina sierica (maschio e femmina, P < 0.0001) così come più alti valori di transferrina e TIBC (femmina, P < 0.0001) rispetto al gruppo NID RLS (Figura 1, Tabella 3).
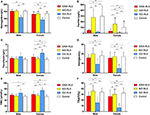
Figura 1. I parametri ematologici e di ferro per gruppo e sesso (A) emoglobina. (B) Ferritina. (C) Transferrina. (D) Ferro. (E) TIBC. (F) TSAT. **P < 0.01, *P < 0.05, test Kruskal-Wallis e post-hoc Mann-Whitney test. Dati confrontati tra IDNA RLS (n = 83), NID RLS (n = 113), IDA RLS (n = 26), e controlli (n = 63). ##P < 0.01, #P < 0.05, Mann-Whitney U-test. Dati confrontati tra maschi e femmine in ogni gruppo di IDNA RLS, NID RLS, IDA RLS, e controlli. Carenza di ferro è stato definito come livello di ferritina <75 μg/L, o ferritina 75 μg/L, tuttavia TSAT <20%. IDA, anemia da carenza di ferro; IDNA, carenza di ferro senza anemia; NID, non ferro carente; RLS, sindrome delle gambe senza riposo; TIBC, capacità totale di legare il ferro; TSAT, saturazione della transferrina.
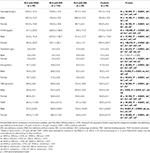
Tabella 3. Dati ematologici dei pazienti RLS con IDNA, NID, IDA, e controlli.
Dopo aver escluso i pazienti RLS sottoposti a farmaci per RLS, il gruppo IDNA RLS ha ancora mostrato tassi più elevati di stanchezza diurna grave/molto grave / sonno rispetto al gruppo NID RLS, anche se non un livello significativo (35 vs 18.8%, P = 0.078). Altre caratteristiche tra IDNA RLS e NID RLS erano simili (Tabella supplementare 1).
Caratteristiche cliniche dei pazienti RLS con IDNA rispetto a IDA
Il gruppo IDA aveva parametri metabolici del ferro sierico più gravemente disturbati rispetto al gruppo IDNA, compresa la ferritina inferiore (maschio, P < 0.05; femmina, P < 0.0001), più alta transferrina (femmina, P < 0.0001), ferro inferiore (maschio, P < 0.05; femmina, P < 0.0001), più alto TIBC (femmina, P < 0.0001), e inferiore TSAT (maschio, P < 0.05; femmina, P < 0.0001) valori nel siero (Figura 1, Tabella 3). IDNA RLS aveva una durata della malattia più lunga (P < 0,01 negli uomini, P < 0,05 nelle donne) e un’età più giovane all’esordio (significativo solo negli uomini con P < 0,05) rispetto a IDA RLS. Non ci sono state differenze per quanto riguarda la storia familiare positiva, la gravità (IRLSRS), la lateralità, la localizzazione e la fluttuazione stagionale della RLS tra IDNA RLS e IDA RLS, sia negli uomini che nelle donne RLS (Tabella 2). I risultati erano simili dopo aver escluso i pazienti RLS con farmaci per RLS (Tabella supplementare 1).
Caratteristiche ematologiche nei soggetti di controllo
I criteri diagnostici per la carenza di ferro sono diversi tra la popolazione generale e i pazienti RLS (come discussione sotto). Secondo il valore di cut-off del nostro ospedale per la carenza di ferro nella popolazione generale (20 μg/L), abbiamo trovato nessuno dei soggetti maschi nel gruppo di controllo aveva carenza di ferro, mentre quattro soggetti di controllo femminile ha mostrato carenza di ferro (due soggetti con ferritina sierica <20 μg/L, e due soggetti con ferritina ≥ 20 μg/L ma TSAT <20%). Non c’era alcuna differenza significativa di prevalenza di carenza di ferro nei controlli tra uomini (0%, 0/22) e donne (9.8%, 4/41; P = 0.288). I test ematologici sull’emoglobina e i parametri del ferro nel gruppo di controllo erano più simili con il gruppo NID RLS rispetto al gruppo IDNA o IDA (Figura 1, Tabella 3).
Discussione
La fisiopatologia della RLS primaria e secondaria è incompletamente compresa. La carenza di ferro nel cervello ha un ruolo fondamentale nella patogenesi della RLS, e le condizioni caratterizzate da carenza sistemica di ferro, come l’anemia e la gravidanza, sono associate ad una maggiore prevalenza di sintomi RLS (2, 3, 5, 6). IDA è una comorbidità riconosciuta associata alla RLS secondaria (4-6, 12). L’IDNA è più insidiosa, e le sue caratteristiche sono meno note nei pazienti RLS.
Caratteristiche cliniche dell’IDNA nella RLS
In generale, le donne sono più suscettibili alla RLS (1, 13, 14). Le donne in età fertile sono anche più carenti di ferro rispetto agli uomini nella popolazione generale (15). In questo studio sui pazienti RLS senza anemia, abbiamo anche trovato una significativa discriminazione dipendente dal sesso. I pazienti RLS di sesso femminile sono a rischio molto più elevato per IDNA rispetto ai pazienti RLS di sesso maschile (rischio relativo di 5,51, p < 0,0001). Meno pazienti maschi RLS soffrivano di carenza di ferro, con o senza anemia. Nei controlli, anche se senza una significatività statistica, abbiamo trovato 9.8% dei soggetti di sesso femminile ha sofferto di carenza di ferro, mentre nessuno dei soggetti di sesso maschile ha fatto. La carenza di ferro non è comune nel genere maschile, quindi se i pazienti maschi RLS hanno carenza di ferro, ulteriori indagini dovrebbero essere fatte per valutare le cause secondarie come l’emorragia cronica e la malnutrizione a causa di disturbi gastrointestinali.
Quando confrontato con il gruppo “normale” NID RLS, il gruppo IDNA RLS ha mostrato una più precoce età di insorgenza RLS e una più giovane età al colloquio nelle donne, ma non negli uomini (Tabella 2). In uno studio precedente, abbiamo scoperto che la RLS ad esordio precoce ha dimostrato una storia familiare di RLS più positiva e parametri periferici del ferro più gravemente disturbati (ferritina sierica più bassa, e valori più alti di transferrina e TIBC nel siero) rispetto alla RLS ad esordio tardivo (8). Recentemente, abbiamo trovato IDNA in RLS predice alcuni fattori genetici rispetto a NID in RLS (dati non pubblicati). Un potenziale sottotipo in associazione con il background genetico, la carenza di ferro e la RLS ad esordio precoce merita ulteriori indagini. Affaticamento, debolezza, difficoltà di concentrazione, diminuzione della memoria e scarso rendimento lavorativo sono sintomi aspecifici spesso associati alla carenza di ferro (7, 16). Allen et al. (6) hanno precedentemente riportato che i malati di IDA con RLS hanno mostrato più stanchezza, una qualità del sonno più scadente e una minore energia diurna rispetto ai pazienti IDA senza RLS. Abbiamo trovato che i pazienti RLS con IDNA erano anche più probabilità di soffrire di manifestazioni di stanchezza grave / molto grave o sonnolenza durante il giorno a causa di RLS rispetto ai pazienti RLS con NID (cut-off point a 75 μg/L, 32,5 vs 17,7%, P < 0,05, Tabella 2). Quando analizzato di nuovo solo in pazienti RLS senza farmaci, i pazienti RLS IDNA ancora mostrato una tendenza di più suscettibile di giorno grave / molto grave stanchezza o sonnolenza, anche se non raggiungere una significatività statistica (35 vs 18.8%, P = 0.078, Tabella supplementare 1). Nessuna differenza di stanchezza diurna grave/molto grave o sonnolenza è stato trovato tra IDNA RLS e IDA RLS in questo studio (Tabella 2). Deposito di ferro impoverito, lungo un continuum da IDA a IDNA, è associato a una ridotta attività degli enzimi ferro dipendenti, ridotta capacità ossidativa cellulare, così come diminuita efficienza energetica (17-19). Quando abbiamo usato una definizione più rigorosa per IDNA (valore di cut-off della ferritina sierica fissato a 50 μg/L), abbiamo ancora trovato più pazienti RLS IDNA sofferto di stanchezza grave / molto grave o sonnolenza durante il giorno rispetto ai pazienti RLS NID (32,3 vs 19,8%), tuttavia questo non era significativo (P > 0,05; Tabella supplementare 2). Movimento periodico delle gambe nel sonno (PLMS) è strettamente correlato alla RLS, e locus all’interno del gene BTBD9 è correlato al rischio di entrambi PLMS e RLS (20, 21). In particolare, abbiamo valutato solo la qualità del sonno utilizzando il subitem 4 della IRLSRS, e non abbiamo eseguito una valutazione dettagliata dello stato del sonno utilizzando la misura della polisonnografia (PSG). Di conseguenza, non erano disponibili i dati del PLMS e di altri parametri relativi al sonno, che possono contribuire significativamente alla stanchezza o alla sonnolenza diurna. Pertanto, l’associazione tra stanchezza/sonnolenza diurna e IDNA necessita di ulteriori indagini. Non abbiamo trovato differenze significative nella gravità della RLS tra il gruppo IDNA e il gruppo NID. La carenza periferica di ferro aumenta il rischio di prevalenza di RLS in studi clinici precedenti (6). Concentrazioni ridotte di ferro nel siero diminuiscono globalmente i livelli di ferro nel cervello, e il trattamento con ferro beneficia i pazienti RLS con bassi livelli di ferro periferico (10). Tuttavia, numerosi pazienti RLS senza carenza sistemica di ferro mostrano ancora un deficit di ferro specifico del cervello (22). Gli studi sui roditori hanno riferito che lo stato del ferro nel siero non era correlato con i livelli regionali di ferro nel cervello, quindi può essere limitatamente correlato alle caratteristiche della RLS (23, 24).
Il IDNA è uno stadio iniziale prima dell’IDA nella RLS?
La carenza di ferro può essere classificata in due livelli, IDNA e IDA, secondo il valore di misurazione dell’emoglobina. In questo studio, i pazienti RLS con IDA avevano i più bassi livelli di emoglobina, ferritina e ferro, così come i più alti valori di transferrina e TIBC rispetto ai RLS IDNA e RLS NID (Figura 1, Tabella 3). Anche se non c’erano differenze significative sui livelli di emoglobina tra RLS IDNA e RLS NID (sia nei pazienti RLS maschi che femmine), l’emoglobina sierica nei pazienti RLS IDNA erano più bassi rispetto ai controlli (solo nella femmina, P < 0,05, Figura 1, Tabella 3). Inoltre, i valori dei parametri del ferro nel gruppo IDNA RLS erano tra quelli del NID RLS o il gruppo di controllo e il gruppo IDA RLS (Figura 1, Tabella 3). Questi risultati sono coerenti con il punto di vista di IDNA è una carenza di ferro più lieve prima dello sviluppo di anemia. Da notare, i parametri del ferro sierico sono considerati che riflettono lo stato periferico del ferro principalmente negli eritroni (25), mentre l’immagazzinamento del ferro in altri organi (come il fegato, il cervello, ecc.) deve essere convalidato nei soggetti IDNA.
Tuttavia, le cause e le caratteristiche di IDNA RLS e IDA RLS non sono completamente simili. In questo studio, la maggior parte dei pazienti RLS con IDA aveva notevoli comorbidità associate a malnutrizione o cronica eccessiva perdita di sangue, tra cui emorragia del tratto alimentare, emorragia emorroidaria, e menorragia (Tabella 1), che è in linea con lo studio precedente (12). Vale la pena notare che la menorragia è una causa comune di IDA nelle donne in età riproduttiva, che può essere successiva a fibromi uterini, adenomiosi e altri disturbi ginecologici. La malnutrizione può essere secondaria a disturbi gastrointestinali, dieta vegetariana e idee sbagliate riguardo all’immagine del proprio corpo nelle giovani donne. Così, la carenza di ferro nella maggior parte dei pazienti RLS IDA in questo studio sono “carenza assoluta di ferro”. Al contrario, i pazienti RLS con IDNA di solito non hanno comorbidità degne di nota. Le cause della RLS IDNA sono insidiose e la IDNA nella RLS appartiene generalmente all’ambito della RLS primaria (4) associata a “carenza di ferro funzionale”. Tuttavia, non possiamo escludere eventuali cause secondarie insidiose nei pazienti RLS IDNA, che possono portare ad un inadeguato apporto di ferro nel corpo.
Rispetto alla RLS con IDNA, i pazienti con IDA avevano un’età più avanzata di insorgenza della RLS, così come una più breve durata della RLS sia nel maschio che nella femmina (più significativa nel maschio; Tabella 2), che era in accordo con il punto di vista che la RLS secondaria di solito ha un’età di insorgenza più avanzata (26). Secondo la nostra esperienza, questi pazienti IDA RLS con cause notevoli (come la perdita di sangue acuta) di solito dimostrano una durata più breve della malattia e un recupero più rapido o sollievo quando i disturbi comorbidi trattabili vengono corretti e lo stato del ferro ripristinato. Di solito non richiedono una terapia RLS a lungo termine, che sono un po’ diversi dai pazienti RLS primari. Futuri studi longitudinali sono necessari per confermare gli effetti del trattamento del supplemento di ferro nei pazienti RLS con IDA. Altri studi sulla RLS in comorbilità con la gravidanza (27) e l’uremia (28) hanno riportato un miglioramento dopo il parto e il trapianto renale, suggerendo che i cambiamenti nei fattori metabolici associati possono innescare la RLS nei soggetti suscettibili (5).
Quindi, ci sono eterogeneità sia nella RLS IDA che nella RLS IDNA. Sebbene l’IDNA sia generalmente considerato uno stadio precoce che precede l’anemia (7), l’IDNA RLS non è probabilmente semplicemente uno stadio prodromico che precede l’IDA RLS.
Raccogliere e diagnosticare l’IDNA nella RLS
Anche se la biopsia del midollo osseo è considerata il miglior indicatore dello stato del ferro, è raramente eseguita a causa dei potenziali rischi di infezione o sanguinamento nel sito della biopsia (29). Gli indicatori di laboratorio più usati per lo stato del ferro sono la ferritina, che riflette le riserve di ferro dei tessuti o l’adeguatezza del ferro prontamente disponibile per l’eritropoiesi (30). Sebbene la ferritina sierica sia un marcatore sensibile per valutare le riserve di ferro del corpo totale, altre condizioni come lo stato infiammatorio, l’età e la funzione renale possono essere confondenti, aumentando i livelli di ferritina sierica (31). La ferritina e la transferrina sono anche reagenti di fase acuta, e il livello di ferritina potrebbe aumentare e i livelli di transferrina diminuire in condizioni infiammatorie (32). Pertanto, anche la ferritina sierica ≥ 75 μg/L e TSAT <20% potrebbe ancora avere una reale carenza di ferro (11, 33).
Un cut off di concentrazione di ferritina sierica di <30 μg/L è più sensibile e specifico per identificare una potenziale carenza di ferro nella popolazione generale (17, 18), e IDNA è classificato come avente livelli di emoglobina normali con livelli di ferritina diminuiti (<20 μg/L) (34, 35). I laboratori clinici di solito fissano il limite inferiore dell’intervallo di riferimento per la ferritina sierica a 10-20 μg/L nella popolazione comune (36) (il limite inferiore è fissato a 20 μg/L nel nostro ospedale). Livelli di soglia significativamente più alti per la ferritina sierica sono di solito utilizzati per definire la carenza di ferro nei disturbi cronici come l’insufficienza cardiaca e la malattia renale cronica (7, 17). Il criterio di valutazione per definire la carenza di ferro nella RLS è anche diverso da quello nei controlli sani, anche se il valore esatto di cut-off per la ferritina per indicare l’IDNA nella RLS non ha ancora raggiunto il consenso. Studi recenti suggeriscono che i pazienti RLS dovrebbero essere considerati carenti di ferro quando la loro concentrazione di ferritina è inferiore a 75 μg/L (10, 11, 27). Tuttavia, gli studi precedenti hanno per lo più determinato la concentrazione di ferritina sotto i 50 μg/L come “basso stato di ferro” nella RLS (37, 38). Poiché non sono disponibili dati sulle descrizioni dei diversi cut off point, abbiamo confrontato le caratteristiche della RLS IDNA e della RLS NID usando sia 75 che 50 μg/L come valori di cut off della ferritina per la carenza di ferro. Abbiamo trovato che quando si usa 50 μg/L come limite inferiore della ferritina, il 33,2% (65/196) dei pazienti RLS soddisfa i criteri di IDNA. I risultati erano abbastanza simili per le due soglie utilizzate, tranne che l’aumento della stanchezza grave/molto grave o sonnolenza durante il giorno in IDNA RLS rispetto alla RLS NID non era significativo quando il valore di cut-off della ferritina è stato fissato a 50 μg/L (Tabella 2, Tabella supplementare 2).
Il nostro studio ha avuto alcune limitazioni: In primo luogo, questo era uno studio trasversale e la mancanza di dati longitudinali ha reso difficile identificare l’evoluzione dei sintomi RLS e gli effetti del trattamento. Inoltre, ci può essere un bias di richiamo. In secondo luogo, questo era uno studio di un solo centro, poiché circa un quarto dei pazienti erano residenti a Shanghai e la maggior parte dei pazienti proveniva dalla Cina orientale. Considerando un vasto territorio in Cina e possibili vari fattori ambientali, ci può essere un bias di selezione. In terzo luogo, non abbiamo eseguito la misurazione PSG per valutare lo stato dettagliato del sonno nei pazienti RLS e nei controlli. In quarto luogo, circa un terzo dei pazienti RLS in questo studio erano in terapia con dopaminergici e/o gabapentin enacarbil (solo un paziente stava ricevendo una terapia supplementare con ferro), che può influenzare le caratteristiche cliniche. Tuttavia, abbiamo calcolato di nuovo tutti i dati in pazienti RLS senza farmaci e abbiamo tratto la stessa conclusione. Detto questo, il nostro studio ha alcuni vantaggi. Abbiamo studiato in dettaglio lo spettro clinico della RLS ed escluso altre comorbidità o mimici della RLS. Abbiamo intervistato ogni paziente faccia a faccia, e abbiamo accuratamente escluso i pazienti RLS atipici durante il follow-up. Ci sono stati studi limitati sulle caratteristiche di IDNA nella RLS, abbiamo esplorato le caratteristiche cliniche dettagliate di IDNA in pazienti cinesi consecutivi RLS.
Conclusione
IDNA è frequente nei pazienti con RLS soprattutto nelle donne e ha alcune caratteristiche cliniche speciali. L’IDNA ha un’età più giovane sia al momento dell’intervista che all’esordio della RLS rispetto alla NID nelle pazienti RLS di sesso femminile. IDNA non è molto comune nei pazienti maschi con RLS e gli uomini con carenza di ferro dovrebbero essere valutati per i disturbi in comorbilità. Le caratteristiche dei pazienti RLS con IDNA sono diverse dalla RLS con IDA. La RLS con IDNA rappresenta un importante e trascurato problema di salute pubblica che merita maggiore attenzione clinica e dovrebbe essere affrontato nella strategia di trattamento. Lo screening regolare dei parametri periferici del ferro anche nei pazienti con emocromo normale è raccomandato per una terapia appropriata e tempestiva.
Data Availability Statement
I set di dati generati per questo studio sono disponibili su richiesta all’autore corrispondente.
Ethics Statement
Gli studi che coinvolgono partecipanti umani sono stati rivisti e approvati dal Shanghai General Hospital Institutional Review Board. I pazienti/partecipanti hanno fornito il loro consenso informato scritto per partecipare a questo studio.
Contributi degli autori
X-YZ ideazione/disegno/esecuzione del progetto/stesura del manoscritto. T-TW: esecuzione del progetto/raccolta e interpretazione dei dati/redazione del manoscritto. H-MW e JS: misure di laboratorio. XL, L-YN, T-JC e M-YQ: esecuzione del progetto/raccolta e interpretazione dei dati. TL e WO: revisione critica del manoscritto per importanti contenuti intellettuali. Y-CW: concezione/design/supervisione del progetto, revisione critica del manoscritto per importanti contenuti intellettuali. Tutti gli autori: preparazione del manoscritto.
Finanziamento
Questo lavoro è stato sponsorizzato dalla Shanghai Municipal Planning Commission of Science and Research Fund (201740017), il Clinical Research Innovation Plan of Shanghai General Hospital (CTCCR-2018C02), il Programma interdisciplinare della Shanghai Jiao Tong University (YG2015QN21), e National Natural Science Foundation of China (No. 81671251).
Conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Riconoscimenti
Ringraziamo tutti i pazienti e soggetti sani di controllo che hanno partecipato a questo studio. Ringraziamo il personale del Physical Examination Center dello Shanghai General Hospital. Ringraziamo anche il Dipartimento di Bioinformatica e Biostatistica, Scuola di Scienze della Vita e Biotecnologie, Shanghai Jiao Tong University, Yue Zhang per la consultazione statistica.
Materiale supplementare
Il materiale supplementare per questo articolo può essere trovato online su: https://www.frontiersin.org/articles/10.3389/fneur.2020.00298/full#supplementary-material
Abbreviazioni
CI, intervallo di confidenza; IRLSSG, International Restless Legs Study Group; MMSE, Mini-Mental State Examination; NID, senza carenza di ferro; RLS, restless legs syndrome; IDA, iron deficiency anemia; IDNA, iron deficiency without anemia; IRLSRS, International Restless Legs Syndrome Rating Scale; TIBC, total iron binding capacity; TSAT, transferrin saturation.
1. Allen RP, Picchietti DL, Garcia-Borreguero D, Ondo WG, Walters AS, Winkelman JW, et al. Restless legs syndrome/Willis-Ekbom criteri diagnostici: aggiornato International Restless Legs Syndrome Study Group (RLSSG) criteri di consenso storia, logica, descrizione e significato. Sleep Med. (2014) 15:860-73. doi: 10.1016/j.sleep.2014.03.025
CrossRef Full Text | Google Scholar
2. Connor JR, Boyer PJ, Menzies SL, Dellinger B, Allen RP, Ondo WG, et al. L’esame neuropatologico suggerisce l’acquisizione di ferro del cervello compromessa nella sindrome delle gambe senza riposo. Neurologia. (2003) 61:304-9. doi: 10.1212/01.WNL.0000078887.16593.12
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Allen RP, Earley CJ. Il ruolo del ferro nella sindrome delle gambe senza riposo. Mov disord. (2007) 18(22 Suppl):S440-8. doi: 10.1002/mds.21607
CrossRef Full Text | Google Scholar
4. Trenkwalder C, Allen R, Hogl B, Clemens S, Patton S, Schormair B, et al. Comorbidità, trattamento e fisiopatologia nella sindrome delle gambe senza riposo. Lancet Neurol. (2018) 17:994-1005. doi: 10.1016/S1474-4422(18)30311-9
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Trenkwalder C, Allen R, Hogl B, Paulus W, Winkelmann J. Sindrome delle gambe senza riposo associata a grandi malattie: una revisione sistematica e nuovo concetto. Neurologia. (2016) 86:1336-43. doi: 10.1212/WNL.00000000002542
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Allen RP, Auerbach S, Bahrain H, Auerbach M, Earley CJ. La prevalenza e l’impatto della sindrome delle gambe senza riposo in pazienti con anemia da carenza di ferro. Am J Hematol. (2013) 88:261-4. doi: 10.1002/ajh.23397
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Soppi ET. Carenza di ferro senza anemia: una sfida clinica. Clin Case Rep. (2018) 6:1082-6. doi: 10.1002/ccr3.1529
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Zhu XY, Wu TT, Wang HM, Ni LY, Li X, Liu Y, et al. Caratteristiche cliniche e sottotipi di sindrome delle gambe senza riposo nella popolazione cinese: uno studio di 359 pazienti. Sleep Med. (2019) 59:15-23. doi: 10.1016/j.sleep.2019.01.053
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Walters AS, LeBrocq C, Dhar A, Hening W, Rosen R, Allen RP, et al. International Restless Legs Syndrome Study, Validation of the International Restless Legs Syndrome Study Group rating scale for restless legs syndrome. Sleep Med. (2003) 4:121-32. doi: 10.1016/S1389-9457(02)00258-7
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Allen RP, Picchietti DL, Auerbach M, Cho YW, Connor JR, Earley CJ, et al. International Restless Legs Syndrome Study, Evidence-based and consensus clinical practice guidelines for the iron treatment of restless legs syndrome/Willis-Ekbom disease in adults and children: an IRLSSG task force report. Sleep Med. (2018) 41:27-44. doi: 10.1016/j.sleep.2017.11.1126
CrossRef Full Text | Google Scholar
11. Trenkwalder C, Winkelmann J, Oertel W, Virgin G, Roubert B, Mezzacasa A, et al. Carbossimaltosio ferrico in pazienti con sindrome delle gambe senza riposo e carenza di ferro non anemica: uno studio randomizzato. Mov Disord. (2017) 32:1478-82. doi: 10.1002/mds.27040
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Mehmood T, Auerbach M, Earley CJ, Allen RP. Risposta al ferro per via endovenosa in pazienti con anemia da carenza di ferro (IDA) e sindrome delle gambe senza riposo (malattia di Willis-Ekbom). Sonno Med. (2014) 15:1473-6. doi: 10.1016/j.sleep.2014.08.012
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Thomas K, Watson CB. Sindrome delle gambe senza riposo nelle donne: una revisione. J Womens Health. (2008) 17:859-68. doi: 10.1089/jwh.2007.0515
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Ohayon MM, O’Hara R, Vitiello MV. Epidemiologia della sindrome delle gambe senza riposo: una sintesi della letteratura. Sleep Med Rev. (2012) 16:283-95. doi: 10.1016/j.smrv.2011.05.002
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Umbreit J. Carenza di ferro: una revisione concisa. Am J Hematol. (2005) 78:225-31. doi: 10.1002/ajh.20249
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Sawada T, Konomi A, Yokoi K. Carenza di ferro senza anemia è associata a rabbia e fatica in giovani donne giapponesi. Biol Trace Elem Res. (2014) 159:22-31. doi: 10.1007/s12011-014-9963-1
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Camaschella C. Anemia da carenza di ferro. N Engl J Med. (2015) 372:1832-43. doi: 10.1056/NEJMra1401038
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Lopez A, Cacoub P, Macdougall IC, Peyrin-Biroulet L. Anemia da carenza di ferro. Lancet. (2016) 387:907-16. doi: 10.1016/S0140-6736(15)60865-0
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Haas JD, Brownlie T. Carenza di ferro ridotta capacità lavorativa: una revisione critica della ricerca per determinare un rapporto causale. J Nutr. (2001) 131:676S-88S; discussione 688S-90S. doi: 10.1093/jn/131.2.676S
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Stefansson H, Rye DB, Hicks A, Petursson H, Ingason A, Thorgeirsson TE, et al. Un fattore di rischio genetico per i movimenti periodici degli arti nel sonno. N Engl J Med. (2007) 357:639-47. doi: 10.1056/NEJMoa072743
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Li G, Tang H, Wang C, Qi X, Chen J, Chen S, et al. Associazione di BTBD9 e MAP2K5/SKOR1 con la sindrome delle gambe senza riposo nella popolazione cinese. Sleep. (2017) 40:zsx028. doi: 10.1093/sleep/zsx028
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Earley CJ, Connor J, Garcia-Borreguero D, Jenner P, Winkelman J, Zee PC, et al. Alterata omeostasi del ferro del cervello e la funzione dopaminergica nella sindrome delle gambe senza riposo (Willis-Ekbom malattia). Sonno Med. (2014) 15:1288-301. doi: 10.1016/j.sleep.2014.05.009
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Erikson KM, Pinero DJ, Connor JR, Barba JL. Concentrazioni regionali di ferro del cervello, ferritina e transferrina durante la carenza di ferro e la ricostituzione del ferro nei ratti in via di sviluppo. J Nutr. (1997) 127:2030-8. doi: 10.1093/jn/127.10.2030
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Yin L, Unger EL, Jellen LC, Earley CJ, Allen RP, Tomaszewicz A, et al. Sistemi di analisi genetica della risposta multivariata alla carenza di ferro nei topi. Am J Physiol Regul Integr Comp Physiol. (2012) 302:R1282-96. doi: 10.1152/ajpregu.00634.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Hallberg L, Hulthen L. Prospettive di assorbimento del ferro. Sangue Cellule Mol Dis. (2002) 29:562-73. doi: 10.1006/bcmd.2002.0603
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Shukla G, Gupta A, Pandey RM, Kalaivani M, Goyal V, Srivastava A, et al. Quali caratteristiche differenziano la sindrome delle gambe senza riposo unilaterale da quella bilaterale? Uno studio osservazionale comparativo di 195 pazienti. Sonno Med. (2014) 15:714-9. doi: 10.1016/j.sleep.2014.01.025
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Picchietti DL, Hensley JG, Bainbridge JL, Lee KA, Manconi M, McGregor JA, et al. International Restless Legs Syndrome Study, Consensus clinical practice guidelines for the diagnosis and treatment of restless legs syndrome/Willis-Ekbom disease during pregnancy and lactation. Sleep Med Rev. (2015) 22:64-77. doi: 10.1016/j.smrv.2014.10.009
CrossRef Full Text | Google Scholar
28. Winkelmann J, Stautner A, Samtleben W, Trenkwalder C. Corso a lungo termine della sindrome delle gambe senza riposo in pazienti in dialisi dopo il trapianto di rene. Mov Disord. (2002) 17:1072-6. doi: 10.1002/mds.10231
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Bain BJ. Morbilità della biopsia del midollo osseo: revisione del 2003. J Clin Pathol. (2005) 58:406-8. doi: 10.1136/jcp.2004.022178
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Baynes RD. Valutazione dello stato del ferro. Clin Biochem. (1996) 29:209-15. doi: 10.1016/0009-9120(96)00010-K
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Desiderio JB. Valutare lo stato del ferro: oltre la ferritina sierica e la saturazione della transferrina. Clin J Am Soc Nephrol. (2006) 1(1 Suppl):S4-8. doi: 10.2215/CJN.01490506
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Tietz NW, Rinker AD, Morrison SR. Quando un ferro sierico è davvero un ferro sierico? Lo stato delle misurazioni del ferro nel siero. Clin Chem. (1994) 40:546-1. doi: 10.1093/clinchem/40.4.546
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Mackie S, Winkelman JW. Ferritina normale in un paziente con carenza di ferro e RLS. J Clin Sleep Med. (2013) 9:511-3. doi: 10.5664/jcsm.2680
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Leonard AJ, Chalmers KA, Collins CE, Patterson AJ. Confronto di due dosi di ferro elementare nel trattamento della carenza di ferro latente: efficacia, effetti collaterali e capacità di cecità. Nutrienti. (2014) 6:1394-405. doi: 10.3390/nu6041394
PubMed Abstract | CrossRef Full Text | Google Scholar
35. D’Adamo CR, Novick JS, Feinberg TM, Dawson VJ, Miller LE. Un integratore alimentare derivato dal cibo contenente una bassa dose di ferro migliorato marcatori di stato del ferro tra le donne carenti di ferro non anemiche. J Am Coll Nutr. (2018) 37:342-9. doi: 10.1080/07315724.2018.1427158
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Goodnough LT, Nemeth E, Ganz T. Rilevamento, valutazione e gestione dell’eritropoiesi limitata dal ferro. Sangue. (2010) 116:4754-61. doi: 10.1182/blood-2010-05-286260
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Lee CS, Lee SD, Kang SH, Park HY, Yoon IY. Confronto dell’efficacia del ferro orale e del pramipexolo per il trattamento dei pazienti con sindrome delle gambe senza riposo con bassa ferritina sierica. Eur J Neurol. (2014) 21:260-6. doi: 10.1111/ene.12286
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Tilma J, Tilma K, Norregaard O, Ostergaard JR. Prima infanzia-insorgenza della sindrome delle gambe senza riposo: sintomi ed effetto del trattamento orale di ferro. Acta Paediatr. (2013) 102:e221-6. doi: 10.1111/apa.12173
PubMed Abstract | CrossRef Full Text | Google Scholar