結合できる基質がある限り、酵素濃度を高めると酵素反応が速くなる。 基質がすべて結合すると、さらに結合する酵素がなくなるので、酵素濃度を上げても反応は速くなりません。
酵素の働き
酵素は触媒タンパク質で、反応の過程で変化することなく化学反応を速めることができます。 反応過程では、酵素と基質の間に結合が形成されないので、酵素は元の形に戻り、再び利用することができる。 酵素は活性部位を介して基質と結合し、酵素-基質複合体を形成する。 反応に非常に特異性があり、また結合する基質にも特異性がある。 基質の形が酵素の活性部位と一致すれば、酵素の働きは正しく、その働きは三次元構造に依存する。 活性化エネルギーを低下させ、より多くの分子を活性化させることで反応を起こしやすくし、触媒を遂行する。
酵素濃度の影響化学反応では、基質と反応するために酵素が必要であり、その濃度が重要である。 多くの場合、少量の酵素で大量の基質を消費することができる。 しかし、酵素の濃度が高くなると、活性部位の効果も高くなるので、これらの活性部位が基質分子を生成物に変換することになる。 酵素の濃度を上げると基質が過剰になる、つまり基質の濃度に依存しない反応でなければならないということである。 一定時間内に生成される生成物の量の変化は、存在する酵素の濃度に依存することになる。 これは図式的に次のように表される:
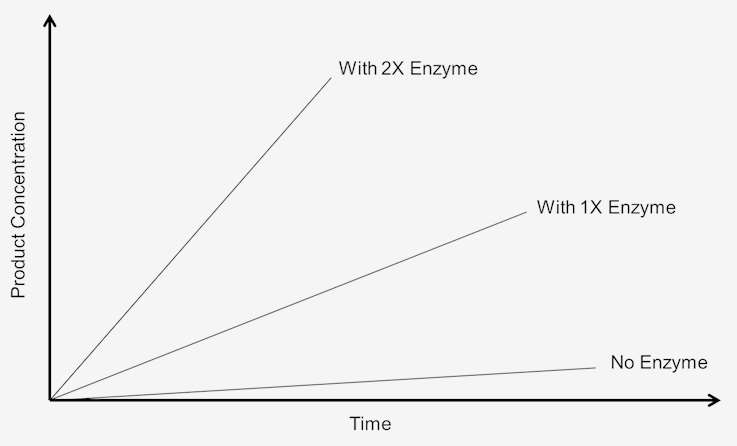 Figure 1. 0次反応の速度は基質濃度に依存する
Figure 1. 0次反応の速度は基質濃度に依存する
これらの反応は、速度が基質濃度に依存しないため、「0次反応」と呼ばれる。 生成物の生成は時間に対して直線的な速度で進行する。 基質の添加量を増やしても速度が速くなることはない。 0次反応では、アッセイを2倍の時間実行させると、生成物の量も2倍になる。 活性と濃度の関係は、温度、pHなど多くの要因に影響される。 酵素アッセイは、酵素濃度が唯一の制限因子となるように、観測される活性が存在する酵素量に比例するように設計されなければならない。 反応が0次である場合にのみ満たされます。
関連サービス
Enzyme Kinetics
Enzymology Assays
サービスの詳細については、1-631-562-8517にお電話で、または [email protected].
に電子メールでお問い合わせください。