As long as there is substrate available to bind to, increasing enzyme concentration will speed up the enzymatic reaction. Gdy cały substrat zostanie związany, reakcja nie będzie już przyspieszać wraz ze wzrostem stężenia enzymu, ponieważ nie będzie nic dla dodatkowych enzymów, aby się z nim związać.
Jak działają enzymy?
Enzym jest białkiem katalitycznym, które może przyspieszyć reakcję chemiczną bez zmiany w procesie reakcji. W procesie reakcji między enzymem a substratem nie tworzy się żadne wiązanie, więc enzym wraca do swojego pierwotnego kształtu i może być użyty ponownie. Enzym wiąże się z substratem poprzez miejsce aktywne, tworząc kompleks enzym-substrat. Są one bardzo specyficzne w reakcji, a także w stosunku do substratu, z którym się wiążą. Gdy kształt substratu pasuje do miejsca aktywnego enzymu, funkcja enzymu jest prawidłowa, a ich działanie zależy od jego trójwymiarowej struktury. Ułatwiają one zajście reakcji poprzez zmniejszenie energii aktywacji i aktywację większej liczby cząsteczek, dzięki czemu przeprowadzają katalizator.
Wpływ stężenia enzymu
Stężenie enzymu jest ważne w reakcji chemicznej, ponieważ jest on potrzebny do reakcji z substratem. Często mała ilość enzymu może pochłonąć dużą ilość substratu. Jednakże, wraz ze wzrostem stężenia enzymu, efektywność miejsc aktywnych również wzrasta, więc te aktywne miejsca będą przekształcać cząsteczki substratu w produkty. Zasadniczo oznacza to, że jeśli stężenie enzymu ma być zwiększone, musi istnieć nadmiar substratu, innymi słowy, co oznacza, że reakcja musi być niezależna od stężenia substratu.
Reakcja zerowego rzędu
Aby zbadać wpływ zwiększenia stężenia enzymu na szybkość reakcji, substrat musi być obecny w nadmiarze, tzn. reakcja musi być niezależna od stężenia substratu. Każda zmiana w ilości produktu powstałego w określonym czasie będzie zależała od poziomu obecnego enzymu. Graficznie można to przedstawić w następujący sposób:
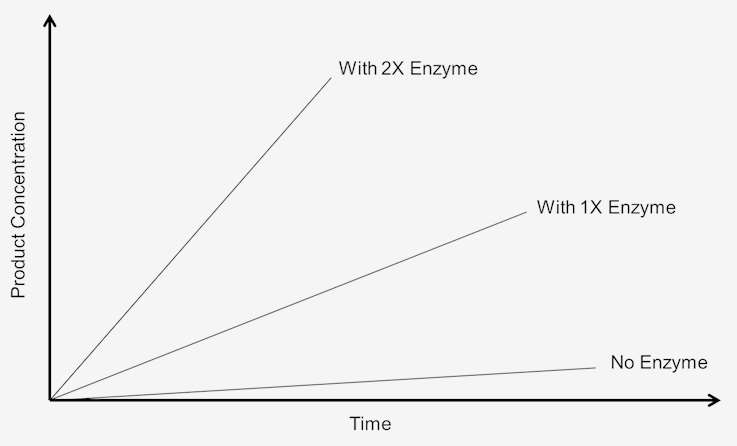 Rysunek 1. Szybkość reakcji zerowego rzędu jest zależna od stężenia substratu.
Rysunek 1. Szybkość reakcji zerowego rzędu jest zależna od stężenia substratu.
Reakcje te są określane jako „reakcje zerowego rzędu”, ponieważ ich szybkość jest niezależna od stężenia substratu. Tworzenie produktu przebiega z szybkością, która jest liniowa w czasie. Dodanie większej ilości substratu nie służy do zwiększenia szybkości. W kinetyce zerowego rzędu, pozwalając, aby badanie przebiegało przez podwójny czas, uzyskuje się podwójną ilość produktu.
Miarą ilości enzymu obecnego w reakcji jest jego aktywność, którą katalizuje. Na zależność pomiędzy aktywnością a stężeniem ma wpływ wiele czynników, takich jak temperatura, pH, itp. Test enzymatyczny musi być zaprojektowany w taki sposób, aby obserwowana aktywność była proporcjonalna do ilości obecnego enzymu, aby stężenie enzymu było jedynym czynnikiem ograniczającym. Jest to spełnione tylko wtedy, gdy reakcja jest zerowego rzędu.
Usługi pokrewne
Kinetyka enzymów
Atesty enzymologiczne
Aby omówić więcej szczegółów dotyczących usług, prosimy o kontakt pod numerem 1-631-562-8517 lub wysyłając e-mail na adres [email protected].
.