Tant qu’il y a un substrat disponible auquel se lier, l’augmentation de la concentration enzymatique accélère la réaction enzymatique. Une fois que tout le substrat est lié, la réaction ne s’accélérera plus avec l’augmentation de la concentration enzymatique, car il n’y aura plus rien à quoi se lier pour les enzymes supplémentaires.
Comment fonctionnent les enzymes?
L’enzyme est une protéine catalytique qui peut accélérer la réaction chimique sans être altérée dans le processus de réaction. Dans le processus de réaction, il n’y a pas de liaison formée entre l’enzyme et le substrat, donc l’enzyme reprend sa forme initiale et peut être utilisée à nouveau. L’enzyme se lie au substrat par le biais du site actif pour former un complexe enzyme-substrat. Ils sont très spécifiques à la réaction et aussi au substrat avec lequel ils se lient. Lorsque la forme du substrat correspond au site actif de l’enzyme, la fonction de l’enzyme est correcte, et leur fonctionnement dépend de leur structure tridimensionnelle. Elles facilitent la réaction en réduisant l’énergie d’activation et en activant plus de molécules, réalisant ainsi le catalyseur.
Effet de la concentration de l’enzyme
La concentration de l’enzyme est importante dans la réaction chimique car elle est nécessaire pour réagir avec le substrat. Souvent, une petite quantité d’enzyme peut consommer une grande quantité de substrat. Cependant, avec l’augmentation de la concentration de l’enzyme, l’efficacité des sites actifs augmente également, donc ces sites actifs vont convertir les molécules de substrat en produits. Cela signifie essentiellement que si la concentration de l’enzyme doit être augmentée, il doit y avoir un excès de substrat, en d’autres termes, ce qui signifie que la réaction doit être indépendante de la concentration du substrat.
Réaction d’ordre zéro
Pour étudier l’effet de l’augmentation de la concentration de l’enzyme sur la vitesse de réaction, le substrat doit être présent en quantité excessive, c’est-à-dire que la réaction doit être indépendante de la concentration du substrat. Tout changement dans la quantité de produit formé sur une période de temps donnée dépendra du niveau d’enzyme présent. Graphiquement, cela peut être représenté comme:
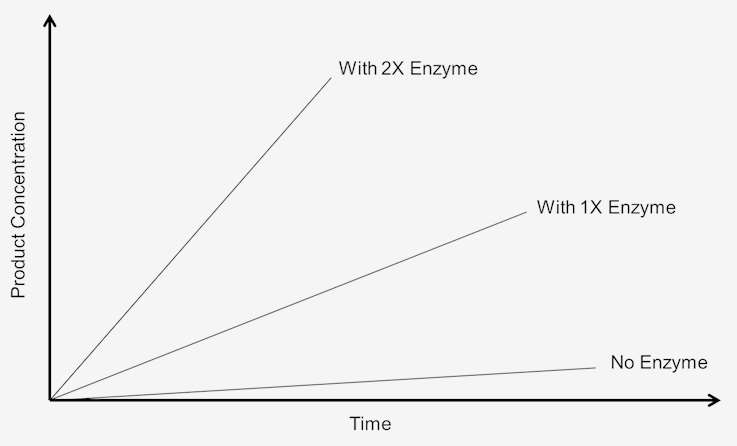 Figure 1. La vitesse de la réaction d’ordre zéro dépend de la concentration du substrat.
Figure 1. La vitesse de la réaction d’ordre zéro dépend de la concentration du substrat.
Ces réactions sont dites « d’ordre zéro » car les vitesses sont indépendantes de la concentration du substrat. La formation du produit se déroule à une vitesse qui est linéaire avec le temps. L’ajout de plus de substrat ne sert pas à augmenter la vitesse. Dans la cinétique d’ordre zéro, le fait de laisser le dosage se dérouler pendant deux fois plus de temps entraîne une quantité de produit deux fois plus importante.
La quantité d’enzyme présente dans une réaction est mesurée par l’activité qu’elle catalyse. La relation entre l’activité et la concentration est affectée par de nombreux facteurs tels que la température, le pH, etc. Un dosage enzymatique doit être conçu pour que l’activité observée soit proportionnelle à la quantité d’enzyme présente afin que la concentration en enzyme soit le seul facteur limitant. Il n’est satisfait que lorsque la réaction est d’ordre zéro.
Services connexes
Cinétique enzymatique
Tests enzymologiques
Pour discuter de plus de détails sur les services, veuillez nous contacter en appelant le 1-631-562-8517, ou en nous envoyant un courriel à [email protected].