Introduction
落ち着かない足症候群(RLS)はよくある神経疾患で(1)、鉄不足はその病因に重要な役割を果たす(2, 3)。 鉄欠乏はRLSに多く、鉄欠乏性貧血(IDA)は二次性RLSの原因としてよく知られており(4、5)、一般集団におけるRLSのリスクが6倍上昇する(6)と言われています。 貧血を伴わない鉄欠乏症(IDNA、非貧血性鉄欠乏症とも)は、通常、罹患しにくく、最近、世界的に流行し、診断と管理が困難なことから注目されています(7)。 IDA患者におけるRLSの臨床的意義は明らかであるにもかかわらず(6)、RLSにおけるIDNAの有病率と特徴については系統的な研究がなされていないのが現状です。 IDNAがRLSのサブグループを示すのか、またRLSにおいてIDNAがIDAに先立つ初期段階であるかは不明です。 本研究では、中国人RLS患者の連続したコホートにおいて、鉄欠乏のない患者(NID、非鉄欠乏でもある)およびIDA患者と比較したIDNAのRLSの臨床的特徴を調査することを目的としています。
方法
患者の包含と除外
2017年1月から2018年10月に上海交通大学医学部上海総合病院神経科のRLS専門クリニックと運動障害クリニックから継続的に患者を募集した。 RLSは2014年国際レストレスレッグス症候群研究会(RLSSG)の診断基準に従って診断した(1)。 他の神経疾患、協調性不良、認知機能障害を有する患者は研究から除外した。 年齢と性別を一致させた貧血のない健常対照者は、同時期に当院の健診センターで募集した。 6156><1626>標準プロトコルの承認と患者の同意<8893><6935>本研究は上海総合病院施設審査委員会の承認を受け、研究に参加したすべての患者と健康な対照者は書面による同意を与えた。<6156><1626>検査プログラム<8893><6935>RLS患者は我々が以前に説明したように評価した(8)。 簡単に言うと、私たちは外来クリニックで患者と対面して面接を行った。 RLS陽性と考えられる患者は、RLSを専門とする2人の神経科医によって診断された。 すべての患者について、人口統計学的情報、病歴、症状、投薬、一般神経学的検査、医学的検査、MMSEを記録した。 さらに半構造化質問票を評価し、RLS発症年齢、RLS家族歴(「第一度近親者」と定義した親近感)、感覚のタイプとトポグラフィー、RLS症状が季節変動と相関しているかどうかを記載した。 面接の1週間前のRLS重症度は、国際RLS評価尺度(IRLSRS)を用いて評価した(9)。 末梢性多発神経炎、静脈うっ血、血管跛行、関節リウマチなど、RLSの模倣の可能性を除外するため、臨床的に指示があれば血管超音波検査、神経伝導速度、筋電図などの検査を実施した。 また、過去3ヵ月間に神経弛緩薬など、著者がRLSに関連する可能性があると判断した投薬歴のある被験者も除外した。 慢性腎不全、妊娠、パーキンソン病、末梢神経障害、脳卒中、運動失調など、二次性RLSに関連する顕著な併存疾患を持つ者も除外した。 ヘモグロビンの血液検査と、血清フェリチン、鉄、トランスフェリン、総鉄結合能(TIBC)を含む末梢の鉄の状態を評価した。 トランスフェリン飽和度(TSAT)は血清鉄/TIBC×100として算出した。 ヘモグロビン値は,当院での正常値により,女性≧113 g/L,男性≧131 g/Lを正常値とした. IDNAは、血清フェリチン<6441>75μg/L(またはフェリチン≧75μg/LだがTSAT<6441>20%)かつヘモグロビン値が正常と定義した(10、11)。 IDAは、ヘモグロビン<113 g/L(女性)または<131 g/L(男性)、および血清フェリチン<75 μg/L (または血清フェリチン≥75 μg/L だが TSAT <20% )時に診断される。
統計
データはSPSS 21.0 for Windows(IBM Co, USA)で分析した。 すべてのデータは、平均値±標準偏差で示される。 ほとんどの変数が正規分布ではなかったので、3群間の単一変数の比較にはクラスカル・ワリス検定を用い、P < 0.05のときはポストホックのマン・ホイットニーを使用した。 比率の差は、適切な場合にはピアソンのカイ二乗またはフィッシャーの正確検定によって分析された。 P < 0.05は有意とみなされた。 RLS症状やその他の特徴に薬物療法が影響する可能性を考慮し、全RLS患者と無投薬のRLS患者でそれぞれすべてのデータを2回算出した。
結果
本研究では、貧血のない一次RLS患者(IDNA RLSおよびNID RLS)合計196名を継続登録し、男性患者66名(33.7%)と女性130名(66.3%)とした。 平均年齢は53.0±13.5歳であった。 RLS患者の65.8%(129/196)がRLSの薬を服用していなかった(薬物未使用109名、問診時に2週間以上薬物を服用していない20名)。 また、IDAを有するRLS患者26名(薬剤未使用22名)を対象とした。 鉄欠乏を認めない貧血のRLS患者5名(女性Hb <113 g/L、男性Hb <131 g/L)は除外した(血清フェリチン75 μg/L 以上、TIBC 20%以上、平均血清フェリチン236.1 ± 119.3 μg/L)。 IDAのRLS患者はいずれも感染症の兆候はなく、IDA RLSの原因を列挙した(表1)。 さらに、男性22名(34.9%)、女性41名(65.1%)を含む63名の健常対照者を集め、対照群の平均年齢は51.0±12.0歳(男性、女性の平均年齢はそれぞれ51.0±10.4、51.0±12.8)であることが判明した。 性別(RLS vs. コントロール:女性66.3 vs. 65.1%, P > 0.05),年齢(RLS vs. コントロール:53.0 ± 13.5 vs. 51.0 ± 12.0, P > 0.05) 共にRLS患者とコントロールに有意差はなかった。 各群のRLS患者の詳細な人口統計学的情報を示す(表2)
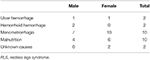
Table 1.RLS患者の人口統計学的情報を示す。 貧血のRLS患者における鉄欠乏の考えられる原因
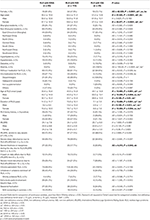
Table 2. IDNA、NID、IDAを有するRLS患者の人口統計学的情報と臨床的特徴。
RLS患者におけるIDNAの頻度
貧血や他の併存疾患のないRLS患者196人(女性130、男性66)のうち、鉄欠乏症は83(42.3%)だった。 貧血のないこのRLS患者コホートでは,女性(58.5%,76/130)のIDNA有病率は男性(10.6%,7/66)よりもはるかに高く(表2),相対リスクは5.51(95%信頼区間 2.70-11.27, p < 0.0001)であった。
IDNAを有するRLS患者のNIDと比較した臨床的特徴
貧血のない女性RLS患者では、NID群と比較してIDNA群は面接時、RLS発症時ともに若年だった(P < 0.01; Table 2)。 IRLSRSによるRLSの重症度には差がなかったが、IDNA群ではNID群に比べ、日中の疲労感や眠気が強い/非常に強い患者が多かった(32.5 vs. 17.7%, P < 0.05; Table 2)。 RLSの家族歴、重症度、側方性、部位、季節変動については、男女ともIDNA群とNID群との間に差はなかった。 IDNA RLS群はNID RLS群と比較して、血清フェリチンが低く(男性、女性、P < 0.0001)、トランスフェリンおよびTIBC値が高かった(女性、P < 0.0001)(図1、表3)。 群別・性別の血液・鉄パラメータ(A)ヘモグロビン。 (B)フェリチン (C)トランスフェリン。 (D)鉄。 (E)TIBC。 (F)TSAT。 **P < 0.01, *P < 0.05, Kruskal-Wallis test and post-hoc Mann-Whitney test. IDNA RLS(n = 83)、NID RLS(n = 113)、IDA RLS(n = 26)、および対照(n = 63)間で比較したデータ。 ##P < 0.01、#P < 0.05、Mann-Whitney U-test(マン・ホイットニーのU検定)。 IDNA RLS,NID RLS,IDA RLS,コントロールの各群で男女を比較したデータ。 鉄欠乏はフェリチン値<6441>75μg/L、またはフェリチン75μg/L、ただしTSAT<6441>20%と定義した。 IDA、鉄欠乏性貧血;IDNA、貧血を伴わない鉄欠乏;NID、非鉄欠乏;RLS、レストレスレッグス症候群;TIBC、総鉄結合能;TSAT、トランスフェリン飽和度。 IDNA、NID、IDA、および対照のRLS患者の血液学的データ。
RLSに対して投薬中のRLS患者を除外しても、IDNA RLSグループはNID RLSグループと比較して、有意水準ではないが、日中の重症/非常に重度の疲労/眠気の割合が高い(35 vs 18.8%, P = 0.078)。 IDNA RLSとNID RLS間のその他の特徴は類似していた(補足表1)。
IDAと比較したIDNAのRLS患者の臨床的特徴
IDAグループはIDNAグループよりも血清鉄代謝パラメータに重度の障害があり、低フェリチン(男性、P < 0.0)であった。05;女性、P < 0.0001)、トランスフェリン高値(女性、P < 0.0001)、血清中の鉄(男性、P < 0.05;女性、P < 0.0001)、TIBC高値(女性、P < 0.0001)、TSAT低値(男性、P < 0.05;女性、P < 0.0001)などが認められた(図1,表3). IDNA RLSはIDA RLSより罹病期間が長く(男性:P < 0.01、女性:P < 0.05)、発症年齢が若かった(男性のみ有意、P < 0.05)。 IDNA RLSとIDA RLSの間では、家族歴陽性、重症度(IRLSRS)、側方性、部位、季節変動に関して、男性でも女性のRLS患者でも差はなかった(表2)。 RLSの薬を服用しているRLS患者を除いても結果は同様であった(補足表1)。
対照群の血液学的特徴
鉄欠乏の診断基準は一般集団とRLS患者で異なる(下記の考察の通り)。 当院の一般集団における鉄欠乏のカットオフ値(20μg/L)によると、対照群の男性被験者には鉄欠乏が見られなかったが、女性対照群には4名の鉄欠乏が見られた(血清フェリチン<6441>20μg/Lの被験者2名、フェリチン≧20μg/LだがTSAT<6441>20%の被験者2名)。 鉄欠乏症の有病率は,男性(0%,0/22)と女性(9.8%,4/41;P = 0.288)で有意差はなかった. 対照群のヘモグロビンおよび鉄パラメータに関する血液学的検査は、IDNAまたはIDA群と比較して、NID RLS群と最も類似していた(図1、表3)
考察
一次および二次RLSの病態生理学は不完全に理解されている。 脳内鉄欠乏はRLSの病因に基本的な役割を果たし、貧血や妊娠などの全身的な鉄欠乏を特徴とする状態は、RLS症状の高い有病率と関連している(2、3、5、6)。 IDAは、二次性RLSに関連する併存疾患として認識されています(4-6, 12)。 IDNAはより険悪で、RLS患者におけるその特徴はあまり知られていません。
RLSにおけるIDNAの臨床的特徴
一般に、女性はRLSにかかりやすいといわれています(1、13、14)。 また、出産適齢期の女性は、一般的に男性よりも鉄分不足である(15)。 今回、貧血のないRLS患者を対象にした研究でも、性差に依存した有意な差別が認められた。 女性RLS患者は男性RLS患者よりIDNAのリスクがはるかに高い(相対リスク5.51、p<6441>0.0001)。 男性RLS患者では、貧血を伴う、あるいは伴わない鉄欠乏症の患者は少なかった。 対照群では、統計的有意差はなかったが、女性では9.8%が鉄欠乏症に罹患していたのに対し、男性では皆無であった。 鉄欠乏は男性では珍しいので、もし男性のRLS患者に鉄欠乏があれば、慢性出血や胃腸障害による栄養失調などの二次的原因を評価するために追加調査をすべきである。
「正常」NID RLS群と比較すると、IDNA RLS群は女性でRLS発症年齢と面接時年齢の若さを示したが、男性では見られなかった(表2)。 以前の研究では、早期発症のRLSは後期発症のRLSと比較して、より陽性のRLS家族歴を示し、より重度の末梢鉄パラメータ障害(血清フェリチンの低下、血清トランスフェリンおよびTIBC値の上昇)を示した(8)。 最近、我々はRLSのIDNAがRLSのNIDと比較していくつかの遺伝的要因を予測することを見出した(未発表データ)。 遺伝的背景、鉄欠乏、早期発症RLSに関連する潜在的なサブタイプは、さらなる調査が必要である。 疲労感、脱力感、集中力低下、記憶力の低下、作業能率の低下などは、鉄欠乏と関連することが多い非特異的な症状である(7, 16)。 Allenら(6)は、RLSのあるIDA患者は、RLSのないIDA患者と比較して、より疲れやすく、睡眠の質が悪く、日中のエネルギーが低下していることを以前に報告している。 IDNAのRLS患者も、NIDのRLS患者と比較して、RLSによる日中の重度/非常に重度の疲労感や眠気の発現が多いことがわかった(75μg/Lのカットオフ点、32.5 vs. 17.7%, P < 0.05, 表2)。 投薬のないRLS患者のみで再度解析したところ、統計的有意差には至らなかったが、IDNA RLS患者は日中の重度/非常に重度の疲労感や眠気を感じやすい傾向が依然として見られた(35 vs. 18.8%, P = 0.078, 補足表1)。 本研究では、IDNA RLSとIDA RLSの間で、日中の重度/超重度の疲労感や眠気の差は認められなかった(表2)。 IDAからIDNAまでの連続した鉄貯蔵量の減少は、鉄依存性酵素の活性低下、細胞酸化能の低下、およびエネルギー効率の低下と関連している(17-19)。 IDNAのより厳格な定義(血清フェリチンのカットオフ値を50μg/Lに設定)を用いても、NID RLS患者に比べIDNA RLS患者の方が日中の重度/超重度の疲労感や眠気に悩まされていた(32.3 vs 19.8% )が、これは有意ではなかった(P > 0.05; 補足表2)。 睡眠時周期性下肢運動(PLMS)はRLSと密接に関連しており,BTBD9遺伝子内の遺伝子座はPLMSとRLSの両方のリスクに相関している(20,21)。 注目すべきは、IRLSRSの小項目4を用いた睡眠の質の評価のみで、ポリソムノグラフィー(PSG)測定による詳細な睡眠状態の評価は行っていないことである。 そのため、日中の疲れや眠気に大きく寄与すると思われるPLMSやその他の睡眠関連パラメータのデータは得られなかった。 したがって、日中の疲労感・眠気とIDNAの関連については、さらなる調査が必要である。 IDNA群とNID群との間でRLSの重症度に有意差は認められなかった。 末梢の鉄欠乏は、これまでの臨床研究でRLS有病率のリスクを高めるとされている(6)。 血清鉄濃度の低下は、脳内鉄レベルをグローバルに低下させ、鉄治療は末梢鉄レベルの低いRLS患者に有効である(10)。 しかしながら、全身的な鉄欠乏がない多くのRLS患者は、依然として脳特異的な鉄欠乏を呈している(22)。 ネズミの研究では、血清鉄の状態は脳の局所鉄レベルとは相関がなく、したがってRLSの特徴との関連は限定的かもしれないと報告されている(23、24)。
Is IDNA an early stage prior to IDA in RLS?
鉄欠乏は、ヘモグロビン測定値によってIDNAとIDAの2段階に分類される。 本研究では、IDAのRLS患者は、IDNAのRLSおよびNIDのRLSと比較して、ヘモグロビン、フェリチン、鉄の値が最も低く、トランスフェリンおよびTIBCの値が最も高かった(図1、表3)。 IDNA RLSとNID RLSではヘモグロビン値に有意差はなかったが(RLS患者の男女とも)、IDNA RLS患者の血清ヘモグロビン値は対照群と比較して低かった(女性のみ、P < 0.05、図1、表3)。 また、IDNA RLS群における鉄パラメータの値は、NID RLS群または対照群とIDA RLS群との間にあった(図1、表3)。 これらの結果は、IDNAが貧血発症前の軽度の鉄欠乏であるという観点と一致する。 なお、血清鉄パラメータは主に赤血球の末梢鉄状態を反映していると考えられており(25)、IDNA被験者では他の臓器(肝臓、脳など)の貯蔵鉄の検証が必要である。
とはいえ、IDNA RLSとIDA RLSの原因や特徴はまったく同じではない。 本研究では、IDAのRLS患者のほとんどが、消化管出血、痔出血、月経困難症などの栄養失調または慢性的な過剰出血に関連する顕著な併存疾患を有しており(表1)、これは以前の研究(12)と一致している。 なお、月経は生殖年齢の女性に多いIDAの原因であり、子宮筋腫や子宮腺筋症などの婦人科疾患に引き続いて起こる可能性があります。 栄養不良は、胃腸障害、ベジタリアン食、若い女性のセルフボディイメージに関する誤解に続発する可能性がある。 したがって、本研究のIDA RLS患者の大半の鉄欠乏は “絶対的鉄欠乏 “である。 一方、IDNAのRLS患者には、通常、目立った併存疾患がない。 IDNA RLSの原因は不明確であり、RLSのIDNAは一般に “機能的鉄欠乏 “を伴う一次性RLS(4)の範囲に属します。 しかし、IDNAのRLS患者では、体内の鉄の供給不足につながるinsidiousな二次的原因を排除できない。
IDNAのRLSと比較して、IDA患者はRLS発症年齢が高く、また男女ともにRLS期間が短く(男性でより顕著、表2)、これは通常二次性RLSは発症年齢が高いという見解と一致している(26)。 我々の経験では、顕著な原因(急性出血など)を持つこれらのIDA RLS患者は、治療可能な併存疾患が修正され、鉄状態が回復すると、通常、疾患期間が短く、より迅速に回復または緩和することが示される。 彼らは通常、長期的なRLS治療を必要とせず、一次RLS患者とはやや異なる。 IDAを持つRLS患者における鉄分補給の治療効果を確認するためには、今後の縦断的研究が必要である。 妊娠(27)および尿毒症(28)の併発RLSに関する他の研究では、出産および腎移植後の改善が報告されており、関連代謝因子の変化が感受性の高い被験者でRLSを誘発する可能性が示唆されている(5)
したがって、IDA RLSとIDNA RLSには異質性が存在することになる。 IDNA は一般に貧血の前段階と考えられているが (7)、IDNA RLS は IDA RLS の単なる前駆症状ではないかもしれない。
RLS における IDNA の検査と診断
骨髄生検は鉄状態の最高の指標と考えられているが、生検部位での感染や出血のリスクがあるため滅多に行われない (29). 鉄の状態の検査指標として最も広く用いられているのはフェリチンであり、これは組織の鉄貯蔵量または赤血球造血に利用しやすい鉄の適切さを反映する(30)。 血清フェリチンは全身の鉄貯蔵量を評価する感度の高いマーカーであるが、炎症状態、年齢、腎機能などの他の条件が交絡因子となり、血清フェリチン値を上昇させる可能性がある(31)。 フェリチンとトランスフェリンは急性期反応物質でもあり、炎症状態ではフェリチン値は上昇し、トランスフェリン値は低下する可能性がある(32)。 したがって、血清フェリチン75μg/L以上、TSAT<20%でも実際の鉄欠乏症の可能性がある(11、33)。
血清フェリチン濃度のカットオフポイント<30μg/Lは、一般集団における潜在的鉄欠乏症を特定するのに最も感度と特異性が高く(17、18)、IDNAは血清フェリチン値が低下(<20 μg/L) ヘモグロビン値が正常であると分類されています(34, 35)。 臨床検査機関では通常、血清フェリチンの基準範囲の下限を一般集団では10〜20μg/Lに設定している(36)(当院では下限を20μg/Lに設定している)。 心不全や慢性腎臓病などの慢性疾患では、血清フェリチンの閾値をかなり高くして鉄欠乏を定義するのが普通である(7, 17)。 RLSのIDNAを示すフェリチンの正確なカットオフ値はまだ合意に至っていないが、RLSの鉄欠乏を定義する評価基準も健康な対照群と異なっている。 最近の研究では、RLS患者のフェリチン濃度が75μg/L未満であれば、鉄欠乏とみなすべきであると示唆されている(10、11、27)。 しかし、以前の研究では、ほとんどが50μg/L未満のフェリチン濃度をRLSの「低鉄分状態」と判断していた(37、38)。 カットオフ値の違いに関する記述のデータがないため、鉄欠乏のフェリチンのカットオフ値として75μg/Lと50μg/Lの両方を用いて、IDNA RLSとNID RLSの特徴を比較検討した。 その結果、フェリチンの下限値として50μg/Lを用いた場合、RLS患者の33.2%(65/196人)がIDNAの基準に合致することがわかった。 フェリチンのカットオフ値を50μg/Lに設定した場合、NID RLSと比較してIDNA RLSで日中の重度/非常に重度の疲労感や眠気の増加が有意でなかったことを除き、使用した2つの閾値について結果はよく似ていた(表2、補足表2)
我々の研究にはいくつかの限界があった。 まず、これは横断研究であり、縦断的なデータがないため、RLS症状の進展や治療の効果を特定することは困難であった。 さらに、リコールバイアスがある可能性もある。 第二に、患者の約4分の1が地元上海の住民であり、大半の患者が華東出身であるため、これは単一施設の研究であった。 中国の広大な領土と様々な環境要因を考慮すると、選択バイアスが存在する可能性がある。 第三に、我々はRLS患者と対照者の詳細な睡眠状態を評価するためのPSG測定を行っていない。 第四に、本研究のRLS患者の約3分の1は、ドーパミン作動薬やガバペンチンエナカルビル療法を受けており(鉄補給療法を受けていた患者は一人だけ)、臨床的特徴に影響を与える可能性がある。 しかし、投薬を受けていないRLS患者で再度すべてのデータを計算したところ、同じ結論が得られた。 とはいえ、我々の研究にはいくつかの利点がある。 RLSの臨床スペクトルを詳細に調査し、他の併存疾患やRLSの模倣を除外した。 各患者に対面して面接を行い、追跡調査中に非典型的なRLS患者を慎重に除外した。 RLSにおけるIDNAの特徴に関する研究は限られており、我々は連続した中国人RLS患者におけるIDNAの詳細な臨床的特徴を調査した。
結論
IDNAはRLS患者、特に女性で頻繁に見られ、いくつかの特別な臨床的特徴を有している。 女性RLS患者では、NIDと比較してIDNAは問診時およびRLS発症時の年齢が若かった。 IDNAは男性のRLS患者にはあまり見られず、鉄欠乏症の男性は併存する疾患がないか評価する必要がある。 IDNAを有するRLS患者の特徴は、IDAを有するRLSとは異なります。 IDNAを伴うRLSは、重要かつ見過ごされている公衆衛生上の問題であり、より臨床的に注目されるべきであり、治療戦略において対処されるべきです。
Data Availability Statement
本研究で作成したデータセットは、対応する著者に依頼すれば入手できる。
Ethics Statement
人間を対象とした研究は、上海総合病院の施設審査委員会の審査と承認を受けている。
著者貢献
X-YZの構想/設計/プロジェクトの実行/原稿の起草。 T-TW:プロジェクトの実行/データの収集と解釈/原稿の起草。 H-MW、JS:実験室での測定。 XL, L-YN, T-JC, M-YQ: プロジェクトの遂行/データの収集と解釈。 TLとWO:重要な知的内容のための原稿の重要な改訂。 Y-CW:プロジェクトの構想/設計/監督、重要な知的コンテンツのための原稿の重要な改訂。 全著者:原稿作成.
資金
この研究は、上海市科学研究基金計画委員会(201740017)、上海総合病院の臨床研究革新計画(CTCCR-2018C02)、上海交通大学学際プログラム(YG2015QN21)、中国国家自然科学基金(No. 81671251)。
利益相反
著者らは、本研究が利益相反の可能性と解釈される商業的または金銭的関係がない状態で行われたことを宣言する。
謝辞
この研究に参加したすべての患者および健康コントロール被験者に感謝します。 また、上海総医院身体検査センターのスタッフの方々に感謝します。 また、上海交通大学生命科学・生物工学部バイオインフォマティクス・生物統計学科、統計相談をしていただいたYue Zhang氏に感謝する。
補足資料
本論文の補足資料は、以下のサイトに掲載されています。 https://www.frontiersin.org/articles/10.3389/fneur.2020.00298/full#supplementary-material
略語
CI, confidence interval; IRLSSG, International Restless Legs Study Group; MMSE, Mini-Mental State Examination; NID, without iron deficiency; RLS, restless legs syndrome; IDA, iron deficiency anemia; IDNA, iron deficiency without anemia; IRLSRS, International Restless Legs Syndrome Rating Scale; TIBC, total iron binding capacity; TSAT, transferrin saturation.IRSRS は鉄欠乏症の格付け尺度。
1. Allen RP, Picchietti DL, Garcia-Borreguero D, Ondo WG, Walters AS, Winkelman JW, et al. Restless legs syndrome/Willis-Ekbom disease diagnostic criteria: updated International Restless Legs Syndrome Study Group (RLSSG) consensus criteria-history, rationale, description, and significance.レストレス・レッグス・シンドロームの国際病型評価尺度(RRLSG)の改訂版。 睡眠医学。 (2014) 15:860-73. doi: 10.1016/j.sleep.2014.03.025
CrossRef Full Text | Google Scholar
2. Connor JR, Boyer PJ, Menzies SL, Dellinger B, Allen RP, Ondo WG, et al. Neuropathological examination suggests impaired brain iron acquisition in restless legs syndrome.レストレスレッグス症候群における脳鉄の獲得障害が示唆された。 Neurology. (2003) 61:304-9. doi: 10.1212/01.WNL.0000078887.16593.12
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Allen RP, Earley CJ.(アレン・アーリー、以下同じ)。 レストレスレッグス症候群における鉄の役割。 Mov disord. (2007) 18(22 Suppl):S440-8. doi: 10.1002/mds.21607
CrossRef Full Text | Google Scholar
4.アレンRP、アーリーCJ、レストレスレッグス症候群における鉄の役割。 レストレスレッグス症候群の併存疾患、治療、および病態生理学。 Lancet Neurol. (2018) 17:994-1005. doi: 10.1016/S1474-4422(18)30311-9
PubMed Abstract | CrossRef Full Text | Google Scholar
5.レストレスレッグス症候群の併存疾患と治療、および病態生理学(Lancet Neurol. Trenkwalder C, Allen R, Hogl B, Paulus W, Winkelmann J. 主要疾患に関連するレストレスレッグス症候群:系統的レビューと新しい概念。 Neurology. (2016) 86:1336-43. doi: 10.1212/WNL.0000000000002542
PubMed Abstract | CrossRef Full Text | Google Scholar
6.レストレスレッグス症候群と主要疾患との関連:システマティック・レビュー. Allen RP, Auerbach S, Bahrain H, Auerbach M, Earley CJ. 鉄欠乏性貧血患者におけるレストレスレッグス症候群の有病率とその影響。 Am J Hematol. (2013) 88:261-4. doi: 10.1002/ajh.23397
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Soppi ET.鉄欠乏性貧血の患者におけるレストレスレッグス症候群の有病率および影響。 貧血を伴わない鉄欠乏症-臨床的課題。 Clin Case Rep. (2018) 6:1082-6. doi: 10.1002/ccr3.1529
PubMed Abstract | CrossRef Full Text | Google Scholar
8.ソッピ ET.貧血を伴わない鉄欠乏症 – clinical challenge. Zhu XY, Wu TT, Wang HM, Ni LY, Li X, Liu Y, et al. Chinese populationにおけるレストレスレッグス症候群の臨床的特徴とサブタイプ:359人の患者を対象とした研究。 Sleep Med. (2019) 59:15-23. doi: 10.1016/j.sleep.2019.01.053
PubMed Abstract | CrossRef Full Text | Google Scholar
9.レストレスレッグス症候群の臨床的特徴およびサブタイプ。 Walters AS, LeBrocq C, Dhar A, Hening W, Rosen R, Allen RP, et al. International Restless Legs Syndrome Study, Validation of the International Restless Legs Syndrome Study Group rating scale for restless legs syndrome.国際レストレスレッグス症候群研究グループ評価尺度の検証。 Sleep Med. (2003) 4:121-32. doi: 10.1016/S1389-9457(02)00258-7
PubMed Abstract | CrossRef Full Text | Google Scholar
10.睡眠医学。 Allen RP, Picchietti DL, Auerbach M, Cho YW, Connor JR, Earley CJ, et al. International Restless Legs Syndrome Study, Evidence-based and consensus clinical practice guidelines for the iron treatment of restless legs syndrome/Willis-Ekbom disease in adults and children: an IRLSSG task force report.国際むずむず足症候群研究会報告書(IRLSSG). Sleep Med. (2018) 41:27-44. doi: 10.1016/j.sleep.2017.11.1126
CrossRef Full Text | Google Scholar
11.レストレスレッグス症候群の治療に関するエビデンスとコンセンサスに基づく診療ガイドライン。 Trenkwalder C, Winkelmann J, Oertel W, Virgin G, Roubert B, Mezzacasa A, et al. Restless legs syndrome and nonanemic iron deficiency patients in Ferric carboxymaltose: a randomized trial.レストレスレッグス症候群と非鉄欠乏症の患者における鉄カルボキシマルトース。 Mov Disord. (2017) 32:1478-82. doi: 10.1002/mds.27040
PubMed Abstract | CrossRef Full Text | Google Scholar
12.邦題:「邦題」「邦題」「邦題」「邦題」。 Mehmood T, Auerbach M, Earley CJ, Allen RP. 鉄欠乏性貧血(IDA)とレストレスレッグ症候群(ウィリス・エクボム病)患者における鉄剤静脈内投与への反応。 Sleep Med. (2014) 15:1473-6. doi: 10.1016/j.sleep.2014.08.012
PubMed Abstract | CrossRef Full Text | Google Scholar
13.鉄欠乏性貧血の患者を対象とした鉄剤の静脈内投与に対する反応。 Thomas K, Watson CB. 女性におけるレストレスレッグス症候群:レビュー。 J Womens Health. (2008) 17:859-68. doi: 10.1089/jwh.2007.0515
PubMed Abstract | CrossRef Full Text | Google Scholar
14.女性のレストレスレッグス症候群:レビュー。 Ohayon MM, O’Hara R, Vitiello MV. レストレスレッグス症候群の疫学:文献の統合。 スリープメッドレブ(2012)16:283-95。 doi:10.1016/j.smrv.2011.05.002
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Umbreit J.鉄欠乏症:簡潔なレビュー。 Am J Hematol。 (2005) 78:225-31. doi: 10.1002/ajh.20249
PubMed Abstract | CrossRef Full Text | Google Scholar
16.鉄欠乏症:簡潔なレビュー。 貧血を伴わない鉄欠乏は、若い日本人女性における怒りや疲労と関連している。 Biol Trace Elem Res. (2014) 159:22-31. doi: 10.1007/s12011-014-9963-1
PubMed Abstract | CrossRef Full Text | Google Scholar
17.鉄欠乏症は、貧血を伴わない怒りと疲労に関連する。 Camaschella C.鉄欠乏性貧血。 N Engl J Med. (2015) 372:1832-43. doi: 10.1056/NEJMra1401038
PubMed Abstract | CrossRef Full Text | Google Scholar
18.鉄欠乏性貧血。 Lopez A, Cacoub P, Macdougall IC, Peyrin-Biroulet L. Iron deficiency anaemia. Lancet. (2016) 387:907-16. doi: 10.1016/S0140-6736(15)60865-0
PubMed Abstract | CrossRef Full Text | Google Scholar
19.鉄欠乏症貧血. Haas JD, Brownlie T. Iron deficiency reduced work capacity: a critical review of the research to determine a causal relationship.鉄欠乏症による労働能力の低下。 J Nutr. (2001) 131:676S-88S; discussion 688S-90S. doi: 10.1093/jn/131.2.676S
PubMed Abstract | CrossRef Full Text | Google Scholar
20.鉄不足による労働能力の低下。 Stefansson H, Rye DB, Hicks A, Petursson H, Ingason A, Thorgeirsson TE, et al. 睡眠時周期性四肢運動に対する遺伝的危険因子。 N Engl J Med. (2007) 357:639-47. doi: 10.1056/NEJMoa072743
PubMed Abstract | CrossRef Full Text | Google Scholar
21.睡眠時無呼吸症候群の遺伝的リスクファクター。 Li G, Tang H, Wang C, Qi X, Chen J, Chen S, et al. BTBD9 と MAP2K5/SKOR1 と中国人集団におけるレストレスレッグス症候群の関連性。 Sleep. (2017) 40:zsx028. doi: 10.1093/sleep/zsx028
PubMed Abstract | CrossRef Full Text | Google Scholar
22.レストレスレッグス症候群との関連。 Earley CJ, Connor J, Garcia-Borreguero D, Jenner P, Winkelman J, Zee PC, et al. Restless Legs Syndrome (Willis-Ekbom Disease) における脳の鉄の恒常性とドーパミン作動性機能の変化. Sleep Med. (2014) 15:1288-301. doi: 10.1016/j.sleep.2014.05.009
PubMed Abstract | CrossRef Full Text | Google Scholar
23.をご参照ください。 Erikson KM, Pinero DJ, Connor JR, Beard JL. 発育期のラットにおける鉄欠乏および鉄補給時の脳の局所鉄、フェリチンおよびトランスフェリン濃度。 J Nutr. (1997) 127:2030-8. doi: 10.1093/jn/127.10.2030
PubMed Abstract | CrossRef Full Text | Google Scholar
24.鉄欠乏症と鉄再補充の間の脳の局所的な鉄とフェリトリン濃度。 Yin L, Unger EL, Jellen LC, Earley CJ, Allen RP, Tomaszewicz A, et al. マウスの鉄欠乏に対する多変量応答のシステム遺伝学的分析。 Am J Physiol Regul Integr Comp Physiol. (2012) 302:R1282-96. doi: 10.1152/ajpregu.00634.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Hallberg L, Hulthen L. Perspectives on iron absorption. 血球モルディブ。 (2002) 29:562-73. doi: 10.1006/bcmd.2002.0603
PubMed Abstract | CrossRef Full Text | Google Scholar
26.鉄の吸収のパースペクティブ(Perspectives). Shukla G, Gupta A, Pandey RM, Kalaivani M, Goyal V, Srivastava A, et al.どのような特徴が片側性レストレスレッグス症候群と両側性レストレスレッグス症候群を区別するか? 195名の患者を対象とした比較観察研究。 Sleep Med. (2014) 15:714-9. doi: 10.1016/j.sleep.2014.01.025
PubMed Abstract | CrossRef Full Text | Google Scholar
27.レストレスレッグス症候群の特徴とは? Picchietti DL, Hensley JG, Bainbridge JL, Lee KA, Manconi M, McGregor JA, et al. International Restless Legs Syndrome Study, Consensus clinical practice guidelines for the diagnosis and treatment of restless legs syndrome/Willis-Ekbom disease during pregnancy and lactation.国際不安足症候群研究会、妊娠中・授乳中の不安足症候群の診断と治療についてのコンセンサス臨床実践ガイドライン(CCP)。 Sleep Med Rev. (2015) 22:64-77. doi: 10.1016/j.smrv.2014.10.009
CrossRef Full Text | Google Scholar
28.邦訳:『レストレスレッグ症候群の診断と治療』(日本評論社)。 Winkelmann J, Stautner A, Samtleben W, Trenkwalder C. 腎臓移植後の透析患者におけるレストレスレッグス症候群の長期経過. Mov Disord. (2002) 17:1072-6. doi: 10.1002/mds.10231
PubMed Abstract | CrossRef Full Text | Google Scholar
29.レストレスレッグス症候群:腎移植後の透析患者の長期経過。 Bain BJ. 骨髄生検の病的状態:2003年のレビュー。 J Clin Pathol. (2005) 58:406-8. doi: 10.1136/jcp.2004.022178
PubMed Abstract | CrossRef Full Text | Google Scholar
30.骨髄生検の病的状態:2003年のレビュー。 ベインズRD. 鉄の状態の評価。 Clin Biochem. (1996) 29:209-15. doi: 10.1016/0009-9120(96)00010-K
PubMed Abstract | CrossRef Full Text | Google Scholar
31.鉄の状態のアセスメント。 Wish JB. 鉄の状態を評価する:血清フェリチンとトランスフェリン飽和を越えて。 Clin J Am Soc Nephrol. (2006) 1(1 Suppl):S4-8. doi: 10.2215/CJN.01490506
PubMed Abstract | CrossRef Full Text | Google Scholar
32.鉄の状態を評価する: 血清フェリチンとトランスフェリン飽和を超えて。 Tietz NW, Rinker AD, Morrison SR. 血清鉄が本当に血清鉄であるのはいつなのか? 血清鉄測定の現状。 Clin Chem. (1994) 40:546-1. doi: 10.1093/clinchem/40.4.546
PubMed Abstract | CrossRef Full Text | Google Scholar
33.血清鉄を測定するには、血清鉄を測定する必要があります。 Mackie S, Winkelman JW. 鉄欠乏症とRLSの患者における正常なフェリチン。 J Clin Sleep Med. (2013) 9:511-3. doi: 10.5664/jcsm.2680
PubMed Abstract | CrossRef Full Text | Google Scholar
34.鉄欠乏症の患者における正常なフェリチン。 Leonard AJ, Chalmers KA, Collins CE, Patterson AJ. 潜在性鉄欠乏症の治療における元素鉄の2用量比較:有効性、副作用および盲検化能力。 Nutrients. (2014) 6:1394-405. doi: 10.3390/nu6041394
PubMed Abstract | CrossRef Full Text | Google Scholar
35.を参照。 D’Adamo CR, Novick JS, Feinberg TM, Dawson VJ, Miller LE. 鉄の低用量を含む食品由来の栄養補助食品は、非貧血性鉄欠乏女性の鉄の状態のマーカーを改善しました。 J Am Coll Nutr. (2018) 37:342-9. doi: 10.1080/07315724.2018.1427158
PubMed Abstract | CrossRef Full Text | Google Scholar
36.鉄分不足の女性において、鉄分を含む食品由来の栄養補助食品が、鉄分状態を改善した。 Goodnough LT, Nemeth E, Ganz T. Detection, Evaluation, and management of iron-restricted erythropoiesis(鉄制限性赤血球の検出、評価、管理)。 Blood. (2010) 116:4754-61. doi: 10.1182/blood-2010-05-286260
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Lee CS, Lee SD, Kang SH, Park HY, Yoon IY. また、このような場合、「鍼灸師が鍼を刺すとどうなるのか? Eur J Neurol. (2014) 21:260-6. doi: 10.1111/ene.12286
PubMed Abstract | CrossRef Full Text | Google Scholar
38.邦訳:『レストレスレッグス症候群の治療法』(講談社学術文庫)。 Tilma J, Tilma K, Norregaard O, Ostergaard JR. 小児期発症の早期レストレスレッグス症候群:症状と経口鉄剤治療の効果。 Acta Paediatr. (2013) 102:e221-6. doi: 10.1111/apa.12173
PubMed Abstract | CrossRef Full Text | Google Scholar