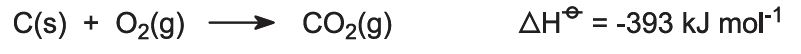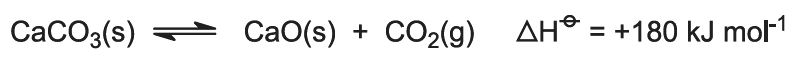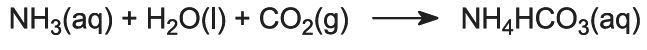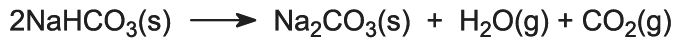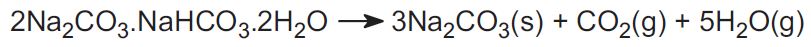- Toepassingen van natriumcarbonaat
- Jaarlijkse productie van natriumcarbonaat
- Vervaardiging van natriumcarbonaat
- (a) uit natriumchloride en calciumcarbonaat
- (1) Ammoniatie van pekel
- (2) Vorming van calciumoxide en kooldioxide
- (3) De Solvay-toren
- (4) Afscheiding van vast natriumwaterstofcarbonaat
- (5) Vorming van natriumcarbonaat
- (6) Vorming van calciumhydroxide
- (7) Regeneratie van ammoniak
- (b) Uit trona- en nahcoliet-ertsen
Toepassingen van natriumcarbonaat
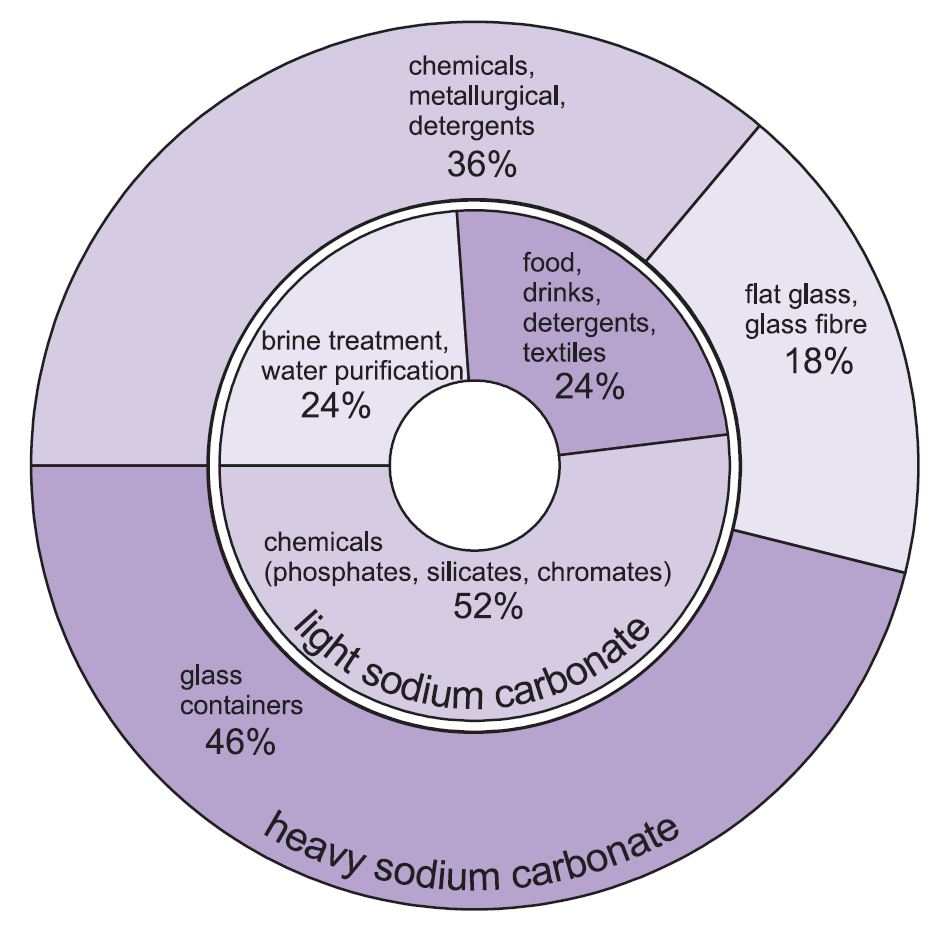
Twee vormen van natriumcarbonaat (natriumcarbonaat) worden gebruikt -zwaar en licht. De lichte vorm wordt eerst verkregen en een deel wordt dan omgezet in de zware vorm. Licht natriumcarbonaat bevat minder dan 0,5% natriumchloride. Zwaar natriumcarbonaat wordt verkregen door licht natriumcarbonaat te hydrateren tot het monohydraat (Na2CO3.H2O) en het vervolgens te dehydrateren om een product te verkrijgen met een grotere kristalgrootte en dichtheid.
De twee soorten hebben verschillende toepassingen.
De belangrijkste toepassingen van zwaar natriumcarbonaat zijn als vaste stof, met name bij het maken van glas, waar het wordt gebruikt als flux bij het smelten van silica (zand).
De toepassingen van licht natriumcarbonaat zijn van oudsher waar de chemische stof in oplossing nodig is.
Figuur 1 Gebruik van zowel zwaar als licht natriumcarbonaat.
In totaal wordt ongeveer 50% van de totale productie van natriumcarbonaat gebruikt om glas te maken, 18% om andere chemicaliën te maken en 10% in zeep en detergenten.
Jaarlijkse productie van natriumcarbonaat
China is ’s werelds grootste producent van natriumcarbonaat, goed voor 46% van de wereldproductie en de VS 23%. (IHS Markit, 2015)
| Wereld | 52 miljoen ton1,2 |
| China | 25 miljoen ton3 |
| V.S. | 12 miljoen ton1 |
| Europa | 11 miljoen ton |
| Rusland | 0.71 miljoen ton4 |
Gegevens uit:
1. 2018 Elements of the Business of Chemistry, American Chemistry Council.
2. Hiervan wordt 14,7 ton gedolven. Het overgrote deel wordt gedolven in de VS (11,7 miljoen ton) en Turkije (2 miljoen ton). De rest wordt gemaakt van natriumchloride en calciumcarbonaat.
3. IHS Markit, 2015
4. Federale Staatsdienst voor de Statistiek: Russische Federatie 2011
Vervaardiging van natriumcarbonaat
Er zijn twee belangrijke bronnen van natriumcarbonaat:
a) uit zout en calciumcarbonaat (via het ammoniak-sodaproces (Solvay))
b) uit natriumcarbonaat- en waterstofcarbonaatertsen (trona en nahcoliet)
(a) uit natriumchloride en calciumcarbonaat
De totale reactie kan worden beschouwd als tussen calciumcarbonaat en natriumchloride:
Calciumcarbonaat is echter te onoplosbaar om met een zoutoplossing te reageren. In plaats daarvan wordt het product verkregen in een reeks van zeven fasen.
Het proces staat bekend als het ammoniak-sodaproces of het Solvay-proces, genoemd naar de Belgische industrieel chemicus die er in 1861 octrooi op aanvroeg.
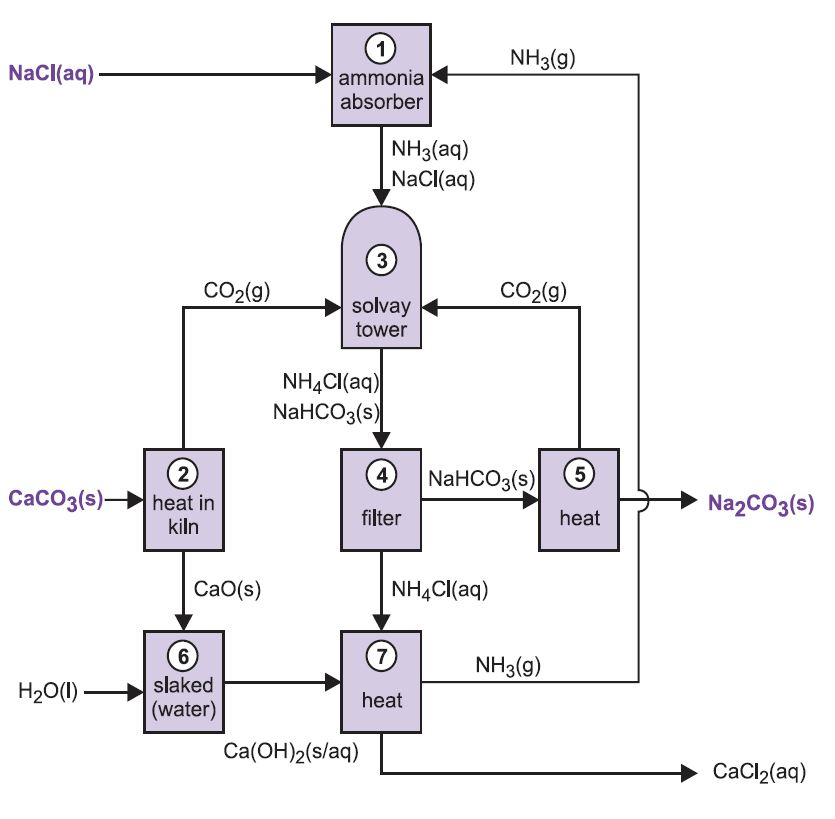
De verschillende fasen van het Solvay-proces zijn onderling met elkaar verbonden, zoals blijkt uit het onderstaande schema en de onderstaande beschrijving.
Figuur 2 Verschillende fasen van het Solvay-proces.
(1) Ammoniatie van pekel
Ammoniumgas wordt geabsorbeerd in geconcentreerde pekel, zodat een oplossing ontstaat die zowel natriumchloride als ammoniak bevat. Na+(aq), Cl-(aq), NH4+(aq), OH-(aq) ionen en NH3(aq) zijn aanwezig.
(2) Vorming van calciumoxide en kooldioxide
Kolen worden gevoed met een kalksteen/cokesmengsel (13:1 in massa). De cokes verbrandt in een tegenstroom van voorverwarmde lucht:
De verbrandingswarmte doet de temperatuur van de oven stijgen en de kalksteen ontleedt:
Het gas, dat ongeveer 40% kooldioxide bevat, wordt van kalkstof ontdaan en naar de carbonatietorens (Solvay) gevoerd. Het residu, calciumoxide, wordt gebruikt bij de terugwinning van ammoniak (zie stap 7 hieronder).
(3) De Solvay-toren
Dit is de belangrijkste fase in het proces. De ammoniakhoudende pekel van stap (1) wordt naar beneden geleid door de Solvay-toren, terwijl kooldioxide van de stappen (2) en (5) naar boven wordt geleid. De Solvay-toren is hoog en bevat een aantal paddestoelvormige keerschotten om de vloeistofstroom te vertragen en te breken zodat het kooldioxide efficiënt door de oplossing kan worden geabsorbeerd. Kooldioxide reageert bij het oplossen met de opgeloste ammoniak tot ammoniumwaterstofcarbonaat:
De oplossing bevat nu de ionen Na+(aq), Cl-(aq), NH4+(aq) en HCO3-(aq). Van de vier stoffen die door verschillende combinaties van deze ionen kunnen worden gevormd, is natriumwaterstofcarbonaat (NaHCO3) de minst oplosbare. Het slaat als vaste stof neer in het onderste deel van de toren, die wordt afgekoeld. Het nettoproces is:
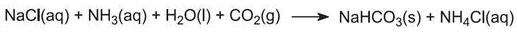
Een suspensie van vast natriumwaterstofcarbonaat in een oplossing van ammoniumchloride loopt uit de basis van de toren.
(4) Afscheiding van vast natriumwaterstofcarbonaat
De suspensie wordt gefiltreerd om het vaste natriumwaterstofcarbonaat te scheiden van de ammoniumchlorideoplossing, die vervolgens wordt gebruikt in stap (7).
(5) Vorming van natriumcarbonaat
Het natriumwaterstofcarbonaat wordt in roterende ovens bij 450 K verhit, zodat het uiteenvalt in natriumcarbonaat, water en kooldioxide:
Het kooldioxide wordt teruggestuurd naar de Solvay-toren voor gebruik in stap (3). Het product van het proces, watervrij natriumcarbonaat, wordt verkregen als een fijn wit poeder dat bekend staat als licht natriumcarbonaat.
(6) Vorming van calciumhydroxide
De laatste twee stappen, (6) en (7), hebben betrekking op de regeneratie van ammoniak uit ammoniumchloride (gemaakt in stap 3). De ongebluste kalk uit stap (2) wordt geslikt met een overmaat water, waardoor kalkmelk ontstaat:
(7) Regeneratie van ammoniak
Deze calciumhydroxidesuspensie wordt gemengd met de ammoniumchlorideoplossing die over is van stap (4) en verwarmd:
De ammoniak wordt aldus teruggewonnen, en teruggevoerd naar stap (1). Calciumchloride is het enige bijproduct van het hele proces.
Het totale proces is een elegant proces. In theorie zijn de enige grondstoffen kalksteen en pekel. Onvermijdelijk zijn er verliezen van ammoniak, en deze worden gecompenseerd door toevoeging van extra voorraden, zoals vereist in stap (1).
(b) Uit trona- en nahcoliet-ertsen
Het Solvay-proces wordt in de VS niet gebruikt. In plaats daarvan gebruikt de industrie twee ertsen en dit vertegenwoordigt ongeveer 30% van de wereldproductie. Het ene is trona, dat in grote hoeveelheden wordt gevonden in Wyoming. Trona heeft de formule:
Het erts wordt in vaste vorm gedolven en verhit om kooldioxide te verdrijven, zodat natriumcarbonaat ontstaat:
Het andere erts is nahcoliet, dat natriumwaterstofcarbonaat is. Bij verhitting vormt het natriumcarbonaat.