- Introduction
- Methodes
- Inclusie en exclusie van patiënten
- Standard Protocol Approvals and Patient Consents
- Examination Program
- Statistieken
- Resultaten
- Voorkomen van IDNA bij RLS-patiënten
- Clinische kenmerken van RLS-patiënten met IDNA in vergelijking met NID
- Clinische kenmerken van RLS-patiënten met IDNA in vergelijking met IDA
- Hematologische kenmerken bij controlepersonen
- Discussie
- Clinische kenmerken van IDNA in RLS
- Is IDNA een vroeg stadium voorafgaand aan IDA in RLS?
- Accessing and Diagnosing IDNA in RLS
- Conclusie
- Data Availability Statement
- Ethics Statement
- Author Contributions
- Funding
- Conflict of Interest
- Acknowledgments
- Supplementary Material
- Afkortingen
Introduction
Restless Legs Syndrome (RLS) is een veel voorkomende neurologische aandoening (1), en ijzertekort speelt een sleutelrol in de pathogenese ervan (2, 3). IJzergebrek komt vaak voor bij RLS en ijzergebreksanemie (IDA) is een bekende oorzaak van secundaire RLS (4, 5), die geassocieerd is met een zesvoudig verhoogd risico voor RLS in de algemene bevolking (6). IJzerdeficiëntie zonder anemie (IDNA, ook niet-anemische ijzerdeficiëntie) is meestal sluipend, en heeft onlangs de aandacht getrokken vanwege de wereldwijde prevalentie en de uitdaging voor diagnose en behandeling (7). Ondanks een duidelijke relatie tussen de klinische betekenis van RLS in de IDA populatie (6), is de prevalentie en kenmerken van IDNA in RLS niet systematisch onderzocht. Of IDNA een subgroep van RLS vertegenwoordigt en of IDNA een vroeg stadium is voorafgaand aan IDA in RLS is onbekend. In deze studie willen we de klinische kenmerken van RLS met IDNA onderzoeken in vergelijking met die zonder ijzertekort (NID, ook niet-ijzertekort) en met IDA-patiënten in een opeenvolgend cohort van Chinese RLS-patiënten.
Methodes
Inclusie en exclusie van patiënten
We rekruteerden continu patiënten uit onze RLS Specialistenkliniek en Bewegingsstoornissenkliniek in Department of Neurology, Shanghai General Hospital, Shanghai Jiao Tong University School of Medicine tussen jan. 2017 en okt. 2018. RLS werd gediagnosticeerd volgens de diagnostische criteria van de International Restless Legs Syndrome Study Group (RLSSG) van 2014 (1). Patiënten met andere neurologische aandoeningen, slechte samenwerking, of cognitieve stoornissen werden uitgesloten van het onderzoek. Leeftijd- en geslachtsgematchte gezonde controles zonder bloedarmoede werden gedurende dezelfde periode gerekruteerd in het gezondheidsonderzoekscentrum van ons ziekenhuis. Controles waren vrij van neurologische ziekte met inbegrip van RLS door face-to-face interview.
Standard Protocol Approvals and Patient Consents
De studie werd goedgekeurd door de Shanghai General Hospital Institutional Review Board en alle patiënten en gezonde controles opgenomen in de studie gaven schriftelijke toestemming.
Examination Program
RLS-patiënten werden geëvalueerd zoals we eerder beschreven (8). In het kort, we interviewden patiënten face-to-face in onze polikliniek. Patiënten die positief werden bevonden voor RLS werden gediagnosticeerd door twee neurologen gespecialiseerd in RLS. Wij registreerden demografische informatie, geschiedenis, symptomen, medicatie, algemeen neurologisch en medisch onderzoek, en MMSE voor alle gerekruteerde patiënten. Een semi-gestructureerde vragenlijst werd verder beoordeeld, met inbegrip van de leeftijd waarop RLS begon, RLS familiegeschiedenis (bekendheid gedefinieerd als “eerstegraads familieleden”), type en topografie van sensaties, en of RLS symptomen gecorreleerd waren met seizoensgebonden variatie. De ernst van RLS gedurende 1 week voor het interview werd beoordeeld aan de hand van de International RLS rating scale (IRLSRS) (9). Onderzoeken zoals vasculaire echografie, zenuwgeleidingssnelheden, elektromyografie, enz. werden uitgevoerd indien klinisch geïndiceerd om mogelijke RLS mimics zoals perifere polyneuropathieën, veneuze stasis, vasculaire claudicatio, reumatoïde artritis, enz. uit te sluiten. Proefpersonen met een medicatiegeschiedenis van neuroleptica of andere medicatie die volgens de auteurs mogelijk verband hield met RLS in de voorafgaande drie maanden werden ook uitgesloten. We sloten diegenen uit met opvallende comorbiditeiten die geassocieerd werden met secundaire RLS zoals chronisch nierfalen, zwangerschap, ziekte van Parkinson, perifere neuropathie, beroerte, en ataxie. Bloedtesten voor hemoglobine en perifere ijzerstatus inclusief serum ferritine, ijzer, transferrine, en totale ijzerbindende capaciteit (TIBC) werden beoordeeld. Transferrine verzadiging (TSAT) werd berekend als serum ijzer/TIBC × 100. Een normaal hemoglobinegehalte werd gedefinieerd als vrouwen ≥ 113 g/L en mannen ≥ 131 g/L volgens de normale waarde in ons ziekenhuis. IDNA wordt gedefinieerd als serumferritine <75 μg/L (of ferritine ≥ 75 μg/L maar TSAT <20%) met normale hemoglobinespiegel (10, 11). IDA wordt gediagnosticeerd wanneer hemoglobine <113 g/L (vrouwen) of <131 g/L (mannen), evenals serumferritine <75 μg/L (of serumferritine ≥ 75 μg/L maar TSAT <20%).
Statistieken
De gegevens werden geanalyseerd met SPSS 21.0 voor Windows (IBM Co., USA). Alle gegevens werden gepresenteerd als gemiddelden ± standaarddeviaties. Aangezien de meeste variabelen niet normaal verdeeld waren, werd de Kruskal-Wallis test gebruikt voor vergelijkingen tussen de drie groepen, en post-hoc Mann-Whitney wanneer P < 0,05. Verschillen in proporties werden geanalyseerd met Pearson’s chi-kwadraat of Fisher’s exact test indien van toepassing. P < 0,05 werd als significant beschouwd. Gezien de mogelijke effecten van medicamenteuze behandeling op RLS symptoom en andere kenmerken, berekenden we alle gegevens tweemaal in de totale RLS patiënten en in RLS patiënten zonder medicatie, respectievelijk.
Resultaten
We schreven continu een totaal van 196 primaire RLS patiënten zonder anemie (IDNA RLS en NID RLS) in deze studie in, waaronder 66 mannelijke patiënten (33,7%) en 130 vrouwelijke patiënten (66,3%). De gemiddelde leeftijd was 53,0 ± 13,5 jaar oud. 65,8% (129/196) van de RLS patiënten gebruikten geen medicatie voor RLS (109 drug-naïeve, en 20 drug-vrij voor meer dan 2 weken bij interview). We includeerden ook 26 RLS patiënten met IDA (22 drug-naïef). We sloten vijf anemische RLS patiënten uit (Hb <113 g/L voor vrouwen en Hb <131 g/L voor mannen) die geen bewijs van ijzertekort hadden (serum ferritine ≥ 75 μg/L evenals TIBC ≥ 20%, gemiddeld serum ferritine als 236,1 ± 119,3 μg/L). Geen van de RLS patiënten met IDA had tekenen van infectie, en de oorzaken van IDA RLS werden opgesomd (tabel 1). Bovendien verzamelden we 63 gezonde controlepersonen, waaronder 22 mannelijke (34,9%) en 41 vrouwelijke (65,1%) proefpersonen, en de gemiddelde leeftijd van de controlegroep was 51,0 ± 12,0 jaar oud (de gemiddelde leeftijd van 51,0 ± 10,4 en 51,0 ± 12,8 voor respectievelijk mannen en vrouwen). Er waren geen significante verschillen in zowel geslacht (RLS vs. controle: 66,3 vs. 65,1% voor vrouwen, P > 0,05) als leeftijd (RLS vs. controle: 53,0 ± 13,5 vs. 51,0 ± 12,0, P > 0,05) tussen RLS patiënten en controles. Gedetailleerde demografische informatie van patiënten met RLS in elke groep wordt getoond (Tabel 2).
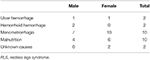
Tabel 1. Mogelijke oorzaken van ijzertekort bij anemische RLS patiënten.
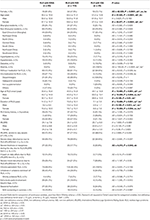
Tabel 2. Demografische informatie en klinische kenmerken van RLS-patiënten met IDNA, NID en IDA.
Voorkomen van IDNA bij RLS-patiënten
Van de 196 RLS-patiënten (130 vrouwen, 66 mannen) zonder anemie of andere comorbiditeiten, hadden 83 (42,3%) een ijzertekort. Prevalentie van IDNA bij vrouwen (58,5%, 76/130) is veel hoger dan bij mannen (10,6%, 7/66) in dit cohort van RLS-patiënten zonder anemie (tabel 2), met een relatief risico van 5,51 (95% betrouwbaarheidsinterval 2,70-11,27, p < 0,0001).
Clinische kenmerken van RLS-patiënten met IDNA in vergelijking met NID
In vrouwelijke RLS-patiënten zonder anemie had de IDNA-groep zowel bij het interview als bij het begin van RLS een jongere leeftijd in vergelijking met de NID-groep (P < 0,01; Tabel 2). Hoewel er geen verschil was in de ernst van RLS volgens de IRLSRS, vonden we meer patiënten met ernstige/zeer ernstige vermoeidheid of slaperigheid overdag in de IDNA groep vergeleken met de NID groep (32,5 vs. 17,7%, P < 0,05; Tabel 2). Er was geen verschil met betrekking tot familiegeschiedenis, ernst, lateraliteit, locatie en seizoensfluctuatie van RLS tussen de IDNA- en de NID-groep, noch bij mannen noch bij vrouwen. De IDNA RLS groep presenteerde lagere serum ferritine (mannen en vrouwen, P < 0.0001) evenals hogere transferrine en TIBC waarden (vrouwen, P < 0.0001) in vergelijking met de NID RLS groep (Figuur 1, Tabel 3).
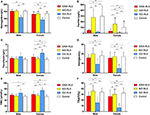
Figuur 1. De hematologische en ijzerparameters per groep en geslacht (A) Hemoglobine. (B) Ferritine. (C) Transferrine. (D) IJzer. (E) TIBC. (F) TSAT. **P < 0.01, *P < 0.05, Kruskal-Wallis test en post-hoc Mann-Whitney test. Gegevens vergeleken tussen IDNA RLS (n = 83), NID RLS (n = 113), IDA RLS (n = 26), en controles (n = 63). ##P < 0.01, #P < 0.05, Mann-Whitney U-test. Gegevens vergeleken tussen mannen en vrouwen in elke groep van IDNA RLS, NID RLS, IDA RLS, en controles. IJzergebrek werd gedefinieerd als ferritinegehalte <75 μg/L, of ferritine 75 μg/L, echter TSAT <20%. IDA, ijzergebreksanemie; IDNA, ijzergebrek zonder anemie; NID, niet-ijzergebrek; RLS, rustelozebenensyndroom; TIBC, totale ijzerbindingscapaciteit; TSAT, transferrineverzadiging.
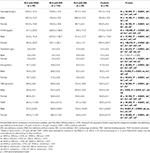
Tabel 3. Hematologische gegevens van RLS patiënten met IDNA, NID, IDA, en controles.
Na uitsluiting van RLS patiënten die medicatie voor RLS gebruikten, vertoonde de IDNA RLS groep nog steeds hogere percentages van ernstige/zeer ernstige vermoeidheid/slaperigheid overdag in vergelijking met de NID RLS groep, hoewel niet op een significant niveau (35 vs. 18,8%, P = 0,078). Andere kenmerken tussen IDNA RLS en NID RLS waren vergelijkbaar (aanvullende tabel 1).
Clinische kenmerken van RLS-patiënten met IDNA in vergelijking met IDA
De IDA-groep had ernstiger verstoorde serum ijzermetabolische parameters dan de IDNA-groep, waaronder lager ferritine (man, P < 0.05; vrouwelijk, P < 0,0001), hogere transferrine (vrouwelijk, P < 0,0001), lager ijzer (mannelijk, P < 0,05; vrouwelijk, P < 0,0001), hogere TIBC (vrouwelijk, P < 0,0001), en lagere TSAT (mannelijk, P < 0,05; vrouwelijk, P < 0,0001) waarden in serum (figuur 1, tabel 3). IDNA RLS had een langere ziekteduur (P < 0,01 bij mannen, P < 0,05 bij vrouwen) en jongere leeftijd bij aanvang (alleen significant bij mannen met P < 0,05) dan IDA RLS. Er waren geen verschillen met betrekking tot positieve familieanamnese, ernst (IRLSRS), lateraliteit, lokalisatie, en seizoensfluctuatie van RLS tussen IDNA RLS en IDA RLS, noch bij mannen noch bij vrouwen RLS patiënten (Tabel 2). De resultaten waren vergelijkbaar na het uitsluiten van RLS-patiënten met medicatie voor RLS (aanvullende tabel 1).
Hematologische kenmerken bij controlepersonen
Diagnostische criteria voor ijzertekort zijn verschillend tussen de algemene bevolking en RLS-patiënten (zoals bespreking hieronder). Volgens de afkapwaarde van ons ziekenhuis voor ijzertekort in de algemene bevolking (20 μg/L), vonden we dat geen van de mannelijke proefpersonen in de controlegroep ijzertekort had, terwijl vier vrouwelijke controlepersonen ijzertekort vertoonden (twee proefpersonen met serumferritine <20 μg/L, en twee proefpersonen met ferritine ≥ 20 μg/L maar TSAT <20%). Er was geen significant verschil in prevalentie van ijzertekort bij de controles tussen mannen (0%, 0/22) en vrouwen (9,8%, 4/41; P = 0,288). De hematologische testen op hemoglobine en ijzerparameters in de controlegroep waren het meest vergelijkbaar met de NID RLS groep in vergelijking met de IDNA of IDA groep (figuur 1, tabel 3).
Discussie
De pathofysiologie van primaire en secundaire RLS is onvolledig begrepen. IJzertekort in de hersenen speelt een fundamentele rol in de pathogenese van RLS, en aandoeningen die worden gekenmerkt door systemisch ijzertekort, zoals bloedarmoede en zwangerschap, zijn geassocieerd met een hogere prevalentie van RLS-symptomen (2, 3, 5, 6). IDA is een erkende comorbiditeit geassocieerd met secundaire RLS (4-6, 12). IDNA is meer sluipend, en de kenmerken ervan zijn minder bekend bij RLS patiënten.
Clinische kenmerken van IDNA in RLS
In het algemeen zijn vrouwen gevoeliger voor RLS (1, 13, 14). Vrouwen in de vruchtbare leeftijd hebben ook meer ijzertekort dan mannen in de algemene bevolking (15). In deze studie bij RLS patiënten zonder anemie, vonden we ook een significante geslachtsafhankelijke discriminatie. Vrouwelijke RLS-patiënten lopen een veel hoger risico op IDNA dan mannelijke RLS-patiënten (relatief risico van 5,51, p < 0,0001). Minder mannelijke RLS-patiënten leden aan ijzertekort, met of zonder anemie. Bij de controles vonden we, hoewel zonder statistische significantie, bij 9,8% van de vrouwelijke proefpersonen ijzertekort, terwijl dit bij geen van de mannelijke proefpersonen het geval was. IJzertekort is ongewoon bij mannen, dus als mannelijke RLS patiënten ijzertekort hebben, moet aanvullend onderzoek worden gedaan naar secundaire oorzaken zoals chronische bloedingen en ondervoeding door gastro-intestinale stoornissen.
Vergeleken met de “normale” NID RLS groep, vertoonde de IDNA RLS groep een vroegere aanvangsleeftijd van RLS en een jongere leeftijd bij interview bij vrouwen, maar niet bij mannen (Tabel 2). In een eerdere studie vonden we bij vroege RLS een positievere RLS familiegeschiedenis en ernstiger gestoorde perifere ijzerparameters (lager serum ferritine, en hogere serum transferrine en TIBC waarden) in vergelijking met late RLS (8). Onlangs vonden we dat IDNA in RLS enkele genetische factoren voorspelt in vergelijking met NID in RLS (ongepubliceerde gegevens). Een potentieel subtype in associatie met genetische achtergrond, ijzertekort, en early onset RLS verdient verder onderzoek. Vermoeidheid, zwakte, concentratieproblemen, geheugenverlies en slechte werkprestaties zijn aspecifieke symptomen die vaak geassocieerd worden met ijzertekort (7, 16). Allen et al. (6) rapporteerden eerder dat IDA patiënten met RLS meer vermoeidheid, slechtere slaapkwaliteit, en verminderde energie overdag vertoonden in vergelijking met IDA patiënten zonder RLS. Wij vonden dat RLS patiënten met IDNA ook meer kans hadden op manifestaties van ernstige/zeer ernstige vermoeidheid of slaperigheid overdag als gevolg van RLS in vergelijking met RLS patiënten met NID (afkappunt bij 75 μg/L, 32,5 vs. 17,7%, P < 0,05, Tabel 2). Wanneer alleen de RLS patiënten zonder medicatie opnieuw werden geanalyseerd, vertoonden de IDNA RLS patiënten nog steeds een trend van meer gevoeligheid voor ernstige/zeer ernstige vermoeidheid of slaperigheid overdag, hoewel dit geen statistische significantie bereikte (35 vs. 18,8%, P = 0,078, Aanvullende Tabel 1). Er werd geen verschil in ernstige/zeer ernstige vermoeidheid of slaperigheid overdag gevonden tussen IDNA RLS en IDA RLS in deze studie (Tabel 2). Een tekort aan ijzer, op een continuüm van IDA tot IDNA, wordt geassocieerd met een verminderde activiteit van ijzerafhankelijke enzymen, een verminderde cellulaire oxidatieve capaciteit, evenals een verminderde energie-efficiëntie (17-19). Wanneer we een striktere definitie voor IDNA gebruikten (serum ferritine afkapwaarde vastgesteld op 50 μg/L), vonden we nog steeds meer IDNA RLS patiënten die leden aan ernstige/zeer ernstige vermoeidheid of slaperigheid overdag in vergelijking met NID RLS patiënten (32,3 vs. 19,8%), maar dit was niet significant (P > 0,05; Supplementaire Tabel 2). Periodic leg movement in sleep (PLMS) is nauw gerelateerd aan RLS, en locus binnen het BTBD9-gen is gecorreleerd aan het risico van zowel PLMS als RLS (20, 21). Wij hebben met name alleen de slaapkwaliteit geëvalueerd met behulp van subitem 4 van de IRLSRS, en wij hebben geen gedetailleerde beoordeling van de slaapstatus uitgevoerd met behulp van de polysomnografie (PSG) meting. Bijgevolg waren er geen gegevens beschikbaar over PLMS en andere slaapgerelateerde parameters, die in belangrijke mate kunnen bijdragen tot vermoeidheid of slaperigheid overdag. Daarom moet het verband tussen vermoeidheid/slaperigheid overdag en IDNA verder onderzocht worden. We vonden geen significant verschil in ernst van RLS tussen de IDNA en de NID groep. Perifeer ijzertekort verhoogt het risico voor de prevalentie van RLS in eerdere klinische studies (6). Verlaagde serum ijzerconcentraties verlagen globaal de ijzergehaltes in de hersenen, en ijzerbehandeling is gunstig voor RLS patiënten met lage perifere ijzergehaltes (10). Niettemin vertonen talrijke RLS patiënten zonder systemisch ijzertekort toch een hersenspecifiek ijzertekort (22). Studies bij knaagdieren meldden dat de serum ijzerstatus niet gecorreleerd was met regionale ijzerniveaus in de hersenen, en daarom mogelijk beperkt gerelateerd is aan kenmerken van RLS (23, 24).
Is IDNA een vroeg stadium voorafgaand aan IDA in RLS?
Iron deficiëntie kan worden geclassificeerd in twee niveaus, IDNA en IDA, afhankelijk van de hemoglobine meetwaarde. In deze studie hadden RLS-patiënten met IDA de laagste hemoglobine-, ferritine- en ijzerniveaus, evenals de hoogste transferrine- en TIBC-waarden in vergelijking met IDNA RLS en NID RLS (figuur 1, tabel 3). Hoewel er geen significante verschillen waren op hemoglobine niveaus tussen IDNA RLS en NID RLS (zowel bij mannelijke als vrouwelijke RLS patiënten), was serum hemoglobine bij IDNA RLS patiënten lager in vergelijking met controles (alleen bij vrouwen, P < 0.05, Figuur 1, Tabel 3). Bovendien lagen de waarden van ijzerparameters in de IDNA RLS groep tussen die van de NID RLS of de controlegroep en de IDA RLS groep (figuur 1, tabel 3). Deze resultaten zijn consistent met het standpunt van IDNA is een milder ijzertekort voorafgaand aan de ontwikkeling van anemie. Van belang is dat serum ijzerparameters worden beschouwd als een afspiegeling van de perifere ijzerstatus voornamelijk in de erytrons (25), terwijl ijzeropslag in andere organen (zoals lever, hersenen, etc.) gevalideerd moet worden bij IDNA proefpersonen.
Niettemin zijn oorzaken en kenmerken van IDNA RLS en IDA RLS niet geheel vergelijkbaar. In deze studie hadden de meeste RLS-patiënten met IDA opmerkelijke comorbiditeiten die verband hielden met ondervoeding of chronisch overmatig bloedverlies, waaronder bloedingen in het spijsverteringskanaal, hemorragische bloedingen en menorragie (tabel 1), wat in overeenstemming is met de vorige studie (12). Het is vermeldenswaard dat menorragie een veel voorkomende oorzaak is van IDA bij vrouwen in de reproductieve leeftijd, die kan voortvloeien uit baarmoederfibromen, adenomyose en andere gynaecologische aandoeningen. Ondervoeding kan secundair zijn aan gastro-intestinale stoornissen, vegetarisch dieet, en misvattingen over het zelfbeeld bij jonge vrouwen. Bijgevolg is het ijzertekort bij de meerderheid van de IDA RLS patiënten in deze studie een “absoluut ijzertekort”. Daarentegen hebben RLS patiënten met IDNA meestal geen noemenswaardige comorbiditeiten. Oorzaken van IDNA RLS zijn sluipend en IDNA in RLS behoort over het algemeen tot het bereik van primaire RLS (4) geassocieerd met “functioneel ijzertekort”. We kunnen echter geen sluipende secundaire oorzaken uitsluiten bij IDNA RLS-patiënten, die kunnen leiden tot onvoldoende toevoer van ijzer in het lichaam.
Vergeleken met RLS met IDNA, hadden patiënten met IDA een oudere leeftijd van aanvang van RLS, evenals een kortere duur van RLS bij zowel mannen als vrouwen (significanter bij mannen; tabel 2), wat in overeenstemming was met het standpunt dat secundaire RLS meestal een oudere aanvangsleeftijd heeft (26). Volgens onze ervaring vertonen deze IDA RLS patiënten met duidelijke oorzaken (zoals acuut bloedverlies) gewoonlijk een kortere ziekteduur en een sneller herstel of verlichting wanneer behandelbare comorbide aandoeningen worden gecorrigeerd en de ijzerstatus wordt hersteld. Zij hebben meestal geen langdurige RLS-therapie nodig, wat enigszins verschilt van primaire RLS-patiënten. Toekomstige longitudinale studies zijn nodig om de behandelingseffecten van ijzersupplementen bij RLS patiënten met IDA te bevestigen. Andere studies naar comorbide RLS van zwangerschap (27) en uremie (28) meldden verbetering na bevalling en niertransplantatie, wat suggereert dat veranderingen in geassocieerde metabole factoren RLS kunnen uitlokken bij gevoelige personen (5).
Daarom zijn er heterogeniteiten in zowel IDA RLS als IDNA RLS. Hoewel IDNA in het algemeen wordt beschouwd als een vroeg stadium voorafgaand aan anemie (7), is IDNA RLS mogelijk niet slechts een prodromaal stadium voorafgaand aan IDA RLS.
Accessing and Diagnosing IDNA in RLS
Hoewel beenmergbiopsie wordt beschouwd als de beste indicator voor ijzerstatus, wordt het zelden uitgevoerd vanwege mogelijke risico’s van infectie of bloeding op de biopsieplaats (29). De meest gebruikte laboratoriumindicatoren voor de ijzerstatus zijn ferritine, dat ofwel de ijzeropslag in het weefsel ofwel de hoeveelheid ijzer die direct beschikbaar is voor erytropoëse weergeeft (30). Hoewel serumferritine een gevoelige marker is voor de beoordeling van de totale ijzeropslag in het lichaam, kunnen andere condities zoals ontstekingsstatus, leeftijd en nierfunctie verstorend werken en de serumferritinespiegel verhogen (31). Ferritine en transferrine zijn ook acute-fase reactanten, en ferritine niveau kan worden verhoogd en transferrine niveaus worden verlaagd onder een inflammatoire conditie (32). Daarom kan zelfs bij serumferritine ≥ 75 μg/L en TSAT <20% nog sprake zijn van een daadwerkelijk ijzertekort (11, 33).
Een afkappunt voor de serumferritineconcentratie van <30 μg/L is het meest gevoelig en specifiek om een potentieel ijzertekort in de algemene bevolking vast te stellen (17, 18), en IDNA wordt geclassificeerd als het hebben van normale hemoglobinespiegels met verlaagde serumferritinespiegels (<20 μg/L) (34, 35). Klinische laboratoria stellen de ondergrens van het referentiebereik voor serumferritine gewoonlijk op 10-20 μg/L in de gewone populatie (36) (in ons ziekenhuis is de ondergrens vastgesteld op 20 μg/L). Aanzienlijk hogere drempelwaarden voor serumferritine worden gewoonlijk gebruikt om ijzertekort te definiëren bij chronische aandoeningen zoals hartfalen en chronische nieraandoeningen (7, 17). De beoordelingscriteria om ijzertekort bij RLS te definiëren verschilt ook van die bij gezonde controles, hoewel er nog geen consensus bestaat over de exacte afkapwaarde voor ferritine om IDNA bij RLS aan te duiden. Recente studies suggereren dat RLS-patiënten als ijzertekort moeten worden beschouwd wanneer hun ferritineconcentratie lager is dan 75 μg/L (10, 11, 27). Eerdere studies definieerden ferritineconcentratie onder 50 μg/L echter meestal als “lage ijzerstatus” bij RLS (37, 38). Omdat er geen gegevens beschikbaar zijn over beschrijvingen van verschillende afkappunten, vergeleken we kenmerken van IDNA RLS en NID RLS met behulp van zowel 75 als 50 μg/L als de afkapwaarden van ferritine voor ijzertekort. Wij vonden dat bij gebruik van 50 μg/L als ondergrens van ferritine, 33,2% (65/196) van de RLS-patiënten aan de criteria van IDNA voldoen. De resultaten waren vrij gelijkaardig voor de twee gebruikte drempels, behalve dat de toegenomen ernstige/zeer ernstige vermoeidheid of slaperigheid overdag bij IDNA RLS in vergelijking met NID RLS niet significant was wanneer de afkapwaarde van ferritine op 50 μg/L werd gesteld (tabel 2, aanvullende tabel 2).
Onze studie had enkele beperkingen: Ten eerste was dit een cross-sectionele studie en het ontbreken van longitudinale gegevens maakte het moeilijk om de evolutie van RLS symptomen en effecten van behandeling te identificeren. Bovendien kan er een bias zijn bij het terugroepen. Ten tweede was dit een studie in één centrum, aangezien ongeveer een kwart van de patiënten lokale inwoners van Shanghai waren en de meerderheid van de patiënten uit Oost-China kwam. Gezien het uitgestrekte grondgebied in China en de mogelijk verschillende omgevingsfactoren, kan er sprake zijn van een selectiebias. Ten derde hebben we geen PSG meting uitgevoerd om de slaapstatus van RLS patiënten en controles in detail te evalueren. Ten vierde, ongeveer een derde van de RLS patiënten in deze studie gebruikten dopaminergica en/of gabapentin enacarbil therapie (slechts één patiënt kreeg een ijzersuppletie), wat de klinische kenmerken kan beïnvloeden. We hebben echter alle gegevens opnieuw berekend bij RLS-patiënten zonder medicatie en kwamen tot dezelfde conclusie. Dit gezegd zijnde, heeft onze studie wel enkele voordelen. We bestudeerden in detail het klinische spectrum van RLS en sloten andere comorbiditeiten of RLS mimics uit. We interviewden elke patiënt face-to-face, en we sloten zorgvuldig de atypische RLS patiënten uit tijdens de follow-up. Er zijn beperkte studies gedaan naar kenmerken van IDNA in RLS, wij onderzochten gedetailleerde klinische kenmerken van IDNA in opeenvolgende Chinese RLS patiënten.
Conclusie
IDNA komt frequent voor bij patiënten met RLS, vooral bij vrouwen, en heeft een aantal speciale klinische kenmerken. IDNA had een jongere leeftijd zowel bij het interview als bij het begin van RLS in vergelijking met NID bij vrouwelijke RLS-patiënten. IDNA komt niet vaak voor bij mannelijke RLS patiënten en mannen met ijzertekort moeten worden geëvalueerd voor comorbide aandoeningen. Kenmerken van RLS patiënten met IDNA zijn verschillend van RLS met IDA. RLS met IDNA vertegenwoordigt een belangrijk en over het hoofd gezien volksgezondheidsprobleem dat meer klinische aandacht verdient en in de behandelingsstrategie aan bod moet komen. Regelmatige screening van perifere ijzerparameters, zelfs bij patiënten met een normaal bloedbeeld, wordt aanbevolen voor tijdige passende therapie.
Data Availability Statement
De datasets die voor deze studie zijn gegenereerd, zijn op verzoek beschikbaar bij de corresponderende auteur.
Ethics Statement
De studies met menselijke deelnemers werden beoordeeld en goedgekeurd door de Shanghai General Hospital Institutional Review Board. De patiënten/deelnemers gaven hun schriftelijke geïnformeerde toestemming om deel te nemen aan deze studie.
Author Contributions
X-YZ concept/ontwerp/uitvoering van het project/schrijven van het manuscript. T-TW: uitvoering van het project/verzameling en interpretatie van gegevens/schrijven van het manuscript. H-MW en JS: laboratoriummetingen. XL, L-YN, T-JC, en M-YQ: uitvoering van het project/verzameling en interpretatie van de gegevens. TL en WO: kritische revisie van het manuscript voor belangrijke intellectuele inhoud. Y-CW: concept/ontwerp/supervisie van het project, kritische revisie van het manuscript voor belangrijke intellectuele inhoud. Alle auteurs: manuscriptvoorbereiding.
Funding
Dit werk werd gesponsord door Shanghai Municipal Planning Commission of Science and Research Fund (201740017), het Clinical Research Innovation Plan van Shanghai General Hospital (CTCCR-2018C02), het Interdisciplinair Programma van Shanghai Jiao Tong University (YG2015QN21), en National Natural Science Foundation of China (No. 81671251).
Conflict of Interest
De auteurs verklaren dat het onderzoek is uitgevoerd in afwezigheid van commerciële of financiële relaties die zouden kunnen worden opgevat als een potentieel belangenconflict.
Acknowledgments
We danken alle patiënten en gezonde controlepersonen die aan deze studie hebben deelgenomen. Wij danken het personeel van het Centrum voor Lichamelijk Onderzoek in het Algemeen Ziekenhuis van Shanghai. Wij danken ook het Department of Bioinformatics and Biostatistics, School of Life Sciences and Biotechnology, Shanghai Jiao Tong University, Yue Zhang voor statistische consultatie.
Supplementary Material
Het Supplementary Material voor dit artikel is online te vinden op: https://www.frontiersin.org/articles/10.3389/fneur.2020.00298/full#supplementary-material
Afkortingen
CI, betrouwbaarheidsinterval; IRLSSG, International Restless Legs Study Group; MMSE, Mini-Mental State Examination; NID, zonder ijzertekort; RLS, restless legs syndrome; IDA, iron deficiency anemia; IDNA, iron deficiency without anemia; IRLSRS, International Restless Legs Syndrome Rating Scale; TIBC, totale ijzerbindingscapaciteit; TSAT, transferrineverzadiging.
1. Allen RP, Picchietti DL, Garcia-Borreguero D, Ondo WG, Walters AS, Winkelman JW, et al. Restless legs syndrome/Willis-Ekbom disease diagnostic criteria: updated International Restless Legs Syndrome Study Group (RLSSG) consensus criteria-history, rationale, description, and significance. Sleep Med. (2014) 15:860-73. doi: 10.1016/j.sleep.2014.03.025
CrossRef Full Text | Google Scholar
2. Connor JR, Boyer PJ, Menzies SL, Dellinger B, Allen RP, Ondo WG, et al. Neuropathological examination suggests impaired brain iron acquisition in restless legs syndrome. Neurologie. (2003) 61:304-9. doi: 10.1212/01.WNL.0000078887.16593.12
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Allen RP, Earley CJ. The role of iron in restless legs syndrome. Mov disord. (2007) 18(22 Suppl):S440-8. doi: 10.1002/mds.21607
CrossRef Full Text | Google Scholar
4. Trenkwalder C, Allen R, Hogl B, Clemens S, Patton S, Schormair B, et al. Comorbidities, treatment, and pathophysiology in restless legs syndrome. Lancet Neurol. (2018) 17:994-1005. doi: 10.1016/S1474-4422(18)30311-9
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Trenkwalder C, Allen R, Hogl B, Paulus W, Winkelmann J. Restless legs syndrome associated with major diseases: a systematic review and new concept. Neurology. (2016) 86:1336-43. doi: 10.1212/WNL.000000002542
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Allen RP, Auerbach S, Bahrain H, Auerbach M, Earley CJ. The prevalence and impact of restless legs syndrome on patients with iron deficiency anemia. Am J Hematol. (2013) 88:261-4. doi: 10.1002/ajh.23397
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Soppi ET. IJzergebrek zonder anemie – een klinische uitdaging. Clin Case Rep. (2018) 6:1082-6. doi: 10.1002/ccr3.1529
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Zhu XY, Wu TT, Wang HM, Ni LY, Li X, Liu Y, et al. Klinische kenmerken en subtypes van rusteloze benen syndroom in de Chinese bevolking: een studie van 359 patiënten. Sleep Med. (2019) 59:15-23. doi: 10.1016/j.sleep.2019.01.053
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Walters AS, LeBrocq C, Dhar A, Hening W, Rosen R, Allen RP, et al. International Restless Legs Syndrome Study, Validation of the International Restless Legs Syndrome Study Group rating scale for restless legs syndrome. Sleep Med. (2003) 4:121-32. doi: 10.1016/S1389-9457(02)00258-7
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Allen RP, Picchietti DL, Auerbach M, Cho YW, Connor JR, Earley CJ, et al. International Restless Legs Syndrome Study, Evidence-based and consensus clinical practice guidelines for the iron treatment of restless legs syndrome/Willis-Ekbom disease in adults and children: an IRLSSG task force report. Sleep Med. (2018) 41:27-44. doi: 10.1016/j.sleep.2017.11.1126
CrossRef Full Text | Google Scholar
11. Trenkwalder C, Winkelmann J, Oertel W, Virgin G, Roubert B, Mezzacasa A, et al. Ferric carboxymaltose bij patiënten met restless legs syndrome en niet-anemisch ijzertekort: een gerandomiseerde trial. Mov Disord. (2017) 32:1478-82. doi: 10.1002/mds.27040
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Mehmood T, Auerbach M, Earley CJ, Allen RP. Response to intravenous iron in patients with iron deficiency anemia (IDA) and restless leg syndrome (Willis-Ekbom disease). Sleep Med. (2014) 15:1473-6. doi: 10.1016/j.sleep.2014.08.012
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Thomas K, Watson CB. Restless legs syndrome in women: a review. J Womens Health. (2008) 17:859-68. doi: 10.1089/jwh.2007.0515
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Ohayon MM, O’Hara R, Vitiello MV. Epidemiologie van restless legs syndrome: een synthese van de literatuur. Sleep Med Rev. (2012) 16:283-95. doi: 10.1016/j.smrv.2011.05.002
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Umbreit J. Iron deficiency: a concise review. Am J Hematol. (2005) 78:225-31. doi: 10.1002/ajh.20249
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Sawada T, Konomi A, Yokoi K. Iron deficiency without anemia is associated with anger and fatigue in young Japanese women. Biol Trace Elem Res. (2014) 159:22-31. doi: 10.1007/s12011-014-9963-1
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Camaschella C. Iron-deficiency anemia. N Engl J Med. (2015) 372:1832-43. doi: 10.1056/NEJMra1401038
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Lopez A, Cacoub P, Macdougall IC, Peyrin-Biroulet L. Iron deficiency anemia. Lancet. (2016) 387:907-16. doi: 10.1016/S0140-6736(15)60865-0
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Haas JD, Brownlie T. Iron deficiency reduced work capacity: a critical review of the research to determine a causal relationship. J Nutr. (2001) 131:676S-88S; discussion 688S-90S. doi: 10.1093/jn/131.2.676S
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Stefansson H, Rye DB, Hicks A, Petursson H, Ingason A, Thorgeirsson TE, et al. A genetic risk factor for periodic limb movements in sleep. N Engl J Med. (2007) 357:639-47. doi: 10.1056/NEJMoa072743
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Li G, Tang H, Wang C, Qi X, Chen J, Chen S, et al. Associatie van BTBD9 en MAP2K5/SKOR1 met het rustelozebenensyndroom in de Chinese bevolking. Sleep. (2017) 40:zsx028. doi: 10.1093/sleep/zsx028
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Earley CJ, Connor J, Garcia-Borreguero D, Jenner P, Winkelman J, Zee PC, et al. Altered brain iron homeostasis and dopaminergic function in Restless Legs Syndrome (Willis-Ekbom Disease). Sleep Med. (2014) 15:1288-301. doi: 10.1016/j.sleep.2014.05.009
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Erikson KM, Pinero DJ, Connor JR, Beard JL. Regional brain iron, ferritin and transferrin concentrations during iron deficiency and iron repletion in developing rats. J Nutr. (1997) 127:2030-8. doi: 10.1093/jn/127.10.2030
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Yin L, Unger EL, Jellen LC, Earley CJ, Allen RP, Tomaszewicz A, et al. Systems genetic analysis of multivariate response to iron deficiency in mice. Am J Physiol Regul Integr Comp Physiol. (2012) 302:R1282-96. doi: 10.1152/ajpregu.00634.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Hallberg L, Hulthen L. Perspectives on iron absorption. Blood Cells Mol Dis. (2002) 29:562-73. doi: 10.1006/bcmd.2002.0603
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Shukla G, Gupta A, Pandey RM, Kalaivani M, Goyal V, Srivastava A, et al. What features differentiate unilateral from bilateral restless legs syndrome? Een vergelijkend observationeel onderzoek bij 195 patiënten. Sleep Med. (2014) 15:714-9. doi: 10.1016/j.sleep.2014.01.025
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Picchietti DL, Hensley JG, Bainbridge JL, Lee KA, Manconi M, McGregor JA, et al. International Restless Legs Syndrome Study, Consensus clinical practice guidelines for the diagnosis and treatment of restless legs syndrome/Willis-Ekbom disease during pregnancy and lactation. Sleep Med Rev. (2015) 22:64-77. doi: 10.1016/j.smrv.2014.10.009
CrossRef Full Text | Google Scholar
28. Winkelmann J, Stautner A, Samtleben W, Trenkwalder C. Langetermijnbeloop van het rustelozebenensyndroom bij dialysepatiënten na niertransplantatie. Mov Disord. (2002) 17:1072-6. doi: 10.1002/mds.10231
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Bain BJ. Morbiditeit van beenmergbiopsie: overzicht van 2003. J Clin Pathol. (2005) 58:406-8. doi: 10.1136/jcp.2004.022178
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Baynes RD. Assessment of iron status. Clin Biochem. (1996) 29:209-15. doi: 10.1016/0009-9120(96)00010-K
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Wens JB. Assessing iron status: beyond serum ferritin and transferrin saturation. Clin J Am Soc Nephrol. (2006) 1(1 Suppl):S4-8. doi: 10.2215/CJN.01490506
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Tietz NW, Rinker AD, Morrison SR. When is a serum iron really a serum iron? De status van serum ijzer metingen. Clin Chem. (1994) 40:546-1. doi: 10.1093/clinchem/40.4.546
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Mackie S, Winkelman JW. Normal ferritin in a patient with iron deficiency and RLS. J Clin Sleep Med. (2013) 9:511-3. doi: 10.5664/jcsm.2680
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Leonard AJ, Chalmers KA, Collins CE, Patterson AJ. Comparison of two doses of elemental iron in the treatment of latent iron deficiency: efficacy, side effects and blindering capabilities. Nutriënten. (2014) 6:1394-405. doi: 10.3390/nu6041394
PubMed Abstract | CrossRef Full Text | Google Scholar
35. 35. D’Adamo CR, Novick JS, Feinberg TM, Dawson VJ, Miller LE. A food-derived dietary supplement containing a low dose of iron improved markers of iron status among nonanemic iron-deficient women. J Am Coll Nutr. (2018) 37:342-9. doi: 10.1080/07315724.2018.1427158
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Goodnough LT, Nemeth E, Ganz T. Detection, evaluation, and management of iron-restricted erythropoiesis. Blood. (2010) 116:4754-61. doi: 10.1182/blood-2010-05-286260
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Lee CS, Lee SD, Kang SH, Park HY, Yoon IY. Comparison of the efficacies of oral iron and pramipexole for the treatment of restless legs syndrome patients with low serum ferritin. Eur J Neurol. (2014) 21:260-6. doi: 10.1111/ene.12286
PubMed Abstract | CrossRef Full Text | Google Scholar
38. 38. Tilma J, Tilma K, Norregaard O, Ostergaard JR. Early childhood-onset restless legs syndrome: symptomen en effect van orale ijzerbehandeling. Acta Paediatr. (2013) 102:e221-6. doi: 10.1111/apa.12173
PubMed Abstract | CrossRef Full Text | Google Scholar