O elemento químico cobalto é classificado como um metal de transição. Foi descoberto em 1735 por George Brandt.

Zona de dados
| Classificação: | Cobalto é um metal de transição |
| Cor: | branco-azul |
| Peso atómico: | 58.9332 |
| Estado: | sólido: |
| Ponto de fusão: | 1495 oC, 1768 K |
| Ponto de enchimento: | 2930 oC, 3203 K |
| Electrões: | 27 |
| Protões: | 27 |
| Neutrons no isótopo mais abundante: | 32 |
| Electrões: | 2,8,15,2 |
| Configuração electrónica: | 3d7 4s2 |
| Densidade @ 20oC: | 8.90 g/cm3 |
Mostrar mais: Aquecimento, Energias, Oxidação, Reações,
Compostos, Raios, Condutividades
| Volume atômico: | 6.7 cm3/mol |
| Estrutura: | hcp: fechamento hexagonal pkd |
| Hardness: | 5.0 mohs |
| Capacidade térmica específica | 0.42 J g-1 K-1 |
| Calor de fusão | 16.190 kJ mol-1 |
| Calor de atomização | 426 kJ mol-1 |
| Calor de vaporização | 373.3 kJ mol-1 |
| 1ª energia de ionização | 758.4 kJ mol-1 |
| 2ª energia de ionização | 1646 kJ mol-1 |
| 3ª energia de ionização | 3232.2 kJ mol-1 |
| Afinidade electrónica | 63.8 kJ mol-1 |
| Número mínimo de oxidação | -1 |
| 0 | |
| Número máximo de oxidação | 5 |
| Oxidação comum máx. n.º | 3 |
| Electronegatividade (escala de Pauling) | 1.88 |
| Polaridade volume | 7,5 Å3 |
| Reacção com o ar | Menor, c/ht ? Co3O4 |
| Reacção com 15 M HNO3 | vigoroso, ? Co(NO3)2, NOx |
| Reacção com 6 M HCl | mild, ? H2, CoCl2 |
| Reacção com 6 M NaOH | – |
| Oxide(s) | CoO, Co3O4 |
| Hidreto(s) | Nenhum |
| Cloreto(s) | CoCl2 |
| Atómico raio | 135 pm |
| Raio iônico (1+ íon) | – |
| Raio iônico (2+ íon) | 83.20 pm |
| Raio iônico (3+ íon) | 71.20 pm |
| Raio iônico (1 íon) | – |
| Raio iônico (2 íons) | – |
| Raio iônico (3 ion) | – |
| Condutividade térmica | 100 W m-1 K-1 |
| Condutividade eléctrica | 17.9 x 106 S m-1 |
| Ponto de congelação/congelação: | 1495 oC, 1768 K |
Descoberta do cobalto
Desde a antiguidade, os compostos de cobalto têm sido usados para produzir vidro azul e cerâmica.
O elemento foi isolado pela primeira vez pelo químico sueco George Brandt em 1735. Ele mostrou que foi a presença do elemento cobalto que causou a cor azul no vidro, e não o bismuto, como se pensava anteriormente.
Em cerca de 1741 ele escreveu: “Como existem seis tipos de metais, assim eu também mostrei com experiências confiáveis… que existem também seis tipos de meios metais: um novo meio metal, nomeadamente o cobalto regulador, além do mercúrio, bismuto, zinco e os reguladores do antimónio e arsénico”
A palavra cobalto deriva do alemão ‘kobold’, que significa goblin ou elfo. A imagem do cobalto abaixo é de Ben Mills.


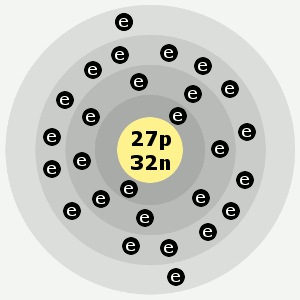
Conchas de electrões do cobalto
Aspecto e Características
Efeitos nocivos:
Cobalto e seus compostos são considerados ligeiramente tóxicos por contacto com a pele e moderadamente tóxicos por ingestão.
Características:
Cobalto é um metal branco-azulado, lustroso, duro e quebradiço. É ferromagnético.
O metal é ativo quimicamente, formando muitos compostos. O cobalto permanece magnético até a mais alta temperatura de todos os elementos magnéticos (tem um ponto de Curie de 1121oC).
Usos de Cobalto
Cobalto é usado em ligas para peças de motores de aeronaves e em ligas com usos resistentes à corrosão/desgaste.
Cobalto é amplamente usado em baterias e em galvanoplastia.
Sais de cobalto são usados para dar cores azul e verde em vidro e cerâmica.
Radioativo 60Co é usado no tratamento de câncer.
Cobalto é essencial para muitos seres vivos e é um componente da vitamina B12.
Cobalto também é usado em ímãs permanentes de samário-cobalto. Estes são usados em captadores de guitarra e motores de alta velocidade.
Abundância e Isótopos
Abundância da crosta terrestre: 25 partes por milhão em peso, 8 partes por milhão em moles
Abundância do sistema solar: 4 partes por milhão por peso, 0,7 partes por milhão por toupeiras
Custo, puro: $21 por 100g
Custo, grosso: $4,40 por 100g
Fonte: O cobalto não é encontrado como um elemento livre na natureza. Ele é encontrado em minérios minerais. Os principais minérios de cobalto são cobaltita (CoAsS), eritrite (arseniato hidratado de cobalto), glaucodot (Co,Fe)AsS, e skutterudite (Co,Ni)As3. O cobalto é geralmente produzido como um subproduto da mineração de níquel e cobre.
Isótopos: O cobalto tem 22 isótopos cujas meias-vidas são conhecidas, com números de massa de 50 a 72. O cobalto natural consiste em um isótopo estável, 59Co.

- Edward Smedley, Hugh James Rose, Henry John Rose, Encyclopaedia Metropolitana; ou Universal Dictionary of Knowledge.., 1845, Volume 4, p693 William Clowes and Sons.
Cite esta Página
Cite esta Página
Para criar um link online, por favor copie e cole um dos seguintes:
<a href="https://www.chemicool.com/elements/cobalt.html">Cobalt</a>
ou
<a href="https://www.chemicool.com/elements/cobalt.html">Cobalt Element Facts</a>
Para citar esta página num documento académico, por favor use a seguinte citação compatível com a MLA:
"Cobalt." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/cobalt.html>.