Michael D. Ober, MD
Christina M. Klais, MD
Emmett T. Cunningham Jr., A EM é uma causa freqüente de perda de visão em pacientes com diabetes mellitus, oclusão venosa retiniana, uveíte e após cirurgia intra-ocular. Ocorre com menor freqüência no ambiente de tração vitreo-retiniana, neovascularização coróide e uma série de outras condições. Muitas estratégias têm sido empregadas para gerenciar a EM com sucesso variável. Este artigo revisa as opções de tratamento disponíveis para esta condição comum.
 |
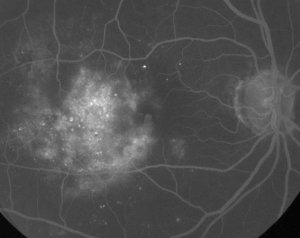 |
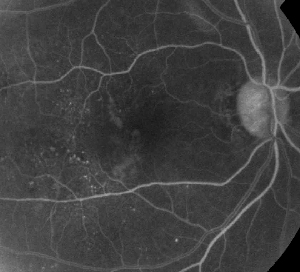
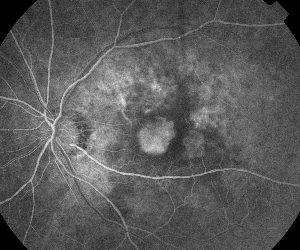
| Figure 1. A. Angiografia fluorescente de fase precoce de um paciente com retinopatia diabética não-proliferativa. Os microaneurismas são vistos mais proeminentemente temporais aos fetos, além do vazamento de fluoresceína na zona avascular foveal. | B. FA em fase tardia do mesmo paciente mostrando fuga difusa temporal para e dentro da zona fetal avascular correspondente ao edema macular diabético. |
Diagnóstico
O diagnóstico clínico de EM é melhor feito usando lentes de contacto e biomicroscopia estereoscópica do fundo da lâmpada. A EM tipicamente se manifesta como uma elevação irregular dentro da retina, muitas vezes adjacente a lipídios intraretinosos, microaneurismas e/ou hemorragias em casos secundários a diabetes melito, oclusão vascular ou isquemia. O líquido intra-retinal também pode se acumular em espaços císticos localizados na retina parafoveal, com ou sem anormalidades vasculares adjacentes. Este edema cistóide macular (EMC) resulta mais comumente de inflamação, tração localizada, ou após cirurgia.
A angiografia de fluoresceína é uma ferramenta essencial no diagnóstico de EM. No olho normal, a fluoresceína é impedida de passar para a retina pelas barreiras hemato-retinianas. Na EM, no entanto, as moléculas fluoresceínicas deixam o espaço intravascular para entrar na retina. Os locais afetados mostram hiperfluorescência nos quadros iniciais a médios que aumenta na área e intensidade nos quadros posteriores (Veja Figura 1). FA não só destaca o edema para fácil visualização e localização do tratamento, mas também cria um registro permanente para futuras comparações. Uma escala quantitativa de quatro graus foi desenvolvida para EM, onde o grau 0 não é hiperfluorescência perifoveal, o grau 1 é hiperfluorescência perifoveal incompleta, o grau 2 é hiperfluorescência leve de 360 graus, o grau 3 é hiperfluorescência moderada de 360 graus, sendo a área hiperfluorescente de aproximadamente 1 disco de diâmetro, e o grau 4 é hiperfluorescência grave de 360 graus, sendo a área hiperfluorescente de aproximadamente 1,5 disco de diâmetro.1,2 Embora FA seja um meio sensível de identificar a presença de EM, ela fornece relativamente pouca informação sobre a distribuição anatômica do fluido; ou seja, difusa vs. cística vs. subretina, e a gravidade do vazamento ao longo do tempo. FA não fornece informações quantitativas relativas ao espessamento da retina. Não é surpreendente, portanto, que este sistema bidimensional de classificação baseado na FA esteja correlacionado de forma deficiente com a visão.3,4
Optical coherence tomography (OCT III, Carl Zeiss) é uma técnica de imagem sem contato, não invasiva, que fornece um coadjuvante útil no diagnóstico da EM. Ela direciona um feixe de luz infravermelha próxima (830 nm) perpendicular à superfície da retina e analisa as propriedades dos reflexos. Em 1,5 segundos, produz uma única imagem linear de alta resolução da secção transversal. Estas imagens podem exibir e até medir a retina cística espessada encontrada em áreas edematosas. Também é útil na visualização das propriedades da interface vitreo-oretina e demonstra efetivamente quando a tração vítrea desempenha um papel na formação do EM (Ver Figura 2).
Um estudo utilizou a TCO para examinar 84 olhos com EM secundários à uveíte, o que proporcionou o benefício adicional de revelar ou confirmar a presença de membranas epiretinais e descolamento seroso da retina em 41% e 20% dos seus casos, respectivamente.5 O estudo encontrou uma correlação moderada entre a espessura da retina e a acuidade visual decrescente, embora o grau de correlação tenha variado entre estudos com outros investigadores relatando correlações fracas,6 moderadas,7 e fortes8,9,10 usando métodos estatísticos variados em diversas populações de pacientes, incluindo pacientes com retinopatia diabética, uveíte e EMC.
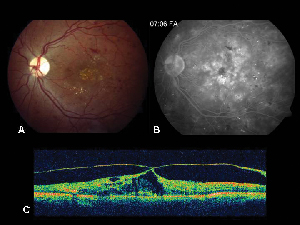
Figure 2. A. Fotografia colorida do fundo do olho esquerdo de um paciente com retinopatia diabética não proliferativa e exsudação lipídica dentro e ao redor da fóvea. B. FA em fase tardia revela edema macular na mácula central. C. A tomografia de coerência óptica demonstra a interface vitreorettal anormal assim como o edema macular.
Outro grupo relatou que a TOC foi tão eficaz quanto a FA na detecção de EM e superior à FA na descrição da distribuição axial do fluido.6 A TOC também tem a capacidade de identificar alguns pacientes com EM não visualizados na FA, como em certos casos de EMC crônica onde o tipo de vazamento ativo melhor visualizado com FA é mínimo ou mesmo ausente, ou quando o exame de fundo é comprometido pela presença de opacidades médias, como em pacientes com hialose de asteróide.11
O analisador de espessura da retina (RTA, Talia Technology, Israel) é uma técnica similar de imagem sem contato que permite a quantificação da espessura da retina. Ele produz 16 varreduras transversais paralelas sobre uma área de retina de 3×3 mm quadrados, analisando reflexos de um pulso de luz verde obliquamente direcionado (540 nm) emitido durante 0,3 segundos. Tanto a OCT como a RTA demonstraram uma excelente precisão nas suas medições individuais da espessura da retina, e uma comparação directa das tecnologias demonstrou uma correlação estatisticamente significativa entre as suas medições. Embora a RTA tenha a vantagem de aquisição rápida com talvez menos artefatos, parece ser menos eficaz na medição da espessura da retina do que a OCT na presença de opacidades médias.12
Outro estudo comparou a espessura da retina com a RTA e a OCT em 30 olhos saudáveis. A espessura média do feto em olhos normais foi medida em 181 µm e 153 µm para RTA e OCT, respectivamente. Os autores concluíram que a ATR ocasionalmente produz falsos valores altos e, portanto, tem confiabilidade reduzida em comparação à TCO.13 Em contraste, uma análise de pacientes com retinopatia diabética não proliferativa leve constatou que a ATR era mais sensível do que a TCO na identificação de áreas de espessamento da retina durante os estágios iniciais do ME diabético.14
 |
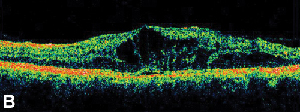 |
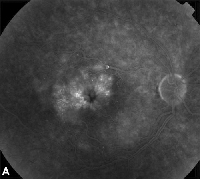
| Figure 3. A. Angiograma fluorescente de fase tardia de um paciente com edema macular de cistoide. | B. Tomografia de coerência óptica mostrando os grandes espaços císticos no fovea. |
Tratamentos -Medicamentos
Medicamentos anti-inflamatórios não-esteróides tópicos são o tratamento mais comum para EM após cirurgia de catarata (Ver Figura 3). Estes agentes são dirigidos à diminuição dos níveis intra-oculares de prostaglandina, que têm sido implicados na patogênese da EM. Estudos duplamente marcados, randomizados, ativos e controlados por placebo, incluindo pacientes submetidos à cirurgia de catarata, relataram efeitos antiinflamatórios de indometacina 1% aplicada topicamente, flurbiprofeno 0,03%, cetorolaco 0,5% e preparações oftálmicas de diclofenaco 0,1%.15,16 Diclofenaco 0,1% e cetorolaco 0,5% soluções oftálmicas, entretanto, são os únicos AINEs aplicados topicamente especificamente aprovados pela Food and Drug Administration para esta indicação. A terapia que combina um corticosteróide tópico e gotas de AINEs tem tido maior eficácia no tratamento de EM do que qualquer outro medicamento isoladamente.16 Embora não aprovados pelo FDA, os AINEs tópicos são frequentemente utilizados antes da cirurgia de catarata para prevenir a EM pós-operatória.
Oral acetazolamida é ocasionalmente usada no tratamento de EM secundária a condições inflamatórias e retinite pigmentosa, particularmente quando os AINE tópicos e corticosteróides falham. Vários estudos prospectivos, mascarados e cruzados comparando a acetazolamida e placebo em pacientes com EM devido a uma variedade de causas. Um estudo cruzado de cinco ciclos em 41 pacientes encontrou uma resposta reprodutível, caracterizada como resolução parcial ou completa de EM, em mais da metade dos pacientes com doença retiniana hereditária ou inflamatória, mas sem resposta daqueles com doenças vasculares retinianas primárias.17 Foi encontrada uma resposta de 500 mg/dia ou acetazolamida oral mais eficaz do que 250 mg/dia no tratamento de EM em pacientes com EM secundária à RP.18 Este estudo observou melhora em 10 dos 12 pacientes tratados.
Outro grupo concluiu que pacientes menores de 55 anos com EM atribuídos à iridociclite crônica eram mais propensos a responder à acetazolamida b.i.d. de 500 mg do que pacientes mais velhos.19 Um estudo recente sugeriu que a acetazolamida também pode ser eficaz no tratamento da EM induzida por diabetes.20
Corticosteróides são potentes agentes antiinflamatórios que são usados com freqüência no tratamento da EM. Eles têm múltiplos mecanismos de ação, incluindo a estabilização da barreira sangue-retiniana e a inibição dos mediadores pró-inflamatórios. Os modos de administração incluem injeção tópica, periocular, injeção intravitreal e administração oral e intravenosa. Embora os corticosteróides orais e intravenosos certamente atinjam níveis terapêuticos dentro do vítreo, eles expõem os pacientes ao risco adicional de complicações sistêmicas e, portanto, são geralmente reservados para pacientes com uveíte que ameaça a visão no cenário da doença sistêmica. As gotas tópicas de corticosteroides estão na outra extremidade do espectro de segurança, mas sua capacidade de alcançar o segmento posterior é limitada.
As injeções do sub-Tenon oferecem uma alternativa para administrar doses relativamente altas de corticosteroides ao olho com menor risco de complicações sistêmicas.21 Embora não tenha havido estudos aleatórios e controlados, a injeção de corticosteroides do sub-Tenon tem sido usada efetivamente no tratamento do edema macular por muitos anos. A técnica mais comum usa uma agulha curta de 25-ga. colocada através da conjuntiva bulbar superotemporal no espaço do sub-Tenon, enquanto o paciente parece inferonasal. A agulha é avançada posteriormente ao longo do globo usando um movimento de varredura lateral para evitar a penetração inadvertida do globo, até que o cubo alcance o local de entrada conjuntival, quando a medicação é entregue. Um relato incluiu 20 pacientes consecutivos com uveíte intermediária associada à perda de visão que foram tratados com a injeção de acetonida de triamcinolona de 40 mg.22 Embora nem todos os pacientes tenham demonstrado EM em FA, 67% melhoraram em duas linhas de visão após um tratamento. Os riscos deste procedimento incluem pressão intra-ocular persistentemente elevada, catarata, ptose e penetração intra-ocular entre outros.
Recentemente, o uso de injeção intravitreal de acetonida de triamcinolona (Kenalog, 4,0 mg) aumentou devido à sua potente capacidade de ameliorar a EM refratária secundária ao diabetes mellitus (ver Figura 4), oclusões venosas retinianas, inflamação e outras causas idiopáticas.23-26 Estudos preliminares mostram redução dramática do espessamento da retina, diminuição do vazamento de fluoresceína e melhora visual, que pode ser marcada em alguns pacientes. Embora o efeito seja temporário e tipicamente dure de três a seis meses ou menos, o EM geralmente responde à reinjeção. O uso de corticosteroides intravitreais está associado a um risco de 30 a 40% de pressão intra-ocular persistentemente elevada e um risco aproximado de 10% de catarata que requer cirurgia, no entanto. O National Eye Institute está atualmente inscrevendo pacientes para o SCORE, o estudo padrão de cuidados versus corticosteroide para oclusão da veia retiniana, que compara injeções intravitreais de triamcinolona (doses de 1 e 4 mg) com cuidados padrão (observação e/ou tratamento a laser de grade) em pacientes com EM secundária à oclusão da veia. O estudo seguirá um total de 1.260 pacientes e continuará o tratamento por 36 meses.
ME também ocorre com a degeneração macular relacionada à idade (ver Figura 5). A injeção intravitreal de acetonida de triamcinolona está atualmente sob investigação para uso combinado com terapia fotodinâmica para o tratamento da DMRI neovascular (Visudyne com acetonida de triamcinolona intravitreal, VisTA). Um estudo enfatiza a importância da triamcinolona intravitreal antes da aplicação de PDT em pacientes com edema macular e CNV.27 Os autores teorizam que a verteporfina pode vazar para espaços císticos intraretinosos levando a lesão fotoreceptoriana da retina normal adjacente, uma vez que a droga é foto-ativada, enquanto que a resolução prévia do edema da retina pode prevenir esta complicação. A pré-administração de corticosteroides também pode servir para embotar qualquer elevação induzida por PDT nos níveis intra-oculares de VEGF.
As próprias injeções intravitreais estão associadas a pequenos, mas definitivos, riscos de efeitos colaterais sérios e potencialmente cegantes, incluindo endoftalmite infecciosa, descolamento da retina, hemorragia, hipertensão ocular, catarata e hipotonia.28 Diretrizes recentemente publicadas para injeções intravitreais tentam estabelecer uma abordagem de melhores práticas para esta técnica cada vez mais utilizada. As recomendações do painel de consenso abordaram considerações pré-injeção, incluindo antibióticos, avaliação de glaucoma, uso de luvas e tratamento de anormalidades pálpebras pré-existentes, bem como a importância de evitar manipulação excessiva da pálpebra antes e durante o procedimento. O regime de peri-injeção recomendado incluiu o uso de anestésico tópico e/ou subconjuntival, iodo povidone tópico e espéculo pálpebral. Os autores enfatizaram a importância da monitorização da PIO e da visualização direta do fundo após a injeção para verificar a perfusão do nervo óptico, a localização intravitreal da triamcinolona e a ausência de hemorragia associada à injeção ou descolamento da retina. Também enfatizaram a importância da educação do paciente em relação aos sintomas precoces de potenciais complicações e acompanhamento minucioso.29
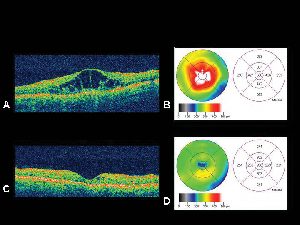
Figure 4. A. Imagem tomográfica de coerência óptica de um olho com edema macular diabético com o correspondente mapa de espessura da retinaB. gerado pelo TOC. C. OCT do mesmo paciente um mês após a injeção intravitreal de triamcinolona acetonídea com o mapa de espessura da retina correspondente. D. Resolução do edema macular. A acuidade visual melhorou de 20/200 para 20/80 após o tratamento.
Estudos transversais estão investigando dispositivos alternativos de entrega de corticosteróides a longo prazo para uso dentro do olho. Um estudo envolve a colocação cirúrgica de uma pastilha de fluocinolona acetonídea embutida em um suporte plástico com liberação controlada de esteróides durante três anos. Conhecido como o implante Envision intravitreal, pela Bausch & Lomb e Control Delivery Systems, é colocado através da pars plana e suturado à esclera. Um estudo randomizado e mascarado da Fase II/III comparou o implante TD Envision em 80 pacientes randomizados a 0.5- vs. 2.0-mg de acetonolona fluocinolona vs. padrão de cuidados que consiste em fotocoagulação ou observação a laser. Após seis meses, uma redução estatisticamente significativa na EM e na gravidade da retinopatia diabética foi observada com o implante de 0,5-mg em comparação com o padrão de cuidados. Além disso, não houve diferenças na incidência de efeitos adversos graves. O braço de 2,0-mg do estudo foi interrompido precocemente devido aos resultados observados em um segundo estudo no qual não foi observada nenhuma vantagem sobre 0,5 mg. Um segundo estudo inscreveu 278 pacientes com uveíte posterior não infecciosa aleatorizados para receberem um implante de 0.59-mg ou 2.1-mg Retisert o olho afetado ou, em casos bilaterais, no olho mais severamente acometido. Após duas doses e 34 semanas, houve uma taxa de recorrência significativamente menor nos olhos com o implante (10 vs. 55,7%, p<0,0001) com uma diminuição no uso de corticosteróides sistêmicos/terapia imunossupressora (59,0% na linha de base vs. 13,7% na 34ª semana), bem como no uso de esteróides sub-Tenon e tópicos. Houve uma melhora significativa na acuidade visual (p<0,05). Os eventos adversos mais comuns incluíram a progressão da catarata e o aumento da pressão intra-ocular que exigiu um procedimento de filtragem em 8,6 por cento. (Jaffe G. Invest Ophthalmol Vis Sci. 2004; 44 ARVO E-Abstract #3369.)
Outro ensaio envolve o Posurdex de Allergan, uma pastilha de dexametasona bioerodável injectada no espaço vítreo que liberta medicamentos durante 50 a 160 dias. Os resultados de um ensaio da Fase II revelaram que tanto uma pelota de 350 µg e 700 µg melhoraram significativamente a percentagem de pacientes com duas linhas ou maior melhoria da visão (27,2 por cento e 35,7 por cento 350 µg e 700 µg, respectivamente) bem como uma melhoria da visão de três linhas ou maior (13 por cento e 19,4 por cento, para 350 µg e 700 µg, respectivamente) a 180 dias em comparação com placebo. Até agora, não houve aumento na incidência de cataratas relatada, embora aumentos da PIO tenham sido observados em cerca de 15% dos pacientes.
Tratamentos -Laser
Mais recentemente, o Macugen da Eyetech e da Pfizer foi estudado em um ensaio randomizado, duplo-mascarado, multicêntrico, dose-ranging, controlado de Fase II de 172 pacientes com EM diabético. O estudo investigou três doses (0,3 mg, 1,0 mg, 3,0 mg) versos de injeções falsas dadas a cada seis semanas para três injeções. Enquanto que aos investigadores prévios de laser focal/grid foram pedidos que inscrevessem apenas pacientes em que se sentissem confortáveis para adiar o laser focal/grid por pelo menos 12 semanas. Injeções adicionais e/ou fotocoagulação focal/grid foram dadas a critério do investigador, a partir da semana 18 a 30. As avaliações finais foram realizadas na semana 36, seis semanas após a última injeção planejada. Em geral, os indivíduos designados para receber Macugen tiveram melhores resultados visuais, tiveram maior probabilidade de mostrar redução na espessura da retina central e foram considerados menos propensos a precisar de terapia laser adicional em comparação com pacientes com farsa.31 Um estudo confirmatório de Fase III está atualmente planejado.
Focal/grid laser photocoagulation permanece o padrão de cuidados para o tratamento de EM diabético. O Estudo de Retinopatia Diabética de Tratamento Precoce mostrou que pacientes tratados com laser de grade tiveram uma redução de 50% na perda visual moderada, definida como uma duplicação do ângulo visual ou uma diminuição da visão em três linhas, quando comparada à observação.30 Embora o mecanismo exato pelo qual o laser diminui a EM seja desconhecido, acredita-se que promova a formação de junções estreitas entre as células RPE, bem como reduza a demanda de oxigênio dos fotorreceptores e aumente a perfusão de oxigênio do coróide.31 O EDTRS identificou pacientes elegíveis para fotocoagulação focal a laser como tendo EM clinicamente significante. Isso foi definido como atendendo a um dos três critérios a seguir: 1) espessamento da retina localizado a 500 µm da fovea; 2) exsudado duro inferior a 500 µm da fovea associada ao espessamento da retina adjacente; ou 3) uma área de edema 1 diâmetro de disco ou maior, sendo que qualquer parte localizada a menos de 1 diâmetro de disco da fovea. O EDTRS não distinguiu, entretanto, entre EM focal, que corresponde ao espessamento local da retina adjacente aos microaneurismas, e EM difusa, que se refere a um espessamento generalizado do pólo posterior. Evidências anedóticas mostram que o EM diabético focal responde bem ao laser focal/grid, enquanto a variedade difusa mais frequentemente falha no tratamento com laser e requer manejo alternativo.
 |
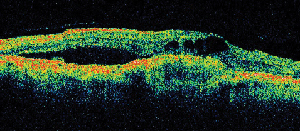 |
| Figure 5. A. Angiograma de fluoresceína precoce mostrando neovascularização subfoveal clássica. | B. A tomografia de coerência óptica correspondente revela áreas de acúmulo de fluido subretinal e intraretal, bem como demonstra a neovascularização (seta). |
Tratamentos – Cirurgia
O primeiro grupo que relatou os benefícios da vitrectomia e separação hialóide posterior em pacientes com EM diabético sugeriu que existe um subgrupo de pacientes em que a tração vítrea e os descolamentos maculares rasos contribuem para o espessamento da retina.32 Isto foi posteriormente confirmado com a TOC, levando ao refinamento das indicações para esta técnica.33,34 As três maiores séries35,36,37 de pacientes submetidos à vitrectomia para EM diabética não responderam aos tratamentos menos invasivos analisados 59, 58 e 65 pacientes, respectivamente. Eles relataram 47%, 53% e 45%, respectivamente, dos seus pacientes melhoraram a visão em duas linhas ou mais. A última destas relatou sérias complicações pós-operatórias desenvolvidas em uma minoria de pacientes incluindo descolamento da retina (1,5%), rubeose iridiana (4,6%), membrana epirretínica (13,8%), hemorragia vítrea recorrente(1,5%), e depósitos de exsudato fetal duro (4,6%), enquanto as complicações revelaram que o segundo grupo incluiu membranas epirretínicas em 10,2% e cataratas em 63,2% dos olhos fáquicos. Várias outras séries de casos mostraram resultados semelhantes, no entanto, todos foram não padronizados, sem controle de placebo, e usando critérios diferentes de inclusão e exclusão. Além disso, as técnicas cirúrgicas também diferiram, deixando as indicações exatas para vitrectomia em pacientes com EMC abertas à interpretação.
ME continua sendo uma das principais causas de perda visual, apesar da variedade de tratamentos disponíveis. A fotocoagulação a laser continua sendo parte integrante do manejo da EM devido a diabetes, isquemia e oclusões vasculares. AINEs e corticosteróides tópicos são atualmente o método primário para controlar a EM pós-operatória, enquanto a acetazolamida continua sendo um meio eficaz de tratamento em pacientes selecionados com EM secundária à uveíte e retinite pigmentosa. O papel dos corticosteróides intravitreais na terapia de EM está em expansão, mas permanece limitado pelos efeitos colaterais e pela duração do efeito. Os refinamentos nas técnicas cirúrgicas continuarão a acrescentar uma nova dimensão à EM sem responder a tratamentos menos invasivos, enquanto os avanços na farmacoterapia e na administração de medicamentos oculares prometem desempenhar um papel na prevenção e no tratamento de todas as causas e tipos de EM.
O Dr. Ober é um fellow em cirurgia vitreo-retiniana no Edward S. Harkness Eye Institute na Faculdade de Médicos e Cirurgiões da Universidade de Columbia, e no LuEsther T. Mertz Retinal Research Center no Manhattan Eye, Ear, and Throat Hospital. Contate-o no 210 East 64th St., 8th Fl, New York, NY 10021; e-mail: [email protected]; ou (212) 605 3777 ou fax (212) 605 3795.
Dr. Klais é bolsista de retina no LuEsther T. Mertz Retinal Research Center. Contacte-a no mesmo endereço, telefone ou fax, ou por e-mail para [email protected].
Dr. Cunningham é professor clínico de oftalmologia e director do Serviço de Uveíte da New York University, School of Medicine. Ele também é funcionário da Eyetech Pharmaceuticals Inc. Contate-o na Vitreous-Retina-Macula Consultants of New York, 460 Park Ave., New York, N.Y. 10022, por e-mail [email protected], ou por telefone/fax em (212) 861 9797.
1. Spaide RF, Yannuzzi LA, Sisco LJ. Edema cistóide macular crônico e preditores de acuidade visual. Ophthalmic Surg 1993;24:262-267.
2. Yannuzzi LA. Uma perspectiva sobre o tratamento do edema macular do cistoide afáfico. Surv Ophthalmol 1984;28:540-553
3. Chang A, Spaide RF, Yannuzzi LA. Edema macular cistóide pós-cirúrgico. In: Guyer DR, Yannuzzi LA, Chang S, et al. Retina, Vitreous, Macula. Saunders. Philadelphia. 1999;1:239-255.
4. Nussenblatt RB, Kaufman SC, Palestine AG, et al. Espessamento macular e acuidade visual. Medição em pacientes com edema macular de cistoide. Oftalmologia 1987;94:1134-9.
5. Markomichelakis NN, Halkiadakis I, Pantelia E, et al. Patterns of macular edema in patients with uveitis: qualitative and quantitative assessment using optical coherence tomography. Oftalmologia 2004;111:946-53.
7. Otani T, Kishi S, Maruyama Y. Patterns of diabetic macular edema with optical coherence tomography. Am J Ophthalmol 1999;127:688-93.
8. Hee MR, Puliafito CA, Wong C, et al. Avaliação quantitativa do edema macular com tomografia de coerência óptica. Arch Ophthalmol 1995;113:1019-29.
9. Nussenblatt RB, Kaufman SC, Palestine AG, et al. Espessamento macular e acuidade visual. Medição em pacientes com edema macular de cistoide. Oftalmologia 1987;94:1134-9.
10. Ozdek SC, Erdinc MA, Gurelik G, et al. Optical coherence tomographic assessment of diabetic macular edema: comparison with fluorescein angiographic and clinical findings. Ophthalmologica 2005;219:86-92.
11. Browning DJ, Fraser CM. Tomografia de coerência óptica para detectar edema macular na presença de hialose de asteróides. Am J Ophthalmol 2004;137:959-961.
12. Polito A, Shah SM, Haller JA et al. Comparação entre o analisador de espessura da retina e a tomografia de coerência óptica para avaliação da espessura de fetos em olhos com doença macular. Am J Ophthalmol 2002;134:240-51.
13. Neubauer AS, Priglinger S, Ullrich S, et al. Comparação da espessura do feto medida com o analisador de espessura da retina e a tomografia de coerência óptica. Retina 2001;21:596-601.
14. Pires I, Bernardes RC, Lobo CL, Soares MA, Cunha-Vaz JG. Espessura da retina em olhos com leve retinopatia não proliferativa em pacientes com diabetes mellitus tipo 2: comparação das medidas obtidas pela análise da espessura da retina e tomografia de coerência óptica. Arch Ophthalmol 2002 Oct;120(10):1301-6.
15. Flach AJ. Inibidores da ciclo-oxigenase em oftalmologia. Surv Ophthalmol 1992;36:259-284.
16. Heier JS, Topping TM, Baumann W, Dirks MS, Chern S. Ketorolac versus prednisolona versus terapia combinada no tratamento do edema macular pseudofáfico agudo do cistoide. Oftalmologia 2000;107:2034-8.
17. Cox SN, Hay E, Bird AC. Tratamento do edema macular crónico com acetazolamida. Arco Ophthalmol 1988;106:1190-5.
18. Fishman GA, Gilbert LD, Fiscella RG, Kimura AE, Jampol LM. Acetazolamida para tratamento de edema macular crônico na retinite pigmentosa. Arco Ophthalmol 1989;107:1445-52.
19. Farber MD, Lam S, Tessler HH, Jennings TJ, Cross A, Rusin MM. Redução do edema macular por acetazolamida em pacientes com iridociclite crônica: um estudo prospectivo randomizado cruzado. Br J Ophthalmol 1994;78:4-7.
20. Giusti C, Forte R, Vingolo EM, Gargiulo P. A acetazolamida é eficaz no tratamento do edema macular diabético? Um estudo piloto. Int Ophthalmol 2001;24:79-88.
21. Jennings T, Rusin MM, Tessler HH, Cunha-Vaz JG. Injeções posteriores do sub-Tenon de corticosteroides em pacientes com uveíte com edema macular cistóide. Jpn J Ophthalmol 1988;32:385-91.
22. Leme CJ, Holland GN. Os efeitos da injeção posterior de acetonido de triamcinolona subtenoidal em pacientes com uveíte intermediária. Am J Ophthalmol 1995;120:55-64.
23. Benhamou N, Massin P, Haouchine B, Audren F, et al. Intravitreal triamcinolone para edema macular pseudofáfico refratário. Am J Ophthalmol 2003;135:246-9.
24. Jonas JB, Kreissig I, Degenring RF. Acetonida triamcinolona intra-vitreal como tratamento do edema macular na oclusão da veia retiniana central. Graefes Arch Clin Exp Ophthalmol. 2002;240:782-3.
25. 25. Martidis A, Duker JS, Greenberg PB, Rogers AH, et al. Intravitreal triamcinolone for refractory diabetic macular edema. Ophthalmology 2002; 109: 920-7.
26. 26. Scott IU, Flynn HW Jr., Rosenfeld PJ. Intravitreal triamcinolone acetonide for idiopathic cystoid macular edema. Am J Ophthalmol 2003;136:737-9.
27. 27. Freund KB, Klais CM, Eandi CM, et al. Sequence Combined Intravitreal Triamcinolone and Indocyanine Green Angiography Guided Photodynamic Therapy for Retinal Angiomatous Proliferation. Arco Oftalmol, In Press.
28. 28. Jager RD, Aiello LP, Patel SC, Cunningham ET Jr. Risks of intravitreal injection: a comprehensive review. Retina. 2004 Oct;24(5):676-98.
29. 29. Aiello LP, Brucker AJ, Chang S, et al. Evolving guidelines for intravitreal injections. Retina 2004 Out;24(5 Suppl):S3-19.
30. G.Jaffe, Fluocinolone Acetonide Uveitis Study Group. Implante Intravitreal de Acetonolona para Uveíte Afetando o Segmento Posterior do Olho. ARVO 2004, poster #3369.
31. O Grupo de Estudo da Retinopatia Diabética Macugen. Um estudo randomizado fase II de pegaptanibe, um fator de crescimento endotelial anti-vascular aptamer, para edema macular diabético. Oftalmologia, In press.
32. 30. Fotocoagulação para edema macular diabético. Tratamento precoce Estudo de Retinopatia Diabética relatório número 1. Arch Ophthalmol 1985;103:1796-806.
33. Christoforidis JB, D’Amico DJ. Tratamento cirúrgico e outros tratamentos de edema macular diabético: uma atualização. Int Ophthalmol Clin 2004;44:139-60.
34. Lewis H, Abrams GW, Blumenkranz MS, Campo RV. Vitrectomia para tracção macular diabética e edema associado à tracção hialóide posterior. Oftalmologia 1992;99:753-9.
35. Kaiser PK, Riemann CD, Sears JE, Lewis H. Desprendimento da tração macular e edema macular diabético associado à tração hialoidal posterior. Am J Ophthalmol 2001;131:44-9.
36. Lewis H. O papel da vitrectomia no tratamento do edema macular diabético. Am J Ophthalmol 2001;131:123-5.
37. Pendergast SD. Vitrectomia para o edema macular diabético associado a um hialóide premacular posterior esticado. Curr Opinião Ophthalmol 1998;9:71-5.
38. Tachi N, Ogino N. Vitrectomia para edema macular difuso em casos de retinopatia diabética. Am J Ophthalmol 1996;122:258-60.
39. Yamamoto T, Hitani K, Tsukahara I, Yamamoto S, et al. Alterações e complicações pós-operatórias precoces da espessura da retina após vitrectomia para edema macular diabético. Am J Ophthalmol 2003;135:14-9.