Substanțe pure și amestecuri
Substanța chimică pură este orice materie care are o compoziție chimică fixă și proprietăți caracteristice. Oxigenul, de exemplu, este o substanță chimică pură care este un gaz incolor și inodor la 25°C. Foarte puține mostre de materie constau din substanțe pure; în schimb, majoritatea sunt amestecuri, care sunt combinații de două sau mai multe substanțe pure în proporții variabile, în care substanțele individuale își păstrează identitatea. Aerul, apa de la robinet, laptele, brânza albastră, pâinea și murdăria sunt toate amestecuri. În cazul în care toate porțiunile unui material se află în aceeași stare, nu au limite vizibile și sunt uniforme în întregime, atunci materialul este omogen. Exemple de amestecuri omogene sunt aerul pe care îl respirăm și apa de la robinet pe care o bem. Amestecurile omogene se mai numesc și soluții. Astfel, aerul este o soluție de azot, oxigen, vapori de apă, dioxid de carbon și alte câteva gaze; apa de la robinet este o soluție de cantități mici de mai multe substanțe în apă. Compozițiile specifice ale acestor două soluții nu sunt însă fixe, ci depind atât de sursă, cât și de locație; de exemplu, compoziția apei de la robinet din Boise, Idaho, nu este aceeași cu cea a apei de la robinet din Buffalo, New York. Deși majoritatea soluțiilor pe care le întâlnim sunt lichide, soluțiile pot fi și solide. Substanța cenușie folosită încă de unii dentiști pentru a umple cariile dentare este o soluție solidă complexă care conține 50% mercur și 50% dintr-o pulbere care conține în principal argint, staniu și cupru, cu cantități mici de zinc și mercur. Soluțiile solide din două sau mai multe metale se numesc în mod obișnuit aliaje.
Dacă compoziția unui material nu este complet uniformă, atunci acesta este eterogen (de exemplu, aluatul de biscuiți cu fulgi de ciocolată, brânza albastră și pământul). Amestecurile care par a fi omogene se constată adesea că sunt eterogene după o examinare microscopică. Laptele, de exemplu, pare a fi omogen, dar, atunci când este examinat la microscop, este format în mod clar din globule mici de grăsime și proteine dispersate în apă. Componentele amestecurilor eterogene pot fi, de obicei, separate prin mijloace simple. Amestecurile solid-lichid, cum ar fi nisipul în apă sau frunzele de ceai în ceai, sunt ușor de separat prin filtrare, care constă în trecerea amestecului printr-o barieră, cum ar fi o strecurătoare, cu găuri sau pori care sunt mai mici decât particulele solide. În principiu, amestecurile de două sau mai multe substanțe solide, cum ar fi zahărul și sarea, pot fi separate prin inspecție microscopică și sortare. Cu toate acestea, sunt necesare, de obicei, operațiuni mai complexe, cum ar fi, de exemplu, separarea pepitelor de aur din pietrișul de râu prin spălare. Mai întâi, materialul solid este filtrat din apa râului; apoi solidele sunt separate prin inspecție. Dacă aurul este înglobat în rocă, este posibil să trebuiască să fie izolat prin metode chimice.
-and-Milk-(left).jpg?revision=1)
Figura 1.2.2.2: Un amestec eterogen. La microscop, laptele integral este de fapt un amestec eterogen compus din globule de grăsime și proteine dispersate în apă. Figura utilizată cu permisiunea Wikipedia
Mestecurile (soluțiile) eterogene pot fi separate în substanțele componente prin procese fizice care se bazează pe diferențele dintre anumite proprietăți fizice, cum ar fi diferențele dintre punctele lor de fierbere. Două dintre aceste metode de separare sunt distilarea și cristalizarea. Distilarea se folosește de diferențele de volatilitate, o măsură a ușurinței cu care o substanță se transformă în gaz la o anumită temperatură. Un aparat simplu de distilare pentru separarea unui amestec de substanțe, dintre care cel puțin una este un lichid. Componenta cea mai volatilă fierbe prima și se condensează la lichid în condensatorul răcit cu apă, de unde se scurge în balonul receptor. Dacă se distilează, de exemplu, o soluție de sare și apă, componenta cea mai volatilă, apa pură, se colectează în balonul de recepție, în timp ce sarea rămâne în balonul de distilare.

Figura 1.2.3: Distilarea unei soluții de sare de masă în apă. Soluția de sare în apă se încălzește în balonul de distilare până la fierbere. Vaporii rezultați se îmbogățesc în componenta mai volatilă (apa), care se condensează în lichid în condensatorul rece și este apoi colectată în balonul receptor.
Mixturile a două sau mai multe lichide cu puncte de fierbere diferite pot fi separate cu un aparat de distilare mai complex. Un exemplu este rafinarea petrolului brut într-o gamă de produse utile: combustibil pentru aviație, benzină, kerosen, motorină și ulei lubrifiant (în ordinea aproximativă a volatilității descrescătoare). Un alt exemplu este distilarea băuturilor alcoolice, cum ar fi brandy sau whisky. Această procedură relativ simplă a provocat nu puține bătăi de cap autorităților federale în anii 1920, în timpul prohibiției, când alambicurile ilegale au proliferat în regiuni îndepărtate ale Statelor Unite.
Cristalizarea separă amestecurile pe baza diferențelor de solubilitate, o măsură a cantității de substanță solidă care rămâne dizolvată într-o anumită cantitate de lichid specificat. Majoritatea substanțelor sunt mai solubile la temperaturi mai ridicate, astfel încât un amestec de două sau mai multe substanțe poate fi dizolvat la o temperatură ridicată și apoi lăsat să se răcească încet. Alternativ, lichidul, numit solvent, poate fi lăsat să se evapore. În ambele cazuri, cea mai puțin solubilă dintre substanțele dizolvate, cea care are cele mai puține șanse de a rămâne în soluție, formează de obicei mai întâi cristale, iar aceste cristale pot fi îndepărtate din soluția rămasă prin filtrare.

Figura 1.2.4: Cristalizarea acetatului de sodiu dintr-o soluție concentrată de acetat de sodiu în apă. Adăugarea unui mic cristal „sămânță” (a) determină compusul să formeze cristale albe, care cresc și, în cele din urmă, ocupă cea mai mare parte a balonului. Videoclipul poate fi găsit aici: https://www.youtube.com/watch?v=BLq5NibwV5g
Majoritatea amestecurilor pot fi separate în substanțe pure, care pot fi fie elemente, fie compuși. Un element, cum ar fi sodiul gri, metalic, este o substanță care nu poate fi descompusă în altele mai simple prin modificări chimice; un compus, cum ar fi clorura de sodiu albă, cristalină, conține două sau mai multe elemente și are proprietăți chimice și fizice care sunt, de obicei, diferite de cele ale elementelor din care este compus. Cu doar câteva excepții, un anumit compus are aceeași compoziție elementară (aceleași elemente în aceleași proporții), indiferent de sursa sau istoria sa. Compoziția chimică a unei substanțe este modificată în cadrul unui proces numit modificare chimică. Transformarea a două sau mai multe elemente, cum ar fi sodiul și clorul, într-un compus chimic, clorura de sodiu, este un exemplu de modificare chimică, adesea numită reacție chimică. În prezent, se cunosc aproximativ 115 elemente, dar milioane de compuși chimici au fost preparați din aceste 115 elemente. Elementele cunoscute sunt enumerate în tabelul periodic.
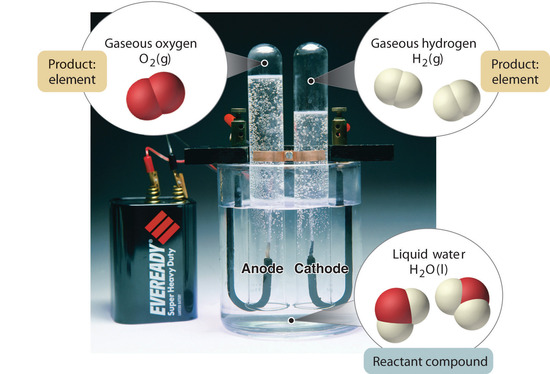
Figura 1.2.5: Descompunerea apei în hidrogen și oxigen prin electroliză. Apa este un compus chimic; hidrogenul și oxigenul sunt elemente.
În general, un proces chimic invers descompune compușii în elementele lor. De exemplu, apa (un compus) poate fi descompusă în hidrogen și oxigen (ambele elemente) printr-un proces numit electroliză. În electroliză, electricitatea furnizează energia necesară pentru a separa un compus în elementele sale constitutive (figura 1.2.5). O tehnică similară este utilizată pe scară largă pentru a obține aluminiu pur, un element, din minereurile sale, care sunt amestecuri de compuși. Deoarece este necesară o cantitate mare de energie pentru electroliză, costul energiei electrice este de departe cea mai mare cheltuială efectuată pentru fabricarea aluminiului pur. Astfel, reciclarea aluminiului este atât rentabilă, cât și ecologică. Organizarea generală a materiei și metodele utilizate pentru separarea amestecurilor sunt rezumate în figura 1.2.6.
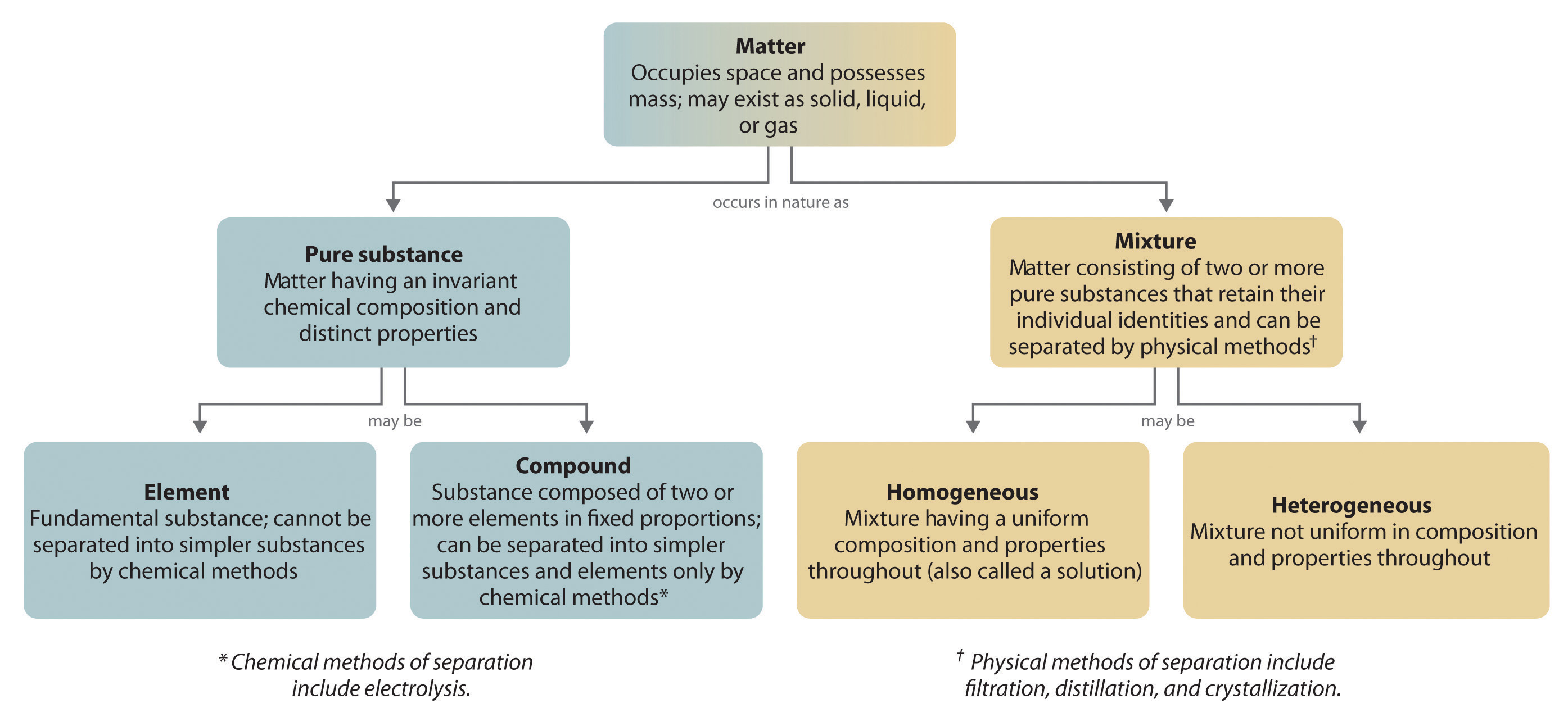
Figura 1.2.6: Relațiile dintre tipurile de materie și metodele utilizate pentru separarea amestecurilor
Exemplu 1.2.1
Identificați fiecare substanță ca fiind un compus, un element, un amestec eterogen sau un amestec omogen (soluție).
- ceai filtrat
- sucul de portocale proaspăt stors
- un compact disc
- oxid de aluminiu, o pulbere albă care conține un 2:raport de 3 între atomii de aluminiu și oxigen
- seleniu
Dat: o substanță chimică
Întrebat: clasificarea acesteia
Strategie:
- Decide dacă o substanță este pură din punct de vedere chimic. Dacă este pură, substanța este fie un element, fie un compus. Dacă o substanță poate fi separată în elementele sale, ea este un compus.
- Dacă o substanță nu este pură din punct de vedere chimic, este fie un amestec eterogen, fie un amestec omogen. Dacă compoziția sa este uniformă peste tot, este un amestec omogen.
Soluție:
- Un ceai este o soluție de compuși în apă, deci nu este chimic pur. De obicei, este separat de frunzele de ceai prin filtrare. B Deoarece compoziția soluției este uniformă pe tot parcursul ei, este un amestec omogen.
- A Sucul de portocale conține particule de solide (pulpă), precum și lichid; nu este chimic pur. B Deoarece compoziția sa nu este uniformă peste tot, sucul de portocale este un amestec eterogen.
- A Un compact disc este un material solid care conține mai mult de un element, cu regiuni de compoziții diferite vizibile de-a lungul marginii sale. Prin urmare, un compact disc nu este pur din punct de vedere chimic. B Regiunile de compoziții diferite indică faptul că un compact disc este un amestec eterogen.
- A Oxidul de aluminiu este un compus unic, chimic pur.
- A Seleniul este unul dintre elementele cunoscute.
Exercițiu 1.2.1
Identificați fiecare substanță ca fiind un compus, un element, un amestec eterogen sau un amestec omogen (soluție).
- vin alb
- mercur
- pansament de salată în stil rustic
- dulceață de masă (zaharoză)
Răspuns:
- soluție
- element
- amestec eterogen
- compus
Rezumat
Materia poate fi clasificată în funcție de proprietățile fizice și chimice. Materia este orice lucru care ocupă spațiu și are masă. Cele trei stări ale materiei sunt: solid, lichid și gaz. O schimbare fizică implică transformarea unei substanțe dintr-o stare a materiei în alta, fără a-i schimba compoziția chimică. Cea mai mare parte a materiei este formată din amestecuri de substanțe pure, care pot fi omogene (cu o compoziție uniformă) sau eterogene (diferite regiuni posedă compoziții și proprietăți diferite). Substanțele pure pot fi fie compuși chimici, fie elemente. Compușii pot fi descompuse în elemente prin reacții chimice, dar elementele nu pot fi separate în substanțe mai simple prin mijloace chimice. Proprietățile substanțelor pot fi clasificate fie ca fiind fizice, fie chimice. Oamenii de știință pot observa proprietățile fizice fără a modifica compoziția substanței, în timp ce proprietățile chimice descriu tendința unei substanțe de a suferi modificări chimice (reacții chimice) care îi modifică compoziția chimică. Proprietățile fizice pot fi intensive sau extensive. Proprietățile intensive sunt aceleași pentru toate probele; nu depind de mărimea probei; și includ, de exemplu, culoarea, starea fizică și punctele de topire și de fierbere. Proprietățile extinse depind de cantitatea de material și includ masa și volumul. Raportul dintre două proprietăți extensive, masa și volumul, este o proprietate intensivă importantă numită densitate.
Contribuitori
Modificat de Joshua Halpern (Howard University)
.