Dacă ați luat vreodată un medicament pe bază de rețetă, ați condus o mașină sau ați băut apă de la robinet, probabil că ați fost expus la clor.
Clorul, elementul nr. 17 din tabelul periodic al elementelor, are multiple aplicații. Este folosit pentru a steriliza apa potabilă și pentru a dezinfecta piscinele și este utilizat în fabricarea unui număr de produse de uz comun, cum ar fi hârtia, textilele, medicamentele, vopselele și plasticul, în special PVC-ul, potrivit Societății Regale de Chimie. În plus, clorul este utilizat în dezvoltarea și fabricarea materialelor folosite în produsele care fac vehiculele mai ușoare, de la pernele și husele scaunelor până la cordoanele pentru anvelope și bare de protecție, potrivit Consiliului American de Chimie.
Elementul este, de asemenea, utilizat în procesele de chimie organică – de exemplu, ca agent oxidant și ca înlocuitor al hidrogenului, potrivit Laboratorului Național Los Alamos. Un agent oxidant are calități puternice de dezinfectare și albire. Atunci când este folosit ca substitut al hidrogenului, clorul poate aduce multe proprietăți dorite în compușii organici, cum ar fi proprietățile sale dezinfectante sau capacitatea sa de a forma compuși și materiale utile, cum ar fi PVC și cauciucul sintetic.
Dar clorul are și o parte întunecată: în forma sa de gaz natural, este dăunător pentru sănătatea umană. Clorul este un iritant respirator, iar inhalarea lui poate provoca edem pulmonar – o acumulare excesivă de lichid în plămâni care poate duce la dificultăți de respirație. De asemenea, gazul poate provoca iritații ale ochilor și ale pielii sau chiar arsuri și ulcerații grave, potrivit Departamentului de Sănătate al statului New York. Expunerea la clor lichid comprimat poate duce la degerături ale pielii și ochilor, raportează agenția.
Citește doar faptele
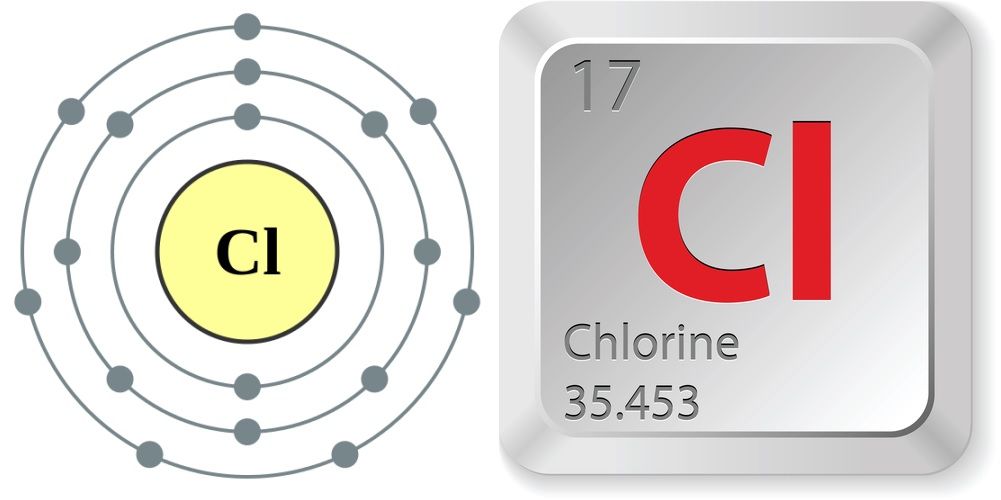
- Numărul atomic (numărul de protoni din nucleu): 17
- Simbolul atomic (în tabelul periodic al elementelor):
- : Cl
- Greutate atomică (masa medie a atomului): 35,453
- Densitate: Cl
- : 3,214 grame pe centimetru cub
- Fază la temperatura camerei: Gaz
- Punct de topire: minus 150,7 grade Fahrenheit (minus 101,5 grade C)
- Punct de fierbere: minus 29,27 F (minus 34,04 C)
- Numărul de izotopi (atomi ai aceluiași element cu un număr diferit de neutroni): 24. Numărul de izotopi stabili: 2
- Cei mai comuni izotopi: Clorul-35 (abundență naturală de 76%)
Gaz galben-verzui confundat cu oxigenul
În 1774, farmacistul suedez Carl Wilhelm Scheele a eliberat câteva picături de acid clorhidric pe o bucată de dioxid de mangan în laboratorul său, iar un gaz galben-verzui a fost produs în câteva secunde, potrivit American Chemistry Council. Cu toate acestea, clorul nu a fost recunoscut ca element decât câteva decenii mai târziu, de către chimistul englez Sir Humphry Davy, iar înainte de aceasta, oamenii credeau că este un compus al oxigenului. Davy l-a numit „khloros”, de la cuvântul grecesc pentru galben-verzui, iar în 1810, a actualizat numele în „gaz cloric” sau „clor”.”
Clorul face parte din grupul halogenilor – elemente care formează săruri – alături de fluor (F), brom (Br), iod (I) și astatină (At). Toate acestea se află în a doua coloană din dreapta pe tabelul periodic, în grupa 17. Configurațiile lor electronice sunt similare, cu șapte electroni în învelișul exterior. Sunt elemente foarte reactive; atunci când se leagă de hidrogen, produc acizi. Nici unul nu se găsește în natură în forma lor elementară, potrivit Universității Purdue. Se găsesc de obicei sub formă de săruri în minerale.
De fapt, probabil cea mai cunoscută formă a unui compus al clorului este clorura de sodiu, cunoscută și sub numele de sare de masă. Alți compuși includ clorura de potasiu, care este folosită pentru a preveni sau a trata nivelurile scăzute de potasiu din sânge, și clorura de magneziu, care este folosită pentru a preveni sau a trata deficitul de magneziu.
Cel mai mult clor este obținut prin electroliza soluțiilor de clorură de sodiu – folosind un curent electric pentru a crea o reacție chimică, potrivit Universității din York. Procesul separă elementele.
Cine știa?
- Datorită proprietăților sale toxice, clorul a fost folosit ca armă chimică în timpul Primului Război Mondial, potrivit Societății Regale de Chimie.
- Când este izolat ca element liber, clorul ia forma unui gaz galben-verzui, care este de 2,5 ori mai greu decât aerul și miroase a înălbitor.
- Clorul este al doilea cel mai abundent halogen și al doilea cel mai ușor halogen de pe Pământ, după fluor.
- Clorura de sodiu (sarea) este cel mai comun compus al clorului și se găsește în cantități mari în ocean.
- Este posibil să existe clor în puiul pe care îl mâncați. Carcasele de pui care provin din fermele industriale din SUA sunt adesea îmbibate în clor pentru a scăpa de contaminarea fecală.
- Clorul distruge ozonul, contribuind la procesul de epuizare a ozonului. De fapt, un atom de clor poate distruge până la 100.000 de molecule de ozon înainte de a fi eliminat din stratosferă, potrivit Agenției de Protecție a Mediului din SUA.
- Piscinele de înot se bazează pe clor pentru a le menține curate. Potrivit Consiliului American de Chimie, apa din majoritatea piscinelor ar trebui să conțină între două și patru părți pe milion de clor. Iar acel clor puternic pe care îl puteți mirosi atunci când înotați la o piscină publică poate fi, de fapt, un indicator că este nevoie de clor suplimentar pentru a echilibra substanțele chimice din apă.
Rezultatele cercetării
Clorul a stârnit multă agitație în rândul cercetătorilor de-a lungul anilor din cauza anumitor efecte nocive pe care le poate avea asupra sănătății umane. Aceste efecte, însă, rămân discutabile.
Clorul este unul dintre atomii dintr-o toxină pe care unele broaște sud-americane o au în piele. Aceasta poate paraliza sau chiar ucide animale mari, potrivit Consiliului American de Chimie. Băștinașii din pădurea tropicală columbiană obișnuiau să își frece vârful săgeților pe pielea acestor „broaște cu săgeți otrăvite”. John Daly, un om de știință de la National Institutes of Health a încercat să izoleze compusul, numit epibatidină, dar nu a reușit să obțină o cantitate suficientă de substanță (broaștele sunt pe cale de dispariție), iar ceea ce a sintetizat a avut efecte secundare nedorite. Cu toate acestea, prin rearanjarea compusului la nivel atomic, chimiștii speră că vor putea găsi în cele din urmă o versiune care să fie un analgezic puternic.
Cercetarea anterioară a legat consumul de apă clorurată de un risc crescut de cancer. De exemplu, într-un studiu publicat în 1992 în American Journal of Public Health, cercetătorii au descoperit că persoanele care au băut apă clorurată au avut un risc cu 21% mai mare de a se îmbolnăvi de cancer de vezică urinară și un risc cu 38% mai mare de a se îmbolnăvi de cancer rectal, decât persoanele care au băut apă neclorurată. Și, într-un alt studiu, publicat în 2010 în revista Environmental Health Perspectives, cercetătorii au descoperit că persoanele care au înotat într-o piscină cu clor timp de 40 de minute au avut o creștere a biomarkerilor (adică anumiți indicatori moleculari) legați de riscul de cancer. Cu toate acestea, un studiu din 2017, publicat în aceeași revistă, a constatat că, deși există un risc mai mare de cancer de vezică urinară atunci când se bea apă clorată, nu a existat nicio dovadă sau aproape nicio dovadă care să facă legătura între înotul într-o piscină cu clor și riscul de cancer de vezică urinară într-un studiu care a analizat numărul de ore petrecute în piscină în timpul lunilor de vară și în afara lunilor de vară și în diferite intervale de vârstă.
Departamentul de Sănătate și Servicii Umane al SUA, Agenția Internațională de Cercetare a Cancerului și Agenția de Protecție a Mediului din SUA nu au clasificat clorul ca fiind un carcinogen uman, potrivit Centrelor pentru Controlul și Prevenirea Bolilor.
Atunci, este clorul rău pentru sănătate? Nu chiar, a declarat Preston J. MacDougall, profesor de chimie la Middle Tennessee State University din Murfreesboro.
„Nu doriți să folosiți cantități excesive de clor, dar nu ar trebui să ne temem de substanțele chimice pentru că nu le înțelegem”, a declarat MacDougall pentru Live Science.
De fapt, lipsa unei clorinări adecvate pentru a distruge bacteriile dăunătoare, cum ar fi E. coli, poate avea consecințe devastatoare asupra sănătății și vieții umane, a adăugat el. De exemplu, în mai 2000, în Walkerton, Ontario, șapte persoane au murit și peste 2.300 s-au îmbolnăvit după ce alimentarea cu apă a orașului a fost infectată cu E. coli și alte bacterii, potrivit Consiliului pentru calitatea apei și sănătate. Dacă nivelurile de clor necesare ar fi fost menținute, dezastrul ar fi putut fi prevenit, chiar și după ce apa a fost contaminată, potrivit unui raport publicat de Ministerul Procurorului General din Ontario.
În plus, adăugarea de clor în apă este una dintre metodele prin care mulți încearcă să facă apa curată ușor accesibilă în țările în curs de dezvoltare. Un studiu publicat în 2017 afirmă că 3,4 milioane de oameni mor în fiecare an din cauza apei contaminate cu bacterii dăunătoare, cum ar fi E. coli, și că până la 4,4 miliarde de oameni nu au o sursă sigură de apă potabilă curată. Clorurarea rezervei de apă, pe lângă aducerea apei mai aproape de comunități, este un pas important pentru a aduce apa curată mai aproape de cei care au nevoie de ea.
În plus, există câteva știri promițătoare legate de cercetare cu privire la clor. MacDougall a subliniat un studiu recent privind atomii de clor găsiți într-o nouă clasă de compuși antibiotici care au fost descoperiți în mici organisme marine din apele Atlanticului de Nord, în apropiere de Norvegia. Acei atomi de clor sunt esențiali pentru activitatea antibiotică a compușilor, care pot fi eficienți împotriva Staphylococcus aureus rezistent la meticilină, o bacterie care provoacă infecții greu de tratat la oameni și care este rezistentă la antibioticele utilizate în mod obișnuit, a spus el.
„Comunitatea de descoperire a medicamentelor este foarte entuziasmată de acești compuși naturali, deoarece sunt eficienți împotriva MRSA”, a declarat MacDougall, care nu a fost implicat în cercetare, publicată în aprilie 2014 în revista Angewandte Chemie International Edition.
Reportaj suplimentar realizat de Rachel Ross, colaborator al Live Science.
Resurse suplimentare
- Pentru a vedea cât de reactiv este clorul atunci când interacționează cu alți compuși, urmăriți acest videoclip distractiv realizat de Periodic Videos.
- Învățați despre numeroasele aplicații surprinzătoare ale clorului pe acest site web numit Elements of Surprise (Elemente de surpriză) care este dedicat acestui element versatil.
- Dacă doriți să aflați mai multe despre modul în care expunerea la clor vă poate afecta sănătatea, consultați secțiunea Întrebări frecvente despre clor de pe site-ul web al CDC.
Știri recente
.