Se hai mai preso una medicina prescritta, guidato una macchina o bevuto acqua di rubinetto, probabilmente sei stato esposto al cloro.
Il cloro, elemento n. 17 della tavola periodica degli elementi, ha molteplici applicazioni. È usato per sterilizzare l’acqua potabile e per disinfettare le piscine, ed è usato nella fabbricazione di una serie di prodotti di uso comune, come carta, tessuti, medicine, vernici e plastica, in particolare PVC, secondo la Royal Society of Chemistry. Inoltre, il cloro è usato nello sviluppo e nella fabbricazione di materiali utilizzati in prodotti che rendono i veicoli più leggeri, dai cuscini e dalle coperture dei sedili alle corde dei pneumatici e ai paraurti, secondo l’American Chemistry Council.
L’elemento è anche usato nei processi di chimica organica – per esempio, come agente ossidante e sostituto dell’idrogeno, secondo il Los Alamos National Laboratory. Un agente ossidante ha forti qualità disinfettanti e sbiancanti. Quando viene usato come sostituto dell’idrogeno, il cloro può portare molte proprietà desiderate nei composti organici, come le sue proprietà disinfettanti o la sua capacità di formare composti e materiali utili come il PVC e la gomma sintetica.
Ma il cloro ha anche un lato oscuro: nella sua forma di gas naturale, è dannoso per la salute umana. Il cloro è un irritante respiratorio, e inalarlo può causare un edema polmonare – un eccessivo accumulo di liquido nei polmoni che può portare a difficoltà respiratorie. Il gas può anche causare irritazione agli occhi e alla pelle, o anche gravi ustioni e ulcerazioni, secondo il New York State Department of Health. L’esposizione al cloro liquido compresso può provocare il congelamento della pelle e degli occhi, riferisce l’agenzia.
Solo i fatti
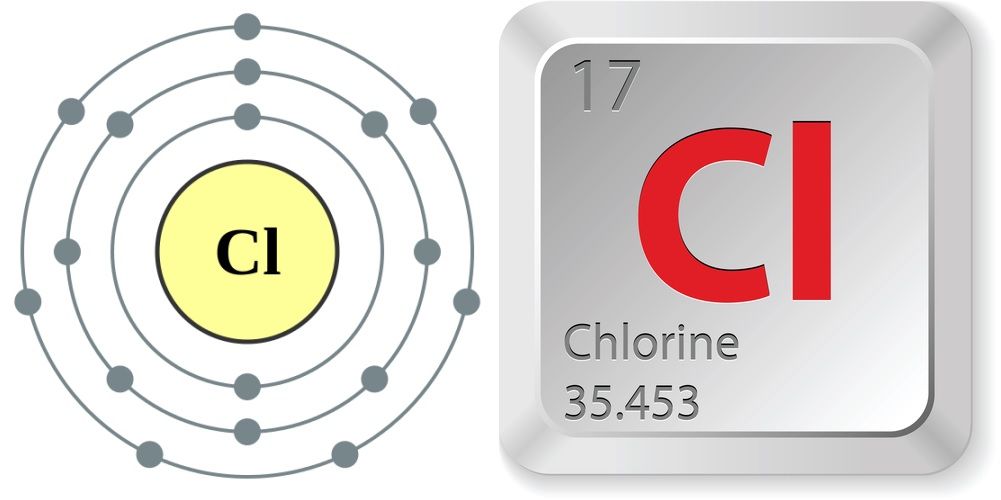
- Numero atomico (numero di protoni nel nucleo): 17
- Simbolo atomico (sulla tavola periodica degli elementi): Cl
- Peso atomico (massa media dell’atomo): 35,453
- Densità: 3,214 grammi per centimetro cubo
- Fase a temperatura ambiente: Gas
- Punto di fusione: meno 150,7 gradi Fahrenheit (meno 101,5 gradi C)
- Punto di ebollizione: meno 29,27 F (meno 34,04 C)
- Numero di isotopi (atomi dello stesso elemento con un diverso numero di neutroni): 24. Numero di isotopi stabili: 2
- Isotopi più comuni: Cloro-35 (76 per cento di abbondanza naturale)
Gas giallo-verdastro scambiato per ossigeno
Nel 1774, il farmacista svedese Carl Wilhelm Scheele rilasciò alcune gocce di acido cloridrico su un pezzo di biossido di manganese nel suo laboratorio, e un gas giallo-verdastro fu prodotto in pochi secondi, secondo l’American Chemistry Council. Tuttavia, il cloro non fu riconosciuto come elemento fino a diversi decenni dopo, dal chimico inglese Sir Humphry Davy, e prima di allora, la gente pensava che fosse un composto dell’ossigeno. Davy lo chiamò “khloros”, dalla parola greca per giallo-verde, e nel 1810, aggiornò il nome in “gas clorico” o “cloro”.
Il cloro appartiene al gruppo degli alogeni – elementi che formano sale – insieme a fluoro (F), bromo (Br), iodio (I) e astato (At). Sono tutti nella seconda colonna da destra sulla tavola periodica nel gruppo 17. Le loro configurazioni elettroniche sono simili, con sette elettroni nel loro guscio esterno. Sono elementi altamente reattivi; quando si legano con l’idrogeno, producono acidi. Nessuno si trova in natura nella sua forma elementare, secondo la Purdue University. Si trovano tipicamente come sali nei minerali.
In effetti, probabilmente la forma più conosciuta di un composto del cloro è il cloruro di sodio, altrimenti noto come sale da cucina. Altri composti includono il cloruro di potassio, che è usato per prevenire o trattare bassi livelli di potassio nel sangue, e il cloruro di magnesio, che è usato per prevenire o trattare la carenza di magnesio.
La maggior parte del cloro è fatto tramite elettrolisi di soluzioni di cloruro di sodio – usando una corrente elettrica per creare una reazione chimica, secondo l’Università di York. Il processo separa gli elementi.
Chi lo sapeva?
- A causa delle sue proprietà tossiche, il cloro è stato usato come arma chimica durante la prima guerra mondiale, secondo la Royal Society of Chemistry.
- Quando viene isolato come elemento libero, il cloro si presenta sotto forma di un gas giallo-verde, che è 2,5 volte più pesante dell’aria e odora di candeggina.
- Il cloro è il secondo alogeno più abbondante e il secondo alogeno più leggero sulla Terra, dopo il fluoro.
- Il cloruro di sodio (sale) è il composto più comune del cloro e si trova in grandi quantità nell’oceano.
- Può esserci del cloro nel pollo che mangi. Le carcasse di pollo che provengono dagli allevamenti statunitensi sono spesso inzuppate di cloro per eliminare la contaminazione fecale.
- Il cloro distrugge l’ozono, contribuendo al processo di riduzione dell’ozono. Infatti, un atomo di cloro può distruggere fino a 100.000 molecole di ozono prima di essere rimosso dalla stratosfera, secondo la U.S. Environmental Protection Agency.
- Le piscine si affidano al cloro per mantenere la loro pulizia. Secondo l’American Chemistry Council, l’acqua della maggior parte delle piscine dovrebbe contenere da due a quattro parti per milione di cloro. E quel forte odore di cloro che si sente quando si nuota in una piscina pubblica può essere in realtà un indicatore che il cloro aggiuntivo è necessario per bilanciare le sostanze chimiche nell’acqua.
Ricerca
Il cloro ha causato molto scalpore tra i ricercatori nel corso degli anni a causa di alcuni effetti nocivi che può avere sulla salute umana. Questi effetti, tuttavia, rimangono discutibili.
Il cloro è uno degli atomi di una tossina che alcune rane sudamericane hanno nella loro pelle. Può paralizzare o addirittura uccidere grandi animali, secondo l’American Chemistry Council. I nativi della foresta tropicale colombiana erano soliti strofinare le punte delle loro frecce sulla pelle di queste “rane dal dardo avvelenato”. John Daly, uno scienziato del National Institutes of Health ha cercato di isolare il composto, chiamato epibatidina, ma non ha potuto ottenere abbastanza della sostanza (le rane sono in pericolo), e quello che ha sintetizzato aveva effetti collaterali indesiderati. Tuttavia, riorganizzando il composto a livello atomico, i chimici sperano di poter trovare alla fine una versione che sia un potente antidolorifico.
Ricerche precedenti hanno collegato il bere acqua clorata a un aumento del rischio di cancro. Per esempio, in uno studio pubblicato nel 1992 nell’American Journal of Public Health, i ricercatori hanno scoperto che le persone che bevevano acqua clorata avevano un rischio più alto del 21% di ammalarsi di cancro alla vescica e del 38% di ammalarsi di cancro al retto, rispetto alle persone che bevevano acqua non clorata. E, in un altro studio, pubblicato nel 2010 sulla rivista Environmental Health Perspectives, gli investigatori hanno scoperto che le persone che hanno nuotato in una piscina clorata per 40 minuti hanno aumentato i biomarcatori (cioè, alcuni indicatori molecolari) legati al rischio di cancro. Tuttavia, uno studio del 2017 pubblicato sulla stessa rivista ha trovato che mentre c’è un rischio maggiore di cancro alla vescica quando si beve acqua clorata, c’era poca o nessuna prova che collega il nuoto in una piscina clorata e il rischio di cancro alla vescica in uno studio che ha esaminato il numero di ore in piscina durante i mesi estivi e non estivi e durante diverse fasce di età.
Il Dipartimento della Salute e dei Servizi Umani degli Stati Uniti, l’Agenzia Internazionale per la Ricerca sul Cancro e l’Agenzia per la Protezione Ambientale degli Stati Uniti non hanno classificato il cloro come cancerogeno per l’uomo, secondo i Centri per il Controllo e la Prevenzione delle Malattie.
Quindi, il cloro fa male alla salute? Non esattamente, ha detto Preston J. MacDougall, professore di chimica alla Middle Tennessee State University di Murfreesboro.
“Non si vuole usare quantità eccessive di cloro, ma non dovremmo temere le sostanze chimiche perché non le capiamo”, ha detto MacDougall a Live Science.
In effetti, la mancanza di un’adeguata clorazione per uccidere i batteri nocivi, come l’E. coli, può avere conseguenze devastanti sulla salute umana e sulla vita, ha aggiunto. Per esempio, nel maggio 2000, a Walkerton, Ontario, sette persone sono morte e più di 2.300 si sono ammalate dopo che la fornitura di acqua della città è stata infettata da E. coli e altri batteri, secondo il Water Quality and Health Council. Se i livelli di cloro richiesti fossero stati mantenuti, il disastro avrebbe potuto essere evitato, anche dopo che l’acqua era stata contaminata, secondo un rapporto pubblicato dal Ministero del Procuratore Generale dell’Ontario.
Inoltre, aggiungere cloro all’acqua è un metodo che molti stanno cercando di rendere l’acqua pulita facilmente accessibile nei paesi in via di sviluppo. Uno studio pubblicato nel 2017 afferma che 3,4 milioni di persone muoiono ogni anno a causa di acqua contaminata da batteri nocivi, come l’E. coli, e che fino a 4,4 miliardi di persone non hanno una fonte affidabile di acqua potabile. Clorare la fornitura d’acqua, oltre a portare l’acqua più vicino alle comunità, è un passo importante per portare l’acqua pulita più vicino a coloro che ne hanno bisogno.
Inoltre, ci sono alcune notizie promettenti legate alla ricerca sul cloro. MacDougall ha sottolineato un recente studio sugli atomi di cloro trovati in una nuova classe di composti antibiotici che sono stati scoperti in piccoli organismi marini nelle acque del Nord Atlantico vicino alla Norvegia. Questi atomi di cloro sono essenziali per l’attività antibiotica dei composti, che possono essere efficaci contro lo Staphylococcus aureus resistente alla meticillina, un batterio che causa infezioni difficili da trattare nelle persone ed è resistente agli antibiotici comunemente usati, ha detto.
“La comunità di scoperta della droga è molto entusiasta di questi composti naturali perché sono efficaci contro MRSA”, ha detto MacDougall, che non è stato coinvolto nella ricerca, pubblicata nell’aprile 2014 sulla rivista Angewandte Chemie International Edition.
Informazioni aggiuntive di Rachel Ross, collaboratrice di Live Science.
Risorse aggiuntive
- Per vedere quanto è reattivo il cloro quando interagisce con altri composti, guarda questo divertente video realizzato da Periodic Videos.
- Scopri le numerose e sorprendenti applicazioni del cloro su questo sito web chiamato Elements of Surprise che è dedicato a questo versatile elemento.
- Se vuoi saperne di più su come l’esposizione al cloro può influenzare la tua salute, controlla la sezione FAQ sul cloro sul sito del CDC.
Notizie recenti