Michael D. Ober, MD
Christina M. Klais, MD
Emmett T. Cunningham Jr.., MD, PhD, MPH
New York City
Edemul macular reprezintă acumularea patologică de lichid extracelular în interiorul retinei, în principal în straturile plexiform extern și nuclear intern, ca răspuns nespecific la o ruptură a barierelor hemato-retiniană. EM este o cauză frecventă de pierdere a vederii la pacienții cu diabet zaharat, ocluzie venoasă retiniană, uveită și în urma unei intervenții chirurgicale intraoculare. Apare mai puțin frecvent în contextul tracțiunii vitreoretiniene, al neovascularizării coroidiene și al unui număr de alte afecțiuni. Multe strategii au fost utilizate pentru a gestiona ME cu succese diferite. Acest articol trece în revistă opțiunile de tratament disponibile pentru această afecțiune frecventă.
 |
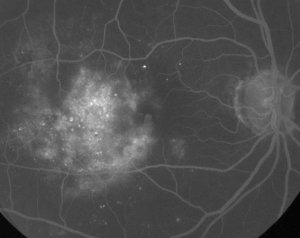 |
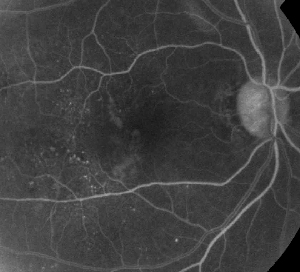
| Figura 1. A. Angiografia cu fluoresceină în fază precoce a unui pacient cu retinopatie diabetică neproliferativă. Microanevrismele sunt observate cel mai proeminent temporal la nivelul foveei, în plus față de scurgerile de fluoresceină în zona avasculară foveală. | B. FA în fază târzie a aceluiași pacient care prezintă scurgeri difuze temporale și în zona avasculară foveală corespunzătoare edemului macular diabetic. |
Diagnostic
Diagnosticul
Diagnosticul clinic al ME este cel mai bine pus cu ajutorul unei lentile de contact și a biomicroscopiei fundului de ochi cu lampă cu fantă stereoscopică. ME se manifestă de obicei ca o elevație neregulată în interiorul retinei, adesea adiacentă lipidelor intraretiniene, microanevrismelor și/sau hemoragiilor în cazurile secundare diabetului zaharat, ocluziei vasculare sau ischemiei. Lichidul intraretinian se poate acumula, de asemenea, în spații chistice localizate la nivelul retinei parafoveale, cu sau fără anomalii vasculare adiacente. Acest edem macular cistoid (EMC) rezultă cel mai frecvent din inflamație, tracțiune localizată sau în urma unei intervenții chirurgicale.
Angiografia cu fluoresceină este un instrument esențial în diagnosticul ME. În ochiul normal, fluoresceina este împiedicată să treacă în retină de barierele sânge-retină. Cu toate acestea, în ME, moleculele de fluoresceină părăsesc spațiul intravascular pentru a intra în retină. Locurile afectate prezintă hiperfluorescență în cadrele timpurii și medii, care crește în suprafață și intensitate în cadrele ulterioare (a se vedea figura 1). FA nu numai că evidențiază edemul pentru o vizualizare și o localizare ușoară a tratamentului, dar creează, de asemenea, o înregistrare permanentă pentru comparații viitoare. Pentru ME a fost elaborată o scală cantitativă cu patru grade, în care gradul 0 nu reprezintă hiperfluorescență perifoveală, gradul 1 reprezintă hiperfluorescență perifoveală incompletă, gradul 2 reprezintă hiperfluorescență ușoară la 360 de grade, gradul 3 reprezintă hiperfluorescență moderată la 360 de grade, zona hiperfluorescentă fiind de aproximativ 1 diametru al discului, iar gradul 4 reprezintă hiperfluorescență severă la 360 de grade, zona hiperfluorescentă fiind de aproximativ 1,5 diametru al discului.1,2 În timp ce FA este un mijloc sensibil de identificare a prezenței ME, aceasta oferă relativ puține informații cu privire la distribuția anatomică a fluidului, adică difuză vs. chistică vs. subretiniană, și la severitatea scurgerii în timp. FA nu oferă informații cantitative cu privire la îngroșarea retinei. Prin urmare, nu este surprinzător faptul că, în general, acest sistem de clasificare bidimensional bazat pe FA are o corelație slabă cu vederea.3,4
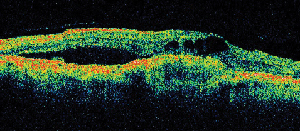
Tomografia în coerență optică (OCT III, Carl Zeiss) este o tehnică de imagistică noncontact, neinvazivă, care oferă un adjuvant util în diagnosticarea ME. Aceasta direcționează un fascicul de lumină în infraroșu apropiat (830 nm) perpendicular pe suprafața retinei și analizează proprietățile reflexiilor. În 1,5 secunde, aceasta produce o singură imagine liniară de înaltă rezoluție a secțiunii transversale. Aceste imagini pot afișa și chiar măsura retina îngroșată, chistică, întâlnită în zonele edematoase. De asemenea, este utilă în vizualizarea proprietăților interfeței vitreoretiniene și demonstrează în mod eficient când tracțiunea vitrosului joacă un rol în formarea ME (a se vedea figura 2).
Un studiu a folosit OCT pentru a examina 84 de ochi cu ME secundară uveitei, ceea ce a oferit avantajul suplimentar de a dezvălui sau de a confirma prezența membranelor epiretiniene și a dezlipirilor seroase de retină în 41 și, respectiv, 20 la sută din cazurile lor.5 Studiul a constatat o corelație moderată între grosimea retinei și scăderea acuității vizuale, deși gradul de corelație a variat de la un studiu la altul, alți cercetători raportând corelații slabe,6 moderate,7 și puternice8,9,10 folosind diferite metode statistice la diverse populații de pacienți, inclusiv pacienți cu retinopatie diabetică, uveită și EMC.
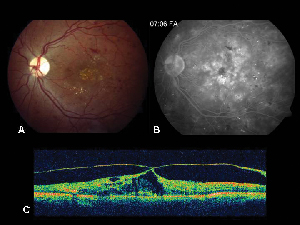
Figura 2. A. Fotografie color a fundului de ochi stâng al unui pacient cu retinopatie diabetică neproliferativă și exsudație lipidică în și în jurul foveei. B. FA în fază târzie relevă edem macular în macula centrală. C. Tomografia în coerență optică demonstrează interfața vitreoretiniană anormală, precum și edemul macular.
Un alt grup a raportat că OCT a fost la fel de eficientă ca FA în detectarea ME și superioară FA în descrierea distribuției axiale a fluidului.6 OCT are, de asemenea, capacitatea de a identifica unii pacienți cu ME care nu sunt vizualizați la FA, ca în anumite cazuri de EMC cronică în care tipul de scurgere activă cel mai bine vizualizată cu FA este minimă sau chiar absentă, sau atunci când examinarea fundului de ochi este compromisă de prezența opacităților medii, cum ar fi la pacienții cu hialoză asteroidă.11
Analizatorul de grosime a retinei (RTA, Talia Technology, Israel) este o tehnică similară de imagistică fără contact care permite cuantificarea grosimii retinei. Acesta produce 16 scanări paralele ale secțiunii transversale pe o suprafață de 3×3 mm pătrați de retină prin analiza reflexiilor unui impuls de lumină verde (540 nm) direcționat oblic, livrat timp de 0,3 secunde. Atât OCT, cât și RTA au demonstrat o precizie excelentă în măsurătorile lor individuale ale grosimii retinei, iar o comparație directă a tehnologiilor a demonstrat o corelație semnificativă din punct de vedere statistic între măsurătorile lor. În timp ce RTA are avantajul achiziției rapide cu poate mai puține artefacte, pare să fie mai puțin eficientă la măsurarea grosimii retinei decât OCT în prezența opacităților medii.12
Un alt studiu a comparat grosimea foveală cu RTA și OCT la 30 de ochi sănătoși. Grosimea foveală medie la ochii normali a fost măsurată la 181 µm și 153 µm pentru RTA și, respectiv, OCT. Autorii au concluzionat că RTA produce ocazional valori fals ridicate și, prin urmare, are o fiabilitate redusă în comparație cu OCT.13 În schimb, o analiză a pacienților cu retinopatie diabetică non-proliferativă ușoară a constatat că RTA a fost mai sensibilă decât OCT în identificarea zonelor de îngroșare a retinei în timpul etapelor inițiale ale ME diabetice.14
 |
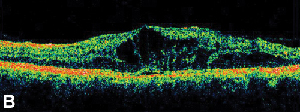 |
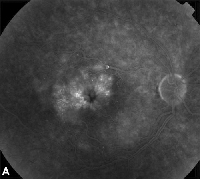
| Figura 3. A. Angiograma cu fluoresceină în fază tardivă a unui pacient cu edem macular cistoid. | B. Tomografia în coerență optică care arată spațiile chistice mari la nivelul foveei. |
Tratamente -Medicale
Medicamentele antiinflamatoare nesteroidiene topice sunt cel mai frecvent tratament pentru ME după operația de cataractă (vezi figura 3). Acești agenți sunt direcționați spre diminuarea nivelurilor de prostaglandine intraoculare, care au fost implicate în patogeneza ME. Studii dublu-mascate, randomizate, active și controlate cu placebo, incluzând pacienți supuși unei intervenții chirurgicale de cataractă, au raportat efecte antiinflamatorii ale preparatelor oftalmice aplicate local 1% indometacin, 0,03% flurbiprofen, 0,5% ketorolac și 0,1% diclofenac.15,16 Diclofenac 0,1% și ketorolac 0,5% soluții oftalmice, cu toate acestea, sunt singurele AINS aplicate local aprobate în mod specific de Food and Drug Administration pentru această indicație. S-a constatat că terapia care combină un corticosteroid topic și picături de AINS a avut o eficacitate mai mare în tratarea ME decât oricare dintre medicamente singure.16 Deși nu sunt aprobate de FDA, AINS topice sunt adesea utilizate înainte de operația de cataractă pentru a preveni ME postoperatorie.
Acetazolamida orală este utilizată ocazional în tratamentul ME secundare afecțiunilor inflamatorii și retinitei pigmentare, în special atunci când AINS topice și corticosteroizii eșuează. Mai multe studii prospective, mascate, încrucișate, care au comparat acetazolamida și placebo la pacienții cu ME datorată unei varietăți de cauze. Un studiu încrucișat pe cinci cicluri la 41 de pacienți a constatat un răspuns reproductibil, caracterizat fie prin rezolvarea parțială, fie prin rezolvarea completă a ME, la mai mult de jumătate dintre pacienții cu boală ereditară sau inflamatorie a retinei, dar niciun răspuns din partea celor cu afecțiuni vasculare primare ale retinei.17 S-a constatat că o doză de acetazolamidă de 500 mg/zi sau pe cale orală a fost mai eficientă decât o doză de 250 mg/zi în tratarea ME la pacienții cu ME secundară la RP.18 Acest studiu a observat o ameliorare la 10 din 12 pacienți tratați.
Un alt grup a concluzionat că pacienții cu vârsta sub 55 de ani cu ME atribuită iridociclitei cronice au răspuns mai degrabă la 500 mg de acetazolamidă b.i.d. decât pacienții mai în vârstă.19 Un studiu recent a sugerat că acetazolamida poate fi, de asemenea, eficientă și pentru tratamentul ME indusă de diabet.20
Corticosteroizii sunt agenți antiinflamatori puternici care sunt utilizați frecvent în tratamentul ME. Aceștia au multiple mecanisme de acțiune, inclusiv stabilizarea barierei hemato-retiniene și inhibarea mediatorilor pro-inflamatori. Modurile de administrare includ administrarea topică, injecția perioculară, injecția intravitreană și atât administrarea orală, cât și cea intravenoasă. În timp ce corticosteroizii administrați pe cale orală și intravenoasă ating cu siguranță niveluri terapeutice în vitros, aceștia expun pacienții la riscul suplimentar de complicații sistemice și, prin urmare, sunt de obicei rezervați pentru pacienții cu uveită care amenință vederea în contextul unei boli sistemice. Picăturile de corticosteroizi topici se află la celălalt capăt al spectrului de siguranță, dar capacitatea lor de a ajunge la segmentul posterior este limitată.
Injecțiile sub-Tenon oferă o alternativă pentru a administra doze relativ mari de corticosteroizi la nivelul ochiului, cu riscuri mai mici de complicații sistemice.21 Deși nu au existat studii randomizate și controlate, injecția de corticosteroizi sub-Tenon a fost utilizată eficient în tratarea edemului macular timp de mulți ani. Cea mai frecventă tehnică utilizează un ac scurt de 25 de grade plasat prin conjunctiva bulbară superotemporală în spațiul sub-Tenon’s în timp ce pacientul privește inferonasal. Acul este avansat posterior de-a lungul globului folosind o mișcare de măturare de la o parte la alta pentru a preveni penetrarea involuntară a globului, până când butucul ajunge la locul de intrare în conjunctivă, când se administrează medicamentul. Un raport a inclus 20 de pacienți consecutivi cu uveită intermediară asociată cu pierderea vederii, care au fost tratați cu o injecție sub-Tenon de 40 mg de acetonidă de triamcinolonă.22 Deși nu toți pacienții au demonstrat ME pe FA, 67 la sută dintre ei s-au îmbunătățit cu două linii de vedere în urma unui singur tratament. Riscurile acestei proceduri includ, printre altele, presiune intraoculară crescută persistentă, cataractă, ptoză și penetrare intraoculară.
Recent, utilizarea injecției intravitreene de acetonidă de triamcinolon (Kenalog, 4,0 mg) a crescut datorită capacității sale puternice de a ameliora ME refractară secundară diabetului zaharat (vezi figura 4), ocluziilor venoase retiniene, inflamației și altor cauze idiopatice.23-26 Studiile preliminare arată o reducere dramatică a îngroșării retinei, scăderea scurgerilor de fluoresceină și o îmbunătățire vizuală, care poate fi marcantă la unii pacienți. Deși efectul este temporar și durează de obicei între trei și șase luni sau mai puțin, ME răspunde de obicei la reinjectare. Cu toate acestea, utilizarea corticosteroizilor intravitreali este asociată cu un risc de 30 până la 40 la sută de presiune intraoculară crescută persistentă și un risc de aproximativ 10 la sută de cataractă care necesită intervenție chirurgicală. Institutul Național de Oftalmologie înrolează în prezent pacienți pentru SCORE, studiul „Standard Care vs. Corticosteroid for retinal vein occlusion”, care compară injecțiile intravitreene de triamcinolon (doze de 1 și 4 mg) cu îngrijirea standard (observație și/sau tratament cu laser cu grilă) la pacienții cu ME secundară ocluziei venoase. Studiul va urmări un total de 1.260 de pacienți și va continua tratamentul timp de 36 de luni.
ME apare, de asemenea, în cazul degenerescenței maculare legate de vârstă (a se vedea figura 5). Injectarea intravitreană de acetonidă de triamcinolonă este în prezent în curs de investigare pentru utilizarea combinată cu terapia fotodinamică pentru tratamentul AMD neovasculară (Visudyne cu acetonidă de triamcinolonă intravitreană, VisTA). Un studiu subliniază importanța triamcinolonei intravitreene care precede aplicarea PDT la pacienții cu edem macular și CNV.27 Autorii susțin că verteporfinul se poate scurge în spațiile intraretiniene chistice, ducând la afectarea fotoreceptorilor retinei adiacente, normale, odată ce medicamentul este fotoactivat, în timp ce rezolvarea prealabilă a edemului retinian poate preveni această complicație. Administrarea prealabilă a corticosteroizilor poate servi, de asemenea, la atenuarea oricărei creșteri induse de PDT a nivelurilor intraoculare de VEGF.
Injecțiile intravitreale în sine sunt asociate cu riscuri mici, dar certe, de efecte secundare grave, potențial orbitoare, inclusiv endoftalmită infecțioasă, dezlipire de retină, hemoragie, hipertensiune oculară, cataractă și hipotonie.28 Orientările publicate recent pentru injecțiile intravitreale încearcă să stabilească o abordare bazată pe cele mai bune practici pentru această tehnică din ce în ce mai utilizată. Recomandările grupului de consens au abordat considerațiile preinjecție, inclusiv antibioticele, evaluarea glaucomului, utilizarea mănușilor și tratamentul anomaliilor preexistente ale pleoapelor, precum și importanța evitării manipulării excesive a pleoapelor înainte și în timpul procedurii. Regimul recomandat pentru peri-injecție a inclus utilizarea unui anestezic topic și/sau subconjunctival, a povidonei iodate topice și a unui speculum pentru pleoape. Autorii au subliniat importanța monitorizării PIO și a vizualizării directe a fundului de ochi după injecție pentru a verifica perfuzia nervului optic, localizarea intravitreană a triamcinolonei și absența hemoragiei sau a dezlipsei de retină asociate cu injecția. Aceștia au subliniat, de asemenea, importanța educației pacienților vis-a-vis de simptomele timpurii ale complicațiilor potențiale și a unei urmăriri amănunțite.29
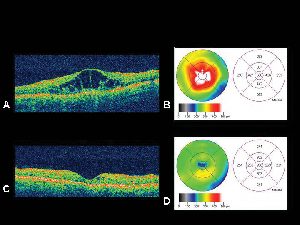
Figura 4. A. Imaginea prin tomografie în coerență optică a unui ochi cu edem macular diabetic cu harta corespunzătoare a grosimii retineiB. generată de OCT. C. OCT a aceluiași pacient la o lună de la injectarea intravitreană de acetonidă de triamcinolon cu harta corespunzătoare a grosimii retinei. D. Rezolvarea edemului macular. Acuitatea vizuală s-a îmbunătățit de la 20/200 la 20/80 în urma tratamentului.
În mai multe studii se investighează dispozitive alternative de administrare a corticosteroizilor pe termen lung pentru utilizarea în interiorul ochiului. Un studiu implică plasarea chirurgicală a unei pelete de acetonidă de fluocinolonă încorporată pe un suport de plastic cu eliberare controlată de steroizi timp de trei ani. Cunoscut sub numele de implant intravitreal Envision, produs de Bausch & Lomb și Control Delivery Systems, acesta este plasat prin pars plana și suturat la scleră. Un studiu de fază II/III, randomizat și mascat, a comparat implantul Envision TD la 80 de pacienți randomizați la 0,5 vs. 2,0 mg de acetonidă de fluocinolonă vs. standardul de îngrijire constând în fotocoagulare cu laser sau observație. După șase luni, s-a observat o reducere semnificativă din punct de vedere statistic a ME și a severității retinopatiei diabetice cu implantul de 0,5 mg în comparație cu tratamentul standard. În plus, nu au existat diferențe în ceea ce privește incidența efectelor adverse grave. Ramura de 2,0 mg a studiului a fost oprită prematur din cauza rezultatelor observate într-un al doilea studiu în care nu s-a observat niciun avantaj față de 0,5 mg. Un al doilea studiu a inclus 278 de pacienți cu uveită posterioară neinfecțioasă randomizați pentru a primi fie un implant Retisert de 0,59 mg, fie unul de 2,1 mg în ochiul afectat sau, în cazurile bilaterale, în ochiul mai grav afectat. După două doze și 34 de săptămâni, s-a înregistrat o rată de recurență semnificativ mai mică la ochii cu implant (10 vs. 55,7 la sută, p<0,0001), cu o scădere a utilizării corticosteroizilor sistemici/terapiei imunosupresoare (59,0 la sută la momentul inițial vs. 13,7 la sută la 34 de săptămâni), precum și a utilizării steroizilor subtenonici și topici. A existat o îmbunătățire semnificativă a acuității vizuale (p<0,05). Cele mai frecvente evenimente adverse au inclus progresia cataractei și creșterea presiunii intraoculare care a necesitat o procedură de filtrare la 8,6 la sută. (Jaffe G. Invest Ophthalmol Vis Sci. 2004; 44 ARVO E-Abstract #3369.)
Un alt studiu implică Posurdex de la Allergan, o pastilă bioerodabilă de dexametazonă injectată în spațiul vitros care eliberează medicația timp de 50 până la 160 de zile. Rezultatele unui studiu de fază II au arătat că atât un granuleț de 350 µg, cât și unul de 700 µg au îmbunătățit semnificativ procentul de pacienți cu o îmbunătățire a vederii cu două linii sau mai mult (27,2 la sută și 35,7 la sută pentru 350 µg și, respectiv, 700 µg), precum și o îmbunătățire a vederii cu trei linii sau mai mult (13 la sută și 19,4 la sută, pentru 350 µg și, respectiv, 700 µg) la 180 de zile, comparativ cu placebo. Până în prezent, nu a fost raportată o incidență crescută a cataractei, deși creșteri ale PIO au fost observate la aproximativ15 la sută dintre pacienți.
Tratamente -Laser
Cel mai recent, Macugen de la Eyetech și Pfizer a fost studiat într-un studiu de fază II randomizat, dublu-mascat, multicentric, controlat, cu doze variate, pe 172 de pacienți cu ME diabetică. Studiul a investigat trei doze (0,3 mg, 1,0 mg, 3,0 mg) față de injecții simulate administrate la fiecare șase săptămâni pentru trei injecții. În timp ce investigatorii anteriori cu laser focal/grilă au fost rugați să înroleze doar pacienți la care se simțeau confortabil să amâne laserul focal/grilă pentru cel puțin 12 săptămâni. Injecțiile suplimentare și/sau fotocoagularea focală/grilă au fost administrate la discreția investigatorului din săptămâna 18 până la 30. Evaluările finale au fost efectuate în săptămâna 36, la șase săptămâni după ultima injecție planificată. În general, subiecții repartizați să primească Macugen au avut rezultate mai bune în ceea ce privește vederea, au fost mai susceptibili de a prezenta o reducere a grosimii centrale a retinei și au fost considerați mai puțin susceptibili de a avea nevoie de terapie laser suplimentară în comparație cu pacienții simulanți.31 În prezent, este planificat un studiu de confirmare de fază III.
Photocoagularea cu laser focal/grilă rămâne standardul de îngrijire pentru tratamentul ME diabetice. Studiul Early Treatment Diabetic Retinopathy Study (Studiul privind retinopatia diabetică cu tratament timpuriu) a arătat că pacienții tratați cu laser cu grilă au avut o reducere cu 50% a pierderii moderate a vederii, definită ca o dublare a unghiului vizual sau o scădere de trei linii a vederii, în comparație cu observația.30 Deși mecanismul exact prin care laserul scade ME este necunoscut, se crede că promovează formarea de joncțiuni strânse între celulele RPE, precum și reducerea cererii de oxigen de la fotoreceptori și creșterea perfuziei de oxigen din coroidă.31 EDTRS a identificat pacienții eligibili pentru fotocoagularea cu laser focal ca având ME semnificativă din punct de vedere clinic. Aceasta a fost definită ca îndeplinind unul dintre următoarele trei criterii: 1) îngroșarea retinei situată la mai puțin de 500 µm de fovea; 2) exsudate dure la mai puțin de 500 µm de la fovea asociate cu îngroșarea retinei adiacente; sau 3) o zonă de edem de 1 diametru de disc sau mai mare, orice parte a acestuia fiind situată la mai puțin de 1 diametru de disc de la fovea. Cu toate acestea, EDTRS nu a făcut distincția între ME focală, care corespunde îngroșării locale a retinei adiacente microanevrismelor, și ME difuză, care se referă la o îngroșare generalizată a polului posterior. Dovezile anecdotice arată că ME diabetică focală răspunde bine la laserul focal/grilă, în timp ce varietatea difuză eșuează mai frecvent la tratamentul cu laser și necesită un management alternativ.
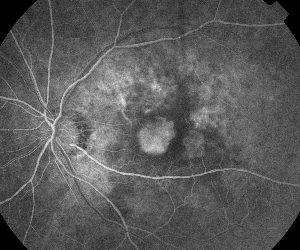 |
 |
| Figura 5. A. Angiogramă fluoresceinică precoce care arată neovascularizația subfoveală clasică. | B. Tomografia în coerență optică corespunzătoare relevă zone de acumulare de lichid subretinian și intraretinian, precum și demonstrarea neovascularizației (săgeată). |
Tratamente -Chirurgie
Primul grup care a raportat beneficiile vitrectomiei și ale separării hialoidei posterioare la pacienții cu ME diabetică a sugerat că există un subgrup de pacienți la care tracțiunea vitrosului și detașările maculare superficiale contribuie la îngroșarea retinei. 32 Acest lucru a fost confirmat ulterior cu ajutorul OCT, ceea ce a dus la rafinarea indicațiilor pentru această tehnică.33,34 Cele mai mari trei serii35,36,37 de pacienți supuși vitrectomiei pentru ME diabetică care nu răspund la tratamente mai puțin invazive au analizat 59, 58 și, respectiv, 65 de pacienți. Acestea au raportat că 47%, 53% și, respectiv, 45% dintre pacienții lor și-au îmbunătățit vederea cu două linii sau mai mult. Ultimul dintre aceștia a raportat complicații postoperatorii grave dezvoltate la o minoritate de pacienți, inclusiv dezlipire de retină (1,5 la sută), rubeosis iridis (4,6 la sută) membrană epiretinală (13,8 la sută), hemoragie vitroasă recurentă(1,5 la sută) și depuneri de exudat dur foveal (4,6 la sută), în timp ce complicațiile relevate de cel de-al doilea grup au inclus membrane epiretinale în 10,2 la sută și cataractă în 63,2 la sută din ochii fazici. Mai multe alte serii de cazuri au arătat rezultate similare, însă toate au fost non-randomizate, fără control placebo și folosind diferite criterii de includere și excludere. Mai mult, tehnicile chirurgicale au fost, de asemenea, diferite, lăsând indicațiile exacte pentru vitrectomie la pacienții cu EMC deschise la interpretare.
ME rămâne o cauză majoră de pierdere a vederii, în ciuda varietății de tratamente disponibile. Fotocoagularea cu laser rămâne o parte integrantă a gestionării ME datorate diabetului, ischemiei și ocluziilor vasculare. AINS și corticosteroizii topici reprezintă în prezent principala metodă de control al ME postoperatorii, în timp ce acetazolamida rămâne un mijloc eficient de tratament la pacienții selectați cu ME secundară uveitei și retinitei pigmentare. Rolul corticosteroizilor intravitreali în terapia ME se extinde, dar rămâne limitat de efectele secundare și de durata efectului. Perfecționările în tehnicile chirurgicale vor continua să adauge o nouă dimensiune la ME care nu răspunde la un tratament mai puțin invaziv, în timp ce progresele în farmacoterapie și în administrarea de medicamente oculare promit să joace un rol în prevenirea și gestionarea tuturor cauzelor și tipurilor de ME.
Dr. Ober este bursier în chirurgie vitreoretinală la Edward S. Harkness Eye Institute din cadrul Columbia University College of Physicians and Surgeons și la LuEsther T. Mertz Retinal Research Center din cadrul Manhattan Eye, Ear, and Throat Hospital. Contactați-l la 210 East 64th St., 8th Fl, New York, NY 10021; e-mail: [email protected]; sau (212) 605 3777 sau fax (212) 605 3795.
Dr. Klais este cercetător în domeniul retinei la LuEsther T. Mertz Retinal Research Center. Contactați-o la aceeași adresă, la aceleași numere de telefon sau fax, sau prin e-mail la [email protected].
Dr. Cunningham este profesor clinic de oftalmologie și director al Serviciului de Uveită la Universitatea din New York, Facultatea de Medicină. El este, de asemenea, angajat al Eyetech Pharmaceuticals Inc. Contactați-l la Vitreous-Retina-Macula Consultants of New York, 460 Park Ave., New York, N.Y. 10022, prin e-mail [email protected], sau prin telefon/fax la (212) 861 9797.
1. Spaide RF, Yannuzzi LA, Sisco LJ. Edemul macular cistoid cronic și predictorii acuității vizuale. Ophthalmic Surg 1993;24:262-267.
2. Yannuzzi LA. O perspectivă asupra tratamentului edemului macular chistoid cistoid afacic. Surv Ophthalmol 1984;28:540-553
3. Chang A, Spaide RF, Yannuzzi LA. Edemul macular cistoid post-chirurgical cistoid. În: In: Guyer DR, Yannuzzi LA, Chang S, et al. Retina, Vitreous, Macula. Saunders. Philadelphia. 1999;1:239-255.
4. Nussenblatt RB, Kaufman SC, Palestine AG, et al. Îngroșarea maculară și acuitatea vizuală. Măsurare la pacienții cu edem macular cistoid. Ophthalmology 1987;94:1134-9.
5. Markomichelakis NN, Halkiadakis I, Pantelia E, et al. Modele de edem macular la pacienții cu uveită: evaluare calitativă și cantitativă utilizând tomografia cu coerență optică. Ophthalmology 2004;111:946-53.
6. Antcliff RJ, Stanford MR, Chauhan DS, et al. Comparație între tomografia cu coerență optică și angiografia cu fluoresceină a fundului de ochi pentru detectarea edemului macular cistoid la pacienții cu uveită. Ophthalmology 2000; 107:593-9.
7. Otani T, Kishi S, Maruyama Y. Patterns of diabetic macular edema with optical coherence tomography. Am J Ophthalmol 1999;127:688-93.
8. Hee MR, Puliafito CA, Wong C, et al. Evaluarea cantitativă a edemului macular cu ajutorul tomografiei cu coerență optică. Arch Ophthalmol 1995;113:1019-29.
9. Nussenblatt RB, Kaufman SC, Palestine AG, et al. Îngroșarea maculară și acuitatea vizuală. Măsurare la pacienții cu edem macular cistoid. Ophthalmology 1987;94:1134-9.
10. Ozdek SC, Erdinc MA, Gurelik G, și colab. Evaluarea tomografică cu coerență optică a edemului macular diabetic: comparație cu rezultatele angiografice și clinice cu fluoresceină. Ophthalmologica 2005;219:86-92.
11. Browning DJ, Fraser CM. Tomografia cu coerență optică pentru detectarea edemului macular în prezența hialozei asteroidale. Am J Ophthalmol 2004;137:959-961.
12. Polito A, Shah SM, Haller JA et al. Comparație între analizatorul de grosime a retinei și tomografia cu coerență optică pentru evaluarea grosimii foveale la ochii cu boală maculară. Am J Ophthalmol 2002;134:240-51.
13. Neubauer AS, Priglinger S, Ullrich S, et al. Compararea grosimii foveale măsurate cu analizorul de grosime retiniană și tomografia în coerență optică. Retina 2001;21:596-601.
14. Pires I, Bernardes RC, Lobo CL, Soares MA, Cunha-Vaz JG. Grosimea retinei la ochii cu retinopatie nonproliferativă ușoară la pacienții cu diabet zaharat de tip 2: compararea măsurătorilor obținute prin analiza grosimii retinei și tomografia cu coerență optică. Arch Ophthalmol 2002 Oct;120(10):1301-6.
15. Flach AJ. Inhibitorii ciclo-oxigenazei în oftalmologie. Surv Ophthalmol 1992;36:259-284.
16. Heier JS, Topping TM, Baumann W, Dirks MS, Chern S. Ketorolac versus prednisolon versus terapie combinată în tratamentul edemului macular cistoid cistoid acut pseudofakic. Ophthalmology 2000;107:2034-8.
17. Cox SN, Hay E, Hay E, Bird AC. Tratamentul edemului macular cronic cu acetazolamidă. Arch Ophthalmol 1988;106:1190-5.
18. Fishman GA, Gilbert LD, Fiscella RG, Kimura AE, Jampol LM. Acetazolamida pentru tratamentul edemului macular cronic în retinita pigmentară. Arch Ophthalmol 1989;107:1445-52.
19. Farber MD, Lam S, Tessler HH, Tessler HH, Jennings TJ, Cross A, Rusin MM. Reducerea edemului macular prin acetazolamidă la pacienții cu iridociclită cronică: un studiu încrucișat prospectiv randomizat. Br J Ophthalmol 1994;78:4-7.
20. Giusti C, Forte R, Forte R, Vingolo EM, Gargiulo P. Este acetazolamida eficientă în tratamentul edemului macular diabetic? Un studiu pilot. Int Ophthalmol 2001;24:79-88.
21. Jennings T, Rusin MM, Tessler HH, Cunha-Vaz JG. Injecții posterioare sub-Tenon de corticosteroizi la pacienții cu uveită cu edem macular cistoid. Jpn J Ophthalmol 1988;32:385-91.
22. Helm CJ, Holland GN. Efectele injecției subtenonului posterior de triamcinolon acetonidă la pacienții cu uveită intermediară. Am J Ophthalmol 1995;120:55-64.
23. Benhamou N, Massin P, Haouchine B, Audren F, et al. Triamcinolonă intravitreană pentru edemul macular pseudophakic refractar. Am J Ophthalmol 2003;135:246-9.
24. Jonas JB, Kreissig I, Degenring RF. Triamcinolon acetonida intravitreană ca tratament al edemului macular în ocluzia venei centrale a retinei. Graefes Arch Clin Exp Ophthalmol. 2002;240:782-3.
25. 25. Martidis A, Duker JS, Greenberg PB, Rogers AH, et al. Triamcinolona intravitreană pentru edemul macular diabetic refractar. Ophthalmology 2002; 109: 920-7.
26. 26. Scott IU, Flynn HW HW Jr., Rosenfeld PJ. Triamcinolon acetonida intravitreană pentru edemul macular cistoid idiopatic. Am J Ophthalmol 2003;136:737-9.
27. 27. Freund KB, Klais CM, Eandi CM, et al. Sequenced Combined Intravitreal Triamcinolone and Indocyanine Green Angiography Guided Photodynamic Therapy for Retinal Angiomatous Proliferation. Arch Ophthalmol, In Press.
28. 28. Jager RD, Aiello LP, Patel SC, Cunningham ET Jr. Riscurile injecției intravitreale: o revizuire cuprinzătoare. Retina. 2004 Oct;24(5):676-98.
29. 29. Aiello LP, Brucker AJ, Chang S, et al. Orientări în evoluție pentru injecțiile intravitreale. Retina 2004 Oct;24(5 Suppl):S3-19.
30. .G.Jaffe, Fluocinolone Acetonide Uveitis Study Group. Fluocinolone Acetonide Intravitreal Implant pentru uveita care afectează segmentul posterior al ochiului. ARVO 2004, poster #3369.
31. Grupul de studiu Macugen pentru retinopatie diabetică. Un studiu de fază II randomizat, dublu-mascat al pegaptanibului, un aptamer anti-factor de creștere endotelială vasculară, pentru edemul macular diabetic. Ophthalmology, In press.
32. 30. Fotocoagulare pentru edemul macular diabetic. Raportul numărul 1 al Early Treatment Diabetic Retinopathy Study. Arch Ophthalmol 1985;103:1796-806.
33. Christoforidis JB, D’Amico DJ. Tratamente chirurgicale și alte tratamente ale edemului macular diabetic: o actualizare. Int Ophthalmol Clin 2004;44:139-60.
34. Lewis H, Abrams GW, Blumenkranz MS, Campo RV. Vitrectomie pentru tracțiune maculară diabetică și edem asociat cu tracțiune hialoidală posterioară. Ophthalmology 1992;99:753-9.
35. Kaiser PK, Riemann CD, Riemann CD, Sears JE, Lewis H. Desprinderea de tracțiune maculară și edemul macular diabetic asociat cu tracțiunea hialoidală posterioară. Am J Ophthalmol 2001;131:44-9.
36. Lewis H. Rolul vitrectomiei în tratamentul edemului macular diabetic. Am J Ophthalmol 2001;131:123-5.
37. Pendergast SD. Vitrectomia pentru edemul macular diabetic asociat cu un hialoid posterior premacular tensionat. Curr Opin Ophthalmol 1998;9:71-5.
38. Tachi N, Ogino N. Vitrectomia pentru edemul macular difuz în cazurile de retinopatie diabetică. Am J Ophthalmol 1996;122:258-60.
39. Yamamoto T, Hitani K, Tsukahara I, Yamamoto S, et al. Modificări postoperatorii timpurii ale grosimii retinei și complicații după vitrectomia pentru edemul macular diabetic. Am J Ophthalmol 2003;135:14-9.
.