- Introduktion
- Metoder
- Inkludering och exkludering av patienter
- Standardprotokollgodkännanden och patientmedgivanden
- Undersökningsprogram
- Statistik
- Resultat
- Frekvens av IDNA hos RLS-patienter
- Kliniska egenskaper hos RLS-patienter med IDNA jämfört med NID
- Kliniska egenskaper hos RLS-patienter med IDNA jämfört med IDA
- Hematologiska egenskaper hos kontrollpersoner
- Diskussion
- Kliniska drag av IDNA vid RLS
- Är IDNA ett tidigt stadium före IDA vid RLS?
- Accessing and Diagnosing IDNA in RLS
- Slutsats
- Data Availability Statement
- Ethics Statement
- Författarens bidrag
- Finansiering
- Intressekonflikt
- Acknowledgments
- Supplementary Material
- Abkortningar
Introduktion
Restless Legs Syndrome (RLS) är en vanlig neurologisk sjukdom (1), och järnbrist spelar en nyckelroll i dess patogenes (2, 3). Järnbrist är vanligt vid RLS och järnbristanemi (IDA) är en välkänd orsak till sekundär RLS (4, 5), vilket är förknippat med en sexfaldigt ökad risk för RLS i den allmänna befolkningen (6). Järnbrist utan anemi (IDNA, även icke-anemisk järnbrist) är vanligtvis smygande och har nyligen uppmärksammats på grund av sin världsomspännande förekomst och utmaning när det gäller diagnos och behandling (7). Trots ett tydligt samband mellan den kliniska betydelsen av RLS i IDA-populationen (6) har förekomsten och egenskaperna hos IDNA i RLS inte undersökts systematiskt. Huruvida IDNA utgör en undergrupp av RLS och om IDNA är ett tidigt stadium före IDA i RLS är okänt. I den här studien syftar vi till att undersöka kliniska särdrag hos RLS med IDNA jämfört med dem utan järnbrist (NID, även icke-järnbrist) och med IDA-patienter i en konsekutiv kohort av kinesiska RLS-patienter.
Metoder
Inkludering och exkludering av patienter
Vi rekryterade kontinuerligt patienter från vår specialistklinik för RLS och kliniken för rörelsestörningar på neurologiavdelningen, Shanghais allmänna sjukhus, Shanghai Jiao Tong University School of Medicine mellan jan. 2017 och okt. 2018. RLS diagnostiserades enligt 2014 års International Restless Legs Syndrome Study Group (RLSSG) diagnostiska kriterier (1). Patienter med andra neurologiska sjukdomar, dåligt samarbete eller kognitiv nedsättning exkluderades från studien. Ålders- och könsmatchade friska kontroller utan anemi rekryterades under samma period i hälsoundersökningscentret på vårt sjukhus. Kontrollerna var fria från neurologisk sjukdom inklusive RLS genom personlig intervju.
Standardprotokollgodkännanden och patientmedgivanden
Studien godkändes av Shanghai General Hospital Institutional Review Board och alla patienter och friska kontroller som ingick i studien gav sitt skriftliga samtycke.
Undersökningsprogram
RLS-patienter utvärderades enligt vår tidigare beskrivning (8). Kortfattat intervjuade vi patienterna ansikte mot ansikte på vår öppenvårdsklinik. Patienter som ansågs positiva för RLS fick sin diagnos av två neurologer specialiserade på RLS. Vi registrerade demografisk information, historia, symtom, mediciner, allmänna neurologiska och medicinska undersökningar samt MMSE för alla rekryterade patienter. Vidare bedömdes ett semistrukturerat frågeformulär som omfattade ålder för RLS-debut, RLS-familjehistoria (förtrogenhet definierad som ”förstagradssläktingar”), typ och topografi av förnimmelser och om RLS-symtom korrelerade med säsongsvariationer. RLS svårighetsgrad under en vecka före intervjun bedömdes med hjälp av International RLS rating scale (IRLSRS) (9). Undersökningar som vaskulärt ultraljud, nervledningshastighet, elektromyografi etc. utfördes om det var kliniskt indicerat för att utesluta möjliga RLS-mimiker som perifera polyneuropatier, venös stasis, vaskulär claudicatio, reumatoid artrit osv. Försökspersoner med medicineringshistorik av neuroleptika eller annan medicinering som författarna ansåg vara möjligen relaterad till RLS under de föregående tre månaderna exkluderades också. Vi uteslöt dem med anmärkningsvärda komorbiditeter som förknippades med sekundär RLS som kronisk njursvikt, graviditet, Parkinsons sjukdom, perifer neuropati, stroke och ataxi. Blodprover för hemoglobin och perifer järnstatus inklusive serumferritin, järn, transferrin och total järnbindningskapacitet (TIBC) bedömdes. Transferrinmättnad (TSAT) beräknades som serumjärn/TIBC × 100. Normal hemoglobinnivå definierades som kvinnor ≥ 113 g/L och män ≥ 131 g/L enligt normalvärdet på vårt sjukhus. IDNA definieras som serumferritin <75 μg/L (eller ferritin ≥ 75 μg/L men TSAT <20 %) med normal hemoglobinnivå (10, 11). IDA diagnostiseras när hemoglobin <113 g/L (kvinnor) eller <131 g/L (män) samt serumferritin <75 μg/L (eller serumferritin ≥ 75 μg/L men TSAT <20 %).
Statistik
Data analyserades med hjälp av SPSS 21.0 för Windows (IBM Co., USA). Alla data presenteras som medelvärden ± standardavvikelser. Eftersom de flesta variabler inte var normalfördelade användes Kruskal-Wallis-testet för jämförelser av enskilda variabler mellan tre grupper, och post-hoc Mann-Whitney när P < 0,05. Skillnader i proportioner analyserades med Pearsons chi-kvadrat- eller Fishers exakta test när så var lämpligt. P < 0,05 ansågs vara signifikant. Med tanke på de potentiella effekterna av läkemedelsbehandling på RLS-symptom och andra egenskaper beräknade vi alla data två gånger i de totala RLS-patienterna respektive i RLS-patienter utan medicinering.
Resultat
Vi rekryterade kontinuerligt sammanlagt 196 primära RLS-patienter utan anemi (IDNA RLS och NID RLS) i den här studien, inklusive 66 manliga patienter (33,7 %) och 130 kvinnliga patienter (66,3 %). Medelåldern var 53,0 ± 13,5 år. 65,8 % (129/196) av RLS-patienterna tog inte läkemedel mot RLS (109 läkemedelsnaiva och 20 läkemedelsfria i mer än 2 veckor vid intervjun). Vi inkluderade också 26 RLS-patienter med IDA (22 läkemedelsnaiva). Vi exkluderade fem anemiska RLS-patienter (Hb <113 g/L för kvinnor och Hb <131 g/L för män) som inte hade bevis på järnbrist (serumferritin ≥ 75 μg/L samt TIBC ≥ 20 %, genomsnittligt serumferritin som 236,1 ± 119,3 μg/L). Ingen av RLS-patienterna med IDA hade några tecken på infektion, och orsakerna till IDA RLS listades (tabell 1). Dessutom samlade vi in 63 friska kontrollpersoner varav 22 manliga personer (34,9 %) och 41 kvinnliga personer (65,1 %), och kontrollgruppens medelålder var 51,0 ± 12,0 år (medelåldern 51,0 ± 10,4 och 51,0 ± 12,8 för män respektive kvinnor). Det fanns inga signifikanta skillnader i både kön (RLS vs. kontroll: 66,3 vs. 65,1 % för kvinnor, P > 0,05) och ålder (RLS vs. kontroll: 53,0 ± 13,5 vs. 51,0 ± 12,0, P > 0,05) mellan RLS-patienter och kontroller. Detaljerad demografisk information om patienter med RLS i varje grupp visas (tabell 2).
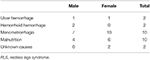
Tabell 1. Möjliga orsaker till järnbrist hos anemiska RLS-patienter.
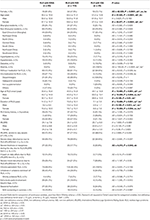
Tabell 2. Demografisk information och kliniska egenskaper hos RLS-patienter med IDNA, NID och IDA.
Frekvens av IDNA hos RLS-patienter
Av de 196 RLS-patienterna (130 kvinnor, 66 män) utan anemi eller andra komorbiditeter hade 83 (42,3 %) järnbrist. Prevalensen av IDNA hos kvinnor (58,5 %, 76/130) är mycket högre än hos män (10,6 %, 7/66) i denna kohort av RLS-patienter utan anemi (tabell 2), med en relativ risk på 5,51 (95 % konfidensintervall 2,70-11,27, p < 0,0001).
Kliniska egenskaper hos RLS-patienter med IDNA jämfört med NID
I kvinnliga RLS-patienter utan anemi hade IDNA-gruppen en yngre ålder både vid intervju och vid RLS-debut jämfört med NID-gruppen (P < 0,01; tabell 2). Även om det inte fanns någon skillnad i fråga om svårighetsgraden av RLS enligt IRLSRS fann vi fler patienter med svår/mycket svår trötthet eller sömnighet under dagen i IDNA-gruppen jämfört med NID-gruppen (32,5 vs. 17,7 %, P < 0,05; tabell 2). Det fanns ingen skillnad avseende familjehistoria, svårighetsgrad, lateralitet, lokalisering och säsongsfluktuation av RLS mellan IDNA- och NID-gruppen, varken hos män eller kvinnor. IDNA RLS-gruppen uppvisade lägre serumferritin (män och kvinnor, P < 0,0001) samt högre transferrin- och TIBC-värden (kvinnor, P < 0,0001) jämfört med NID RLS-gruppen (figur 1, tabell 3).
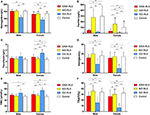
Figur 1. De hematologiska och järnparametrarna per grupp och kön (A) Hemoglobin. (B) Ferritin. (C) Transferrin. (D) Järn. (E) TIBC. (F) TSAT. **P < 0,01, *P < 0,05, Kruskal-Wallis-test och post-hoc Mann-Whitney-test. Data jämförs mellan IDNA RLS (n = 83), NID RLS (n = 113), IDA RLS (n = 26) och kontroller (n = 63). ##P < 0,01, #P < 0,05, Mann-Whitney U-test. Data jämförs mellan män och kvinnor i varje grupp av IDNA RLS, NID RLS, IDA RLS och kontroller. Järnbrist definierades som ferritinnivå <75 μg/L, eller ferritin 75 μg/L, men TSAT <20 %. IDA, järnbristanemi; IDNA, järnbrist utan anemi; NID, icke-järnbrist; RLS, restless legs syndrome; TIBC, total järnbindningskapacitet; TSAT, transferrinmättnad.
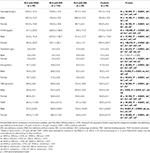
Tabell 3. Hematologiska data för RLS-patienter med IDNA, NID, IDA och kontroller.
Efter att ha uteslutit RLS-patienter som fick mediciner mot RLS visade IDNA RLS-gruppen fortfarande högre andelar av svår/mycket svår trötthet/sömnighet dagtid jämfört med NID RLS-gruppen, dock inte på en signifikant nivå (35 vs. 18,8 %, P = 0,078). Andra egenskaper mellan IDNA RLS och NID RLS var likartade (kompletterande tabell 1).
Kliniska egenskaper hos RLS-patienter med IDNA jämfört med IDA
IDA-gruppen hade mer allvarligt störda järnmetaboliska parametrar i serum än IDNA-gruppen, bland annat lägre ferritin (man, P < 0.05; kvinna, P < 0,0001), högre transferrin (kvinna, P < 0,0001), lägre järn (man, P < 0,05; kvinna, P < 0,0001), högre TIBC (kvinna, P < 0,0001) och lägre TSAT-värden (man, P < 0,05; kvinna, P < 0,0001) i serum (figur 1, tabell 3). IDNA RLS hade längre sjukdomsduration (P < 0,01 hos män, P < 0,05 hos kvinnor) och yngre ålder vid insjuknandet (endast signifikant hos män med P < 0,05) än IDA RLS. Det fanns inga skillnader när det gäller positiv familjehistoria, svårighetsgrad (IRLSRS), lateralitet, lokalisering och säsongsfluktuation av RLS mellan IDNA RLS och IDA RLS, varken hos män eller hos kvinnliga RLS-patienter (tabell 2). Resultaten var likartade efter att ha uteslutit RLS-patienter med läkemedel mot RLS (kompletterande tabell 1).
Hematologiska egenskaper hos kontrollpersoner
Diagnostiska kriterier för järnbrist skiljer sig åt mellan den allmänna befolkningen och RLS-patienter (enligt diskussion nedan). Enligt vårt sjukhus gränsvärde för järnbrist i den allmänna befolkningen (20 μg/L) fann vi att ingen av de manliga försökspersonerna i kontrollgruppen hade järnbrist, medan fyra kvinnliga kontrollpersoner uppvisade järnbrist (två försökspersoner med serumferritin <20 μg/L och två försökspersoner med ferritin ≥ 20 μg/L men TSAT <20 %). Det fanns ingen signifikant skillnad i prevalensen av järnbrist hos kontroller mellan män (0 %, 0/22) och kvinnor (9,8 %, 4/41; P = 0,288). De hematologiska testerna på hemoglobin och järnparametrar i kontrollgruppen var mest lika med NID RLS-gruppen jämfört med IDNA- eller IDA-gruppen (figur 1, tabell 3).
Diskussion
Patofysiologin för primär och sekundär RLS är ofullständigt förstådd. Järnbrist i hjärnan har en grundläggande roll i RLS-patogenesen, och tillstånd som kännetecknas av systemisk järnbrist, såsom anemi och graviditet, är förknippade med en högre prevalens av RLS-symtom (2, 3, 5, 6). IDA är en erkänd komorbiditet i samband med sekundär RLS (4-6, 12). IDNA är mer fördröjd och dess egenskaper är mindre kända hos RLS-patienter.
Kliniska drag av IDNA vid RLS
I allmänhet är kvinnor mer mottagliga för RLS (1, 13, 14). Kvinnor i barnafödande ålder har också mer järnbrist än män i den allmänna befolkningen (15). I den här studien om RLS-patienter utan anemi fann vi också en betydande könsberoende diskriminering. Kvinnliga RLS-patienter löper mycket högre risk för IDNA än manliga RLS-patienter (relativ risk på 5,51, p < 0,0001). Färre manliga RLS-patienter led av järnbrist, antingen med eller utan anemi. Hos kontrollerna fann vi, även om det inte var statistiskt signifikant, att 9,8 % av de kvinnliga personerna led av järnbrist medan ingen av de manliga personerna gjorde det. Järnbrist är ovanligt hos det manliga könet, så om manliga RLS-patienter har järnbrist bör ytterligare undersökningar göras för att utvärdera sekundära orsaker som kronisk blödning och undernäring på grund av gastrointestinala störningar.
Vid jämförelse med den ”normala” NID RLS-gruppen uppvisade IDNA RLS-gruppen en tidigare ålder för insjuknande i RLS och en yngre ålder vid intervju hos kvinnor, men inte hos män (tabell 2). I en tidigare studie fann vi att tidigt insjuknande i RLS visade mer positiv RLS-familjehistoria och mer allvarligt störda perifera järnparametrar (lägre serumferritin och högre serumtransferrin- och TIBC-värden) jämfört med sent insjuknande i RLS (8). Nyligen fann vi att IDNA i RLS förutsäger vissa genetiska faktorer jämfört med NID i RLS (opublicerade uppgifter). En potentiell subtyp i samband med genetisk bakgrund, järnbrist och tidigt begynnande RLS förtjänar ytterligare undersökningar. Trötthet, svaghet, koncentrationssvårigheter, nedsatt minne samt dålig arbetsprestation är ospecifika symtom som ofta förknippas med järnbrist (7, 16). Allen et al. (6) har tidigare rapporterat att IDA-patienter med RLS visade mer trötthet, sämre sömnkvalitet och minskad energi dagtid jämfört med IDA-patienter utan RLS. Vi fann att RLS-patienter med IDNA också var mer benägna att drabbas av manifestationer av svår/mycket svår trötthet eller sömnighet under dagen på grund av RLS jämfört med RLS-patienter med NID (brytpunkt vid 75 μg/L, 32,5 vs. 17,7 %, P < 0,05, tabell 2). När man återigen analyserade endast RLS-patienter utan medicinering visade RLS-patienterna med IDNA fortfarande en tendens till att vara mer mottagliga för svår/mycket svår trötthet eller sömnighet under dagen, även om de inte nådde statistisk signifikans (35 vs. 18,8 %, P = 0,078, kompletterande tabell 1). Ingen skillnad i fråga om svår/mycket svår trötthet eller sömnighet under dagen hittades mellan IDNA RLS och IDA RLS i den här studien (tabell 2). Utarmat järnlager, längs ett kontinuum från IDA till IDNA, är förknippat med minskad aktivitet av järnberoende enzymer, minskad cellulär oxidativ kapacitet samt minskad energieffektivitet (17-19). När vi använde en striktare definition för IDNA (serumferritin cut-off-värde satt till 50 μg/L) fann vi fortfarande att fler IDNA RLS-patienter med IDNA led av svår/mycket svår trötthet eller sömnighet under dagen jämfört med NID RLS-patienter (32,3 vs. 19,8 %), men detta var dock inte signifikant (P > 0,05; Kompletterande tabell 2). Periodisk benrörelse i sömnen (PLMS) är nära besläktat med RLS, och locus inom BTBD9-genen är korrelerat till risken för både PLMS och RLS (20, 21). Noterbart är att vi endast utvärderade sömnkvaliteten med hjälp av IRLSRS underpunkt 4, och vi utförde inte en detaljerad sömnstatusbedömning med hjälp av polysomnografimåttet (PSG). Följaktligen fanns det inga uppgifter om PLMS och andra sömnrelaterade parametrar, som i hög grad kan bidra till trötthet eller sömnighet under dagen. Sambandet mellan dagtrötthet/sömnighet och IDNA behöver därför undersökas ytterligare. Vi fann ingen signifikant skillnad i svårighetsgrad av RLS mellan IDNA- och NID-gruppen. Perifer järnbrist kommer att öka risken för RLS prevalens i tidigare kliniska studier (6). Minskade serumjärnkoncentrationer minskar globalt sett järnnivåerna i hjärnan, och järnbehandling gynnar RLS-patienter med låga nivåer av perifert järn (10). Trots detta uppvisar många RLS-patienter utan systemisk järnbrist ändå en hjärnspecifik brist på järn (22). Studier på gnagare rapporterade att serumjärnstatus inte var korrelerad med regionala järnnivåer i hjärnan, och kan därför vara begränsat relaterad till egenskaper hos RLS (23, 24).
Är IDNA ett tidigt stadium före IDA vid RLS?
Järnbrist kan klassificeras i två nivåer, IDNA och IDA, enligt hemoglobinmätningsvärdet. I den här studien hade RLS-patienter med IDA de lägsta hemoglobin-, ferritin- och järnnivåerna samt de högsta transferrin- och TIBC-värdena jämfört med IDNA RLS och NID RLS (figur 1, tabell 3). Även om det inte fanns några signifikanta skillnader i hemoglobinnivåer mellan IDNA RLS och NID RLS (både hos manliga och kvinnliga RLS-patienter), var serumhemoglobinet hos IDNA RLS-patienter lägre jämfört med kontrollerna (endast hos kvinnor, P < 0,05, figur 1, tabell 3). Dessutom låg värdena för järnparametrar i IDNA RLS-gruppen mellan värdena för NID RLS eller kontrollgruppen och IDA RLS-gruppen (figur 1, tabell 3). Dessa resultat överensstämmer med synpunkten att IDNA är en mildare järnbrist före utvecklingen av anemi. Noterbart är att serumjärnparametrar anses spegla den perifera järnstatusen främst i erythronerna (25), medan järnlagring i andra organ (såsom lever, hjärna etc.) behöver valideras hos IDNA-personerna.
När det gäller att orsaker och kännetecken för IDNA RLS och IDA RLS inte är helt likartade. I den här studien hade de flesta RLS-patienter med IDA anmärkningsvärda komorbiditeter i samband med undernäring eller kronisk överdriven blodförlust, inklusive matstrupsblödning, hemorrhoidblödning och menorragi (tabell 1), vilket är i linje med den tidigare studien (12). Det är värt att notera att menorrhagi är en vanlig orsak till IDA hos kvinnor i reproduktiv ålder, vilket kan vara efterföljande till livmoderfibroider, adenomyos och andra gynekologiska sjukdomar. Undernäring kan vara sekundär till gastrointestinala störningar, vegetarisk kost och missuppfattningar om den egna kroppsbilden hos unga kvinnor. Järnbrist hos majoriteten av IDA RLS-patienterna i denna studie är således ”absolut järnbrist”. Däremot saknar RLS-patienter med IDNA vanligtvis anmärkningsvärda komorbiditeter. Orsakerna till IDNA RLS är smygande och IDNA i RLS tillhör i allmänhet omfattningen av primär RLS (4) i samband med ”funktionell järnbrist”. Vi kan dock inte utesluta några smygande sekundära orsaker hos RLS-patienter med IDNA, vilket kan leda till otillräcklig tillförsel av järn i kroppen.
Vid jämförelse med RLS med IDNA hade patienter med IDA en högre ålder för RLS-debut samt kortare varaktighet av RLS hos både män och kvinnor (mer signifikant hos männen; tabell 2), vilket stämde överens med synsättet att sekundär RLS vanligen har en högre debutålder (26). Enligt vår erfarenhet uppvisar dessa IDA RLS-patienter med anmärkningsvärda orsaker (t.ex. akut blodförlust) vanligen kortare sjukdomsduration och snabbare återhämtning eller lindring när behandlingsbara komorbida sjukdomar korrigeras och järnstatus återställs. De kräver vanligtvis inte långvarig RLS-terapi, vilket skiljer sig något från primära RLS-patienter. Framtida longitudinella studier är nödvändiga för att bekräfta behandlingseffekterna av järntillskott hos RLS-patienter med IDA. Andra studier om komorbid RLS vid graviditet (27) och uremi (28) rapporterade förbättring efter förlossning och njurtransplantation, vilket tyder på att förändringar i associerade metaboliska faktorer kan utlösa RLS hos mottagliga personer (5).
Därmed finns det heterogenitet i både IDA RLS och IDNA RLS. Även om IDNA i allmänhet anses vara ett tidigt stadium före anemi (7), är IDNA RLS möjligen inte bara ett prodromalstadium före IDA RLS.
Accessing and Diagnosing IDNA in RLS
Och även om benmärgsbiopsi anses vara den bästa indikatorn för järnstatus, utförs den sällan på grund av potentiella risker för infektion eller blödning vid biopsiplatsen (29). De mest använda laboratorieindikatorerna för järnstatus är ferritin, som återspeglar antingen vävnadernas järndepåer eller tillräckligheten av järn som är lätt tillgängligt för erytropoesin (30). Även om serumferritin är en känslig markör för att utvärdera kroppens totala järnförråd kan andra tillstånd, t.ex. inflammatorisk status, ålder och njurfunktion, vara förväxlingsfaktorer som ökar serumferritinnivåerna (31). Ferritin och transferrin är också akutfasreaktanter, och ferritinnivåerna kan öka och transferrinnivåerna minska under ett inflammatoriskt tillstånd (32). Därför kan även serumferritin ≥ 75 μg/L och TSAT <20 % fortfarande ha faktisk järnbrist (11, 33).
En gränsvärde för serumferritinkoncentrationen på <30 μg/L är mest känslig och specifik för att identifiera potentiell järnbrist i den allmänna befolkningen (17, 18), och IDNA klassificeras som att man har normala hemoglobinnivåer med minskade serumferritinnivåer (<20 μg/L) (34, 35). Kliniska laboratorier fastställer vanligtvis den nedre gränsen för referensområdet för serumferritin till 10-20 μg/L i den allmänna befolkningen (36) (den nedre gränsen är fastställd till 20 μg/L på vårt sjukhus). Betydligt högre tröskelvärden för serumferritin används vanligen för att definiera järnbrist vid kroniska sjukdomar som hjärtsvikt och kronisk njursjukdom (7, 17). Bedömningskriterierna för att definiera järnbrist vid RLS skiljer sig också från dem hos friska kontroller, även om det exakta gränsvärdet för ferritin för att beteckna IDNA vid RLS ännu inte har nått konsensus. Nya studier tyder på att RLS-patienter bör betraktas som järnbrist när deras ferritinkoncentration är lägre än 75 μg/L (10, 11, 27). Tidigare studier fastställde dock oftast ferritinkoncentrationen under 50 μg/L som ”låg järnstatus” vid RLS (37, 38). Eftersom det inte finns några uppgifter om beskrivningar av olika gränsvärden, jämförde vi egenskaper hos IDNA RLS och NID RLS genom att använda både 75 och 50 μg/L som gränsvärden för ferritin för järnbrist. Vi fann att när vi använde 50 μg/L som den nedre brädgränsen för ferritin, uppfyllde 33,2 % (65/196) av RLS-patienterna kriterierna för IDNA. Resultaten var ganska lika för de två använda tröskelvärdena, förutom att ökad allvarlig/ mycket allvarlig trötthet eller sömnighet under dagen i IDNA RLS jämfört med NID RLS inte var signifikant när gränsvärdet för ferritin sattes till 50 μg/L (tabell 2, kompletterande tabell 2).
Vår studie hade vissa begränsningar: För det första var detta en tvärsnittsstudie och bristen på longitudinella data gjorde det svårt att identifiera utvecklingen av RLS-symtom och effekter av behandling. Dessutom kan det finnas en bias i samband med återkallande. För det andra var detta en studie på ett enda center eftersom ungefär en fjärdedel av patienterna var lokala invånare i Shanghai och majoriteten av patienterna kom från östra Kina. Med tanke på det stora territoriet i Kina och eventuella olika miljöfaktorer kan det finnas en selektionsbias. För det tredje utförde vi ingen PSG-mätning för att utvärdera detaljerad sömnstatus hos RLS-patienter och kontroller. För det fjärde stod ungefär en tredjedel av RLS-patienterna i den här studien på dopaminergika och/eller gabapentin enacarbil-behandling (endast en patient fick järntilläggsbehandling), vilket kan påverka de kliniska egenskaperna. Vi beräknade dock alla data på nytt hos RLS-patienter utan medicinering och drog samma slutsats. Med detta sagt har vår studie vissa fördelar. Vi studerade i detalj det kliniska spektrumet av RLS och uteslöt andra komorbiditeter eller RLS-mimik. Vi intervjuade varje patient ansikte mot ansikte, och vi uteslöt noggrant de atypiska RLS-patienterna under uppföljningen. Det har funnits begränsade studier om egenskaper hos IDNA vid RLS, vi utforskade detaljerade kliniska egenskaper hos IDNA hos konsekutiva kinesiska RLS-patienter.
Slutsats
IDNA är vanligt förekommande hos patienter med RLS, särskilt hos kvinnor, och har vissa speciella kliniska egenskaper. IDNA hade yngre ålder både vid intervju och vid RLS-debut jämfört med NID hos kvinnliga RLS-patienter. IDNA är inte särskilt vanligt hos manliga RLS-patienter och män med järnbrist bör utvärderas för komorbida sjukdomar. Egenskaper hos RLS-patienter med IDNA skiljer sig från RLS med IDA. RLS med IDNA utgör ett viktigt och förbisett folkhälsoproblem som förtjänar mer klinisk uppmärksamhet och bör tas upp i behandlingsstrategin. Regelbunden screening av perifera järnparametrar även hos patienter med normalt blodstatus rekommenderas för lämplig behandling i rätt tid.
Data Availability Statement
Datauppsättningarna som genererats för den här studien är tillgängliga på begäran till motsvarande författare.
Ethics Statement
Studierna som involverar mänskliga deltagare granskades och godkändes av Shanghai General Hospital Institutional Review Board. Patienterna/deltagarna gav sitt skriftliga informerade samtycke till att delta i denna studie.
Författarens bidrag
X-YZ utformning/design/genomförande av projektet/utformning av manuskriptet. T-TW: genomförande av projektet/insamling och tolkning av data/utformning av manuskriptet. H-MW och JS: laboratoriemätning. XL, L-YN, T-JC och M-YQ: genomförande av projektet/insamling och tolkning av data. TL och WO: kritisk granskning av manuskriptet med avseende på viktigt intellektuellt innehåll. Y-CW: utformning/design/övervakning av projektet, kritisk granskning av manuskriptet med avseende på viktigt intellektuellt innehåll. Alla författare: utarbetande av manuskriptet.
Finansiering
Detta arbete sponsrades av Shanghai Municipal Planning Commission of Science and Research Fund (201740017), Clinical Research Innovation Plan of Shanghai General Hospital (CTCCR-2018C02), Interdisciplinary Program of Shanghai Jiao Tong University (YG2015QN21), och National Natural Science Foundation of China (No. 81671251).
Intressekonflikt
Författarna förklarar att forskningen utfördes i avsaknad av kommersiella eller finansiella relationer som skulle kunna tolkas som en potentiell intressekonflikt.
Acknowledgments
Vi tackar alla patienter och friska kontrollpersoner som deltog i denna studie. Vi tackar personalen vid Physical Examination Center i Shanghai General Hospital. Vi tackar också Department of Bioinformatics and Biostatistics, School of Life Sciences and Biotechnology, Shanghai Jiao Tong University, Yue Zhang för statistisk konsultation.
Supplementary Material
Supplementary Material for this article can be found online at: https://www.frontiersin.org/articles/10.3389/fneur.2020.00298/full#supplementary-material
Abkortningar
CI, konfidensintervall; IRLSSG, International Restless Legs Study Group; MMSE, Mini-Mental State Examination; NID, utan järnbrist; RLS, restless legs syndrome; IDA, järnbristanemi; IDNA, järnbrist utan anemi; IRLSRS, International Restless Legs Syndrome Rating Scale; TIBC, total järnbindningskapacitet; TSAT, transferrinmättnad.
1. Allen RP, Picchietti DL, Garcia-Borreguero D, Ondo WG, Walters AS, Winkelman JW, et al. Restless legs syndrome/Willis-Ekbom disease diagnostic criteria: updated International Restless Legs Syndrome Study Group (RLSSG) consensus criteria-history, rationale, description, and significance. Sleep Med. (2014) 15:860-73. doi: 10.1016/j.sleep.2014.03.025
CrossRef Full Text | Google Scholar
2. Connor JR, Boyer PJ, Menzies SL, Dellinger B, Allen RP, Ondo WG, et al. Neuropatologisk undersökning tyder på nedsatt järnanskaffning i hjärnan vid restless legs syndrome. Neurologi. (2003) 61:304-9. doi: 10.1212/01.WNL.0000078887.16593.12
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Allen RP, Earley CJ. Järnets roll vid restless legs syndrome. Mov disord. (2007) 18(22 Suppl):S440-8. doi: 10.1002/mds.21607
CrossRef Full Text | Google Scholar
4. Trenkwalder C, Allen R, Hogl B, Clemens S, Patton S, Schormair B, et al. Komorbiditeter, behandling och patofysiologi vid restless legs syndrome. Lancet Neurol. (2018) 17:994-1005. doi: 10.1016/S1474-4422(18)30311-9
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Trenkwalder C, Allen R, Hogl B, Paulus W, Winkelmann J. Restless legs syndrome associated with major diseases: a systematic review and new concept. Neurology. (2016) 86:1336-43. doi: 10.1212/WNL.0000000000002542
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Allen RP, Auerbach S, Bahrain H, Auerbach M, Earley CJ. Prevalens och inverkan av restless legs syndrome på patienter med järnbristanemi. Am J Hematol. (2013) 88:261-4. doi: 10.1002/ajh.23397
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Soppi ET. Järnbrist utan anemi – en klinisk utmaning. Clin Case Rep. (2018) 6:1082-6. doi: 10.1002/ccr3.1529
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Zhu XY, Wu TT, Wang HM, Ni LY, Li X, Liu Y, et al. Kliniska särdrag och subtyper av restless legs syndrome i den kinesiska befolkningen: en studie av 359 patienter. Sleep Med. (2019) 59:15-23. doi: 10.1016/j.sleep.2019.01.053
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Walters AS, LeBrocq C, Dhar A, Hening W, Rosen R, Allen RP, et al. International Restless Legs Syndrome Study, Validation of the International Restless Legs Syndrome Study Group rating scale for restless legs syndrome. Sleep Med. (2003) 4:121-32. doi: 10.1016/S1389-9457(02)00258-7
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Allen RP, Picchietti DL, Auerbach M, Cho YW, Connor JR, Earley CJ, et al. International Restless Legs Syndrome Study, Evidence-based and consensus clinical practice guidelines for the iron treatment of restless legs syndrome/Willis-Ekbom disease in adults and children: an IRLSSG task force report. Sleep Med. (2018) 41:27-44. doi: 10.1016/j.sleep.2017.11.1126
CrossRef Full Text | Google Scholar
11. Trenkwalder C, Winkelmann J, Oertel W, Virgin G, Roubert B, Mezzacasa A, et al. Ferric carboxymaltose in patients with restless legs syndrome and nonanemic iron deficiency: a randomized trial. Mov Disord. (2017) 32:1478-82. doi: 10.1002/mds.27040
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Mehmood T, Auerbach M, Earley CJ, Allen RP. Svar på intravenöst järn hos patienter med järnbristanemi (IDA) och restless leg syndrome (Willis-Ekboms sjukdom). Sleep Med. (2014) 15:1473-6. doi: 10.1016/j.sleep.2014.08.012
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Thomas K, Watson CB. Restless legs syndrome hos kvinnor: en översikt. J Womens Health. (2008) 17:859-68. doi: 10.1089/jwh.2007.0515
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Ohayon MM, O’Hara R, Vitiello MV. Epidemiologi för restless legs syndrome: en sammanfattning av litteraturen. Sleep Med Rev. (2012) 16:283-95. doi: 10.1016/j.smrv.2011.05.002
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Umbreit J. Järnbrist: en kortfattad översikt. Am J Hematol. (2005) 78:225-31. doi: 10.1002/ajh.20249
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Sawada T, Konomi A, Yokoi K. Järnbrist utan anemi är förknippad med ilska och trötthet hos unga japanska kvinnor. Biol Trace Elem Res. (2014) 159:22-31. doi: 10.1007/s12011-014-9963-1
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Camaschella C. Järnbristanemi. N Engl J Med. (2015) 372:1832-43. doi: 10.1056/NEJMra1401038
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Lopez A, Cacoub P, Macdougall IC, Peyrin-Biroulet L. Järnbristanemi. Lancet. (2016) 387:907-16. doi: 10.1016/S0140-6736(15)60865-0
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Haas JD, Brownlie T. Iron deficiency reduced work capacity: a critical review of the research to determine a causal relationship. J Nutr. (2001) 131:676S-88S; discussion 688S-90S. doi: 10.1093/jn/131.2.676S
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Stefansson H, Rye DB, Hicks A, Petursson H, Ingason A, Thorgeirsson TE, et al. En genetisk riskfaktor för periodiska rörelser i sömnen. N Engl J Med. (2007) 357:639-47. doi: 10.1056/NEJMoa072743
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Li G, Tang H, Wang C, Qi X, Chen J, Chen S, et al. Samband mellan BTBD9 och MAP2K5/SKOR1 och restless legs syndrome i den kinesiska befolkningen. Sleep. (2017) 40:zsx028. doi: 10.1093/sleep/zsx028
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Earley CJ, Connor J, Garcia-Borreguero D, Jenner P, Winkelman J, Zee PC, et al. Altered brain iron homeostasis and dopaminergic function in Restless Legs Syndrome (Willis-Ekbom Disease). Sleep Med. (2014) 15:1288-301. doi: 10.1016/j.sleep.2014.05.009
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Erikson KM, Pinero DJ, Connor JR, Beard JL. Regionala koncentrationer av järn, ferritin och transferrin i hjärnan under järnbrist och järnåteruppfyllnad hos råttor under utveckling. J Nutr. (1997) 127:2030-8. doi: 10.1093/jn/127.10.2030
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Yin L, Unger EL, Jellen LC, Earley CJ, Allen RP, Tomaszewicz A, et al. Systemgenetisk analys av multivariat respons på järnbrist hos möss. Am J Physiol Regul Integr Comp Physiol. (2012) 302:R1282-96. doi: 10.1152/ajpregu.00634.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Hallberg L, Hulthen L. Perspektiv på järnabsorption. Blood Cells Mol Dis. (2002) 29:562-73. doi: 10.1006/bcmd.2002.0603
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Shukla G, Gupta A, Pandey RM, Kalaivani M, Goyal V, Srivastava A, et al. Vilka kännetecken skiljer unilateralt från bilateralt restless legs syndrome? En jämförande observationsstudie av 195 patienter. Sleep Med. (2014) 15:714-9. doi: 10.1016/j.sleep.2014.01.025
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Picchietti DL, Hensley JG, Bainbridge JL, Lee KA, Manconi M, McGregor JA, et al. International Restless Legs Syndrome Study, Consensus clinical practice guidelines for the diagnosis and treatment of restless legs syndrome/Willis-Ekbom disease during pregnancy and lactation. Sleep Med Rev. (2015) 22:64-77. doi: 10.1016/j.smrv.2014.10.009
CrossRef Full Text | Google Scholar
28. Winkelmann J, Stautner A, Samtleben W, Trenkwalder C. Långsiktigt förlopp av restless legs syndrome hos dialyspatienter efter njurtransplantation. Mov Disord. (2002) 17:1072-6. doi: 10.1002/mds.10231
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Bain BJ. Morbiditet vid benmärgsbiopsi: genomgång av 2003. J Clin Pathol. (2005) 58:406-8. doi: 10.1136/jcp.2004.022178
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Baynes RD. Bedömning av järnstatus. Clin Biochem. (1996) 29:209-15. doi: 10.1016/0009-9120(96)00010-K
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Wish JB. Bedömning av järnstatus: bortom serumferritin och transferrinmättnad. Clin J Am Soc Nephrol. (2006) 1(1 Suppl):S4-8. doi: 10.2215/CJN.01490506
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Tietz NW, Rinker AD, Morrison SR. När är ett serumjärn verkligen ett serumjärn? Status för mätningar av serumjärn. Clin Chem. (1994) 40:546-1. doi: 10.1093/clinchem/40.4.546
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Mackie S, Winkelman JW. Normalt ferritin hos en patient med järnbrist och RLS. J Clin Sleep Med. (2013) 9:511-3. doi: 10.5664/jcsm.2680
PubMed Abstract | CrossRef Full Text | Google Scholar
34. Leonard AJ, Chalmers KA, Collins CE, Patterson AJ. Jämförelse av två doser av elementärt järn vid behandling av latent järnbrist: effekt, biverkningar och blindningsmöjligheter. Nutrients. (2014) 6:1394-405. doi: 10.3390/nu6041394
PubMed Abstract | CrossRef Full Text | Google Scholar
35. D’Adamo CR, Novick JS, Feinberg TM, Dawson VJ, Miller LE. Ett livsmedelsbaserat kosttillskott som innehåller en låg dos av järn förbättrade markörer för järnstatus bland icke-anemiska kvinnor med järnbrist. J Am Coll Nutr. (2018) 37:342-9. doi: 10.1080/07315724.2018.1427158
PubMed Abstract | CrossRef Full Text | Google Scholar
36. Goodnough LT, Nemeth E, Ganz T. Detection, evaluation, and management of iron-restricted erythropoiesis. Blood. (2010) 116:4754-61. doi: 10.1182/blood-2010-05-286260
PubMed Abstract | CrossRef Full Text | Google Scholar
37. Lee CS, Lee SD, Kang SH, Park HY, Yoon IY. Jämförelse av effekten av oralt järn och pramipexol för behandling av patienter med restless legs syndrome med lågt serumferritin. Eur J Neurol. (2014) 21:260-6. doi: 10.1111/ene.12286
PubMed Abstract | CrossRef Full Text | Google Scholar
38. Tilma J, Tilma K, Norregaard O, Ostergaard JR. Restless legs syndrome i tidig barndom: symtom och effekt av oral järnbehandling. Acta Paediatr. (2013) 102:e221-6. doi: 10.1111/apa.12173
PubMed Abstract | CrossRef Full Text | Google Scholar