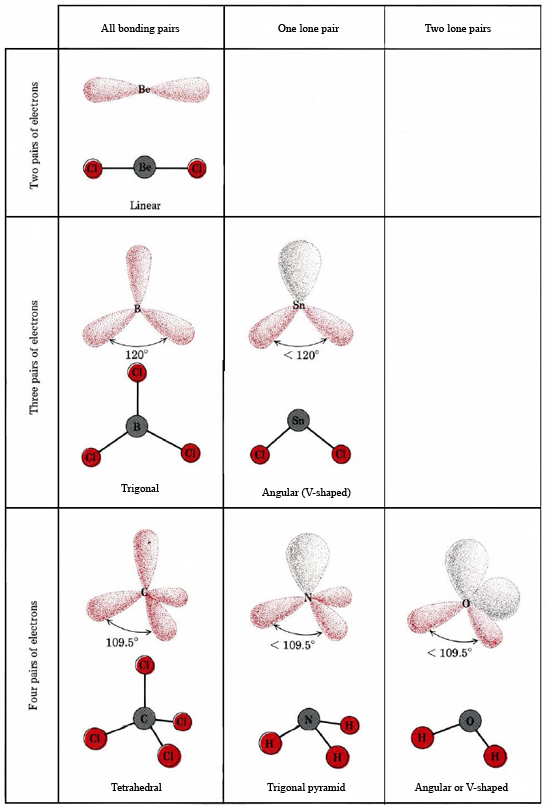
Teorie VSEPR dokáže vysvětlit a předpovědět tvary molekul, které obsahují osamělé páry. V takovém případě se předpokládá, že se osamělé páry stejně jako vazebné páry odpuzují a vzájemně se vyhýbají. Protože například v molekule SnCl2 jsou dvě vazby, lze očekávat, že bude lineární jako BeCl2. Pokud však nakreslíme Lewisův diagram, najdeme ve valenční slupce atomu Sn osamělý pár i dva vazebné páry:
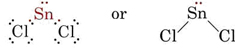_Chloride.jpg?revision=1&size=bestfit&width=235&height=48)
Osamělý pár ovlivňuje také strukturu amoniaku, NH3. Protože se tato molekula řídí pravidlem oktetu, je atom N obklopen čtyřmi elektronovými páry:
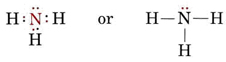
Pokud by všechny tyto páry byly rovnocenné, očekávali bychom, že úhel mezi nimi bude pravidelný tetraedrický úhel 109,5°. Experimentálně bylo zjištěno, že úhel je o něco menší, a to 107°. Opět je to proto, že osamělý pár je „tlustší“ než vazebné páry a může je k sobě přitisknout.
Elektronická struktura molekuly H2O je podobná struktuře NH3 s tím rozdílem, že jeden vazebný pár byl nahrazen osamělým párem:
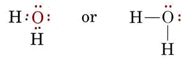
Příklad \(\PageIndex{1}\) : Molekulová geometrie
Nakreslete a popište geometrii následujících molekul: (a) GaCl3, (b) AsCl3 a (c) AsOCl3.
Řešení
a) Protože prvek gallium patří do III. skupiny, má tři valenční elektrony. Lewisův diagram pro GaCl3 je tedy
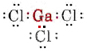
Protože kolem atomu Ga jsou tři vazebné páry a žádné osamělé páry, usuzujeme, že tři atomy Cl jsou uspořádány trigonálně a že všechny čtyři atomy jsou v jedné rovině.
b) Arsen patří do skupiny V, a proto má pět valenčních elektronů. Lewisova struktura pro AsCl3 je tedy
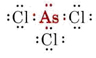
Protože je přítomen osamělý pár, tvar této molekuly je trigonální pyramida, přičemž jádro As je kousek nad rovnostranným trojúhelníkem jader Cl.
c) Lewisův diagram pro AsOCl3 je podobný jako pro AsCl3.

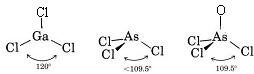
Teorii VSEPR lze aplikovat i na molekuly, které obsahují pět a šest valenčních párů elektronů, z nichž některé jsou osamělé. Takové druhy jsme zde nezahrnuli, protože většina sloučenin spadá do námi popsaných kategorií.
Přispěvatelé
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff a Adam Hahn.
.