La teoria VSEPR è in grado di spiegare e prevedere le forme delle molecole che contengono coppie solitarie. In tal caso si considera che le coppie solitarie e le coppie di legami si respingano e si evitino a vicenda. Per esempio, poiché ci sono due legami nella molecola SnCl2, ci si potrebbe aspettare che sia lineare come BeCl2. Se disegniamo il diagramma di Lewis, però, troviamo una coppia solitaria e due coppie di legami nel guscio di valenza dell’atomo di Sn:
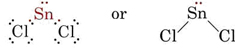_Chloride.jpg?revision=1&size=bestfit&width=235&height=48)
Una coppia solitaria influenza anche la struttura dell’ammoniaca, NH3. Poiché questa molecola obbedisce alla regola dell’ottetto, l’atomo N è circondato da quattro coppie di elettroni:
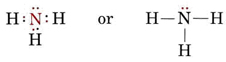
Se queste coppie fossero tutte equivalenti, ci aspetteremmo che l’angolo tra loro sia l’angolo tetraedrico regolare di 109,5°. Sperimentalmente, l’angolo si trova un po’ meno, cioè 107°. Ancora una volta questo è dovuto al fatto che la coppia solitaria è più “grassa” delle coppie di legame ed è in grado di stringerle più vicine tra loro.
La struttura elettronica della molecola H2O è simile a quella dell’NH3, tranne che una coppia di legame è stata sostituita da una coppia solitaria:
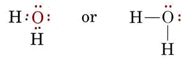
Esempio \(\PageIndex{1}}) : Geometria Molecolare
Scrivi e descrivi la geometria delle seguenti molecole: (a) GaCl3, (b) AsCl3, e (c) AsOCl3.
Soluzione
a) Poiché l’elemento gallio appartiene al gruppo III, ha tre elettroni di valenza. Il diagramma di Lewis per GaCl3 è così
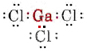
Siccome ci sono tre coppie di legame e nessuna coppia solitaria intorno all’atomo di Ga, concludiamo che i tre atomi di Cl sono disposti trigonalmente e che tutti e quattro gli atomi sono nello stesso piano.
b) L’arsenico appartiene al gruppo V e quindi ha cinque elettroni di valenza. La struttura di Lewis per AsCl3 è così
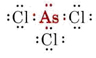
Siccome è presente una coppia solitaria, la forma di questa molecola è una piramide trigonale, con il nucleo As poco sopra un triangolo equilatero di nuclei Cl.
c) Il diagramma di Lewis per AsOCl3 è simile a quello di AsCl3.

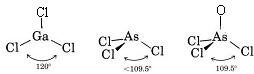
La teoria VSEPR può anche essere applicata a molecole che contengono cinque e sei coppie di elettroni di valenza, alcune delle quali sono coppie solitarie. Non abbiamo incluso tali specie qui perché la maggior parte dei composti rientrano nelle categorie che abbiamo descritto.
Contribuenti
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff e Adam Hahn.