Teoria VSEPR jest w stanie wyjaśnić i przewidzieć kształty cząsteczek, które zawierają samotne pary. W takim przypadku uważa się, że zarówno samotne pary, jak i pary wiążące odpychają się i unikają siebie nawzajem. Na przykład, ponieważ w cząsteczce SnCl2 występują dwa wiązania, można by oczekiwać, że będzie ona miała kształt liniowy, jak BeCl2. Jeśli jednak narysujemy diagram Lewisa, znajdziemy samotną parę, jak również dwie pary wiążące w powłoce walencyjnej atomu Sn:
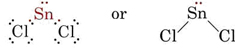_Chloride.jpg?revision=1&size=bestfit&width=235&height=48)
Samotna para wpływa również na strukturę amoniaku, NH3. Ponieważ cząsteczka ta spełnia zasadę oktetu, atom N jest otoczony przez cztery pary elektronowe:
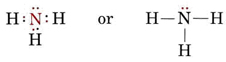
Gdyby wszystkie te pary były równoważne, oczekiwalibyśmy, że kąt między nimi będzie regularnym kątem tetraedrycznym 109,5°. Eksperymentalnie okazuje się, że kąt ten jest nieco mniejszy, a mianowicie 107°. Ponownie jest to spowodowane tym, że samotna para jest „grubsza” od par wiążących i jest w stanie ścisnąć je bliżej siebie.
Struktura elektronowa cząsteczki H2O jest podobna do struktury NH3 z wyjątkiem tego, że jedna para wiążąca została zastąpiona parą samotną:
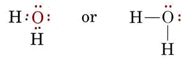
Przykład : Geometria molekularna
Zarysuj i opisz geometrię następujących cząsteczek: (a) GaCl3, (b) AsCl3, oraz (c) AsOCl3.
Rozwiązanie
a) Ponieważ pierwiastek gal należy do grupy III, posiada trzy elektrony walencyjne. Schemat Lewisa dla GaCl3 ma więc postać
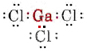
Ponieważ wokół atomu Ga znajdują się trzy pary wiążące i nie ma par samotnych, wnioskujemy, że trzy atomy Cl są ułożone trygonalnie, a wszystkie cztery atomy znajdują się w tej samej płaszczyźnie.
b) Arsen należy do grupy V i dlatego posiada pięć elektronów walencyjnych. Struktura Lewisa dla AsCl3 jest więc następująca
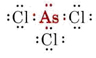
Ponieważ obecna jest samotna para, kształt tej cząsteczki jest piramidą trygonalną, z jądrem As znajdującym się nieco powyżej trójkąta równobocznego z jądrami Cl.
c) Schemat Lewisa dla AsOCl3 jest podobny do schematu Lewisa dla AsCl3.

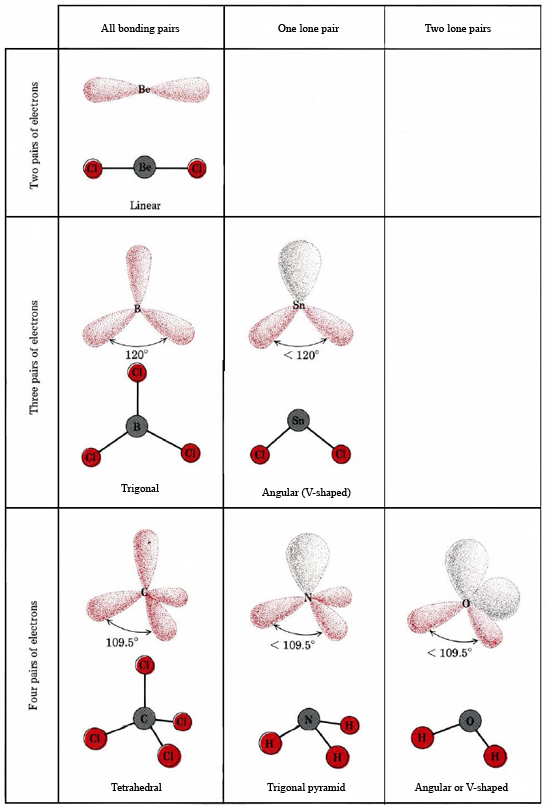
Teoria VSEPR może być również stosowana do cząsteczek, które zawierają pięć i sześć par elektronów walencyjnych, z których niektóre są parami samotnymi. Nie uwzględniliśmy tutaj takich gatunków, ponieważ większość związków należy do opisanych przez nas kategorii.
Wydawcy
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff, and Adam Hahn.
.