La teoría VSEPR es capaz de explicar y predecir las formas de las moléculas que contienen pares solitarios. En tal caso, se considera que los pares solitarios, así como los pares de enlace, se repelen y se evitan mutuamente. Por ejemplo, dado que hay dos enlaces en la molécula de SnCl2, cabría esperar que fuera lineal como BeCl2. Sin embargo, si dibujamos el diagrama de Lewis, encontramos un par solitario así como dos pares de enlace en la capa de valencia del átomo de Sn:
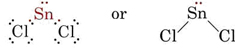_Chloride.jpg?revision=1&size=bestfit&width=235&height=48)
Un par solitario también afecta a la estructura del amoníaco, NH3. Como esta molécula obedece a la regla del octeto, el átomo de N está rodeado por cuatro pares de electrones:
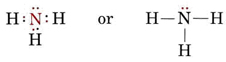
Si estos pares fueran todos equivalentes, esperaríamos que el ángulo entre ellos fuera el ángulo tetraédrico regular de 109,5°. Experimentalmente, el ángulo se encuentra a él algo menos, a saber, 107°. Una vez más, esto se debe a que el par solitario es más «gordo» que los pares de enlace y es capaz de apretarlos más juntos.
La estructura electrónica de la molécula de H2O es similar a la del NH3, excepto que un par de enlace ha sido sustituido por un par solitario:
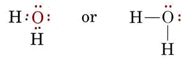
Ejemplo \(\PageIndex{1}\) : Geometría Molecular
Esquema y describe la geometría de las siguientes moléculas: (a) GaCl3, (b) AsCl3, y (c) AsOCl3.
Solución
a) Como el elemento galio pertenece al grupo III, tiene tres electrones de valencia. El diagrama de Lewis para el GaCl3 es así
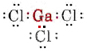
Como hay tres pares de enlace y ningún par solitario alrededor del átomo de Ga, concluimos que los tres átomos de Cl están dispuestos trigonalmente y que los cuatro átomos están en el mismo plano.
b) El arsénico pertenece al grupo V y por tanto tiene cinco electrones de valencia. La estructura de Lewis para el AsCl3 es así
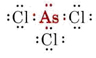
Como hay un par solitario, la forma de esta molécula es una pirámide trigonal, con el núcleo de As un poco por encima de un triángulo equilátero de núcleos de Cl.
c) El diagrama de Lewis para el AsOCl3 es similar al del AsCl3.

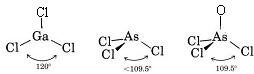
La teoría VSEPR también puede aplicarse a moléculas que contienen cinco y seis pares de electrones de valencia, algunos de los cuales son pares solitarios. No hemos incluido tales especies aquí porque la mayoría de los compuestos entran en las categorías que hemos descrito.
Contribuidores
-
Ed Vitz (Universidad de Kutztown), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (Universidad de Minnesota Rochester), Tim Wendorff y Adam Hahn.