Žlučové soli a žlučové kyseliny jsou polární deriváty cholesterolu a představují hlavní cestu jeho eliminace z těla.
Jedná se o molekuly s podobnou, nikoli však totožnou strukturou a různými fyzikálními a biologickými vlastnostmi.
Syntetizují se v játrech, ukládají se ve žlučníku, vylučují se do dvanáctníku a nakonec se z větší části reabsorbují v ileu.
Protože při fyziologickém pH jsou tyto molekuly přítomny jako anionty, termíny žlučové kyseliny a žlučové soli se zde používají jako synonyma.
Složení
- Chemická struktura žlučových solí
- Primární, konjugované a sekundární žlučové soli
- Funkce žlučových kyselin
- Enterohepatální oběh žlučových solí
- Střevní metabolismus žlučových kyselin
- Rozpustná vlákna a reabsorpce. žlučových solí
- Syntéza primárních žlučových kyselin
- Klasická neboli neutrální cesta
- Alternativní neboli kyselá cesta
- Minoritní cesty
- Žlučové soli: žlučových solí
- Chemická struktura žlučových solí
- Primární, konjugované a sekundární žlučové soli
- Funkce žlučových kyselin
- Enterohepatální cirkulace žlučových solí
- Střevní metabolismus žlučových kyselin
- Rozpustná vláknina a zpětné vstřebávání žlučových solí
- Syntéza primárních žlučových kyselin
- Klasická neboli neutrální cesta
- Alternativní neboli kyselá cesta
- Minoritní dráhy
- Žlučové soli: regulace syntézy
Chemická struktura žlučových solí
Žlučové soli mají podobnosti a rozdíly s molekulou cholesterolu.
Stejně jako steroidy mají jádro složené ze čtyř sloučených kruhů: tří cyklohexanových kruhů, označených A, B a C, a jednoho cyklopentanového kruhu, označeného D. Tato struktura je perhydrocyklopentanofenantren, známější jako steroidní jádro.
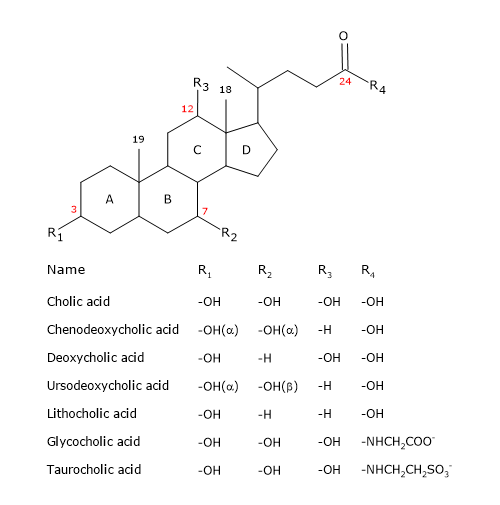
U vyšších obratlovců mají 24 atomů uhlíku, protože postranní řetězec je o tři uhlíky kratší než původní. U nižších obratlovců mají žlučové kyseliny 25, 26 nebo 27 atomů uhlíku. Postranní řetězec je zakončen karboxylovou skupinou, ionizovanou při pH 7, která může být navázána na aminokyselinu glycin nebo taurin (viz níže).
Kromě hydroxylové skupiny v poloze 3 mají hydroxylové skupiny v polohách 7 a/nebo 12.
Všechno toto je činí mnohem polárnějšími než cholesterol.
Protože jsou kruhy A a B sloučeny v konfiguraci cis, je planární struktura steroidního jádra zakřivená a je možné identifikovat:
- konkávní stranu, která je hydrofilní, protože hydroxylové skupiny a karboxylová skupina postranního řetězce s navázanou aminokyselinou nebo bez ní jsou orientovány směrem k ní;
- konvexní stranu, která je hydrofobní, protože methylové skupiny přítomné v poloze 18 a 19 jsou orientovány směrem k ní.
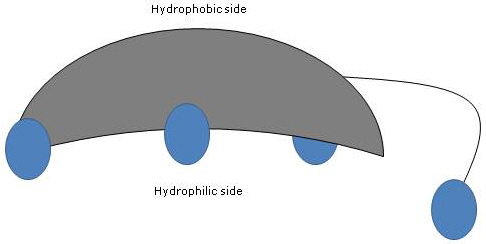
Protože mají polární i nepolární skupiny, jsou to amfifilní molekuly a vynikající povrchově aktivní látky. Jejich chemická struktura je však odlišuje od mnoha jiných povrchově aktivních látek, často se skládají z polární oblasti hlavy a nepolárního ocasu.
Primární, konjugované a sekundární žlučové soli
Primární žlučové kyseliny jsou kyseliny syntetizované přímo z cholesterolu v hepatocytech. U člověka jsou nejdůležitější kyselina cholová a kyselina chenodeoxycholová, které tvoří 80 % všech žlučových kyselin. Před vylučováním do žlučového stromu jsou téměř úplně konjugovány, až z 98 %, s glycinem nebo taurinem za vzniku glykokonjugátů, resp. taurokonjugátů. Zejména přibližně 75 % kyseliny cholové a chenodeoxycholové je konjugováno s glycinem za vzniku kyseliny glykocholové a glykochenodeoxycholové, zbývajících 25 % s taurinem za vzniku kyseliny taurocholové a taurochenodeoxycholové.
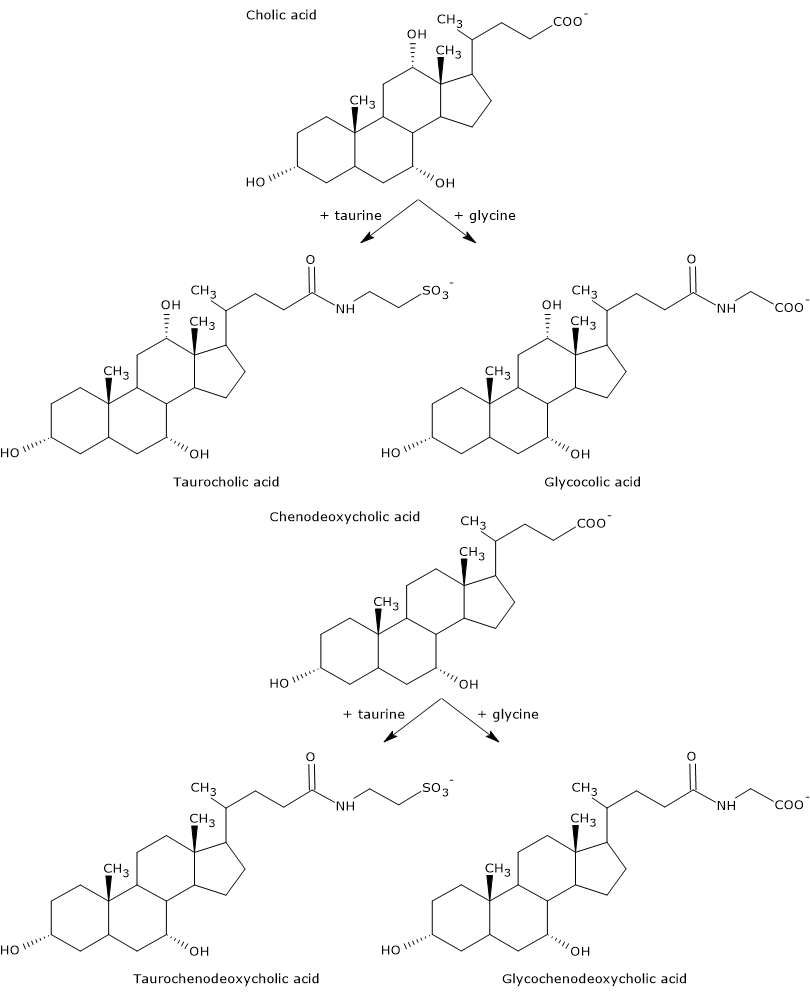
Konjugované žlučové kyseliny jsou molekuly s více hydrofilními skupinami než nekonjugované žlučové kyseliny, tedy se zvýšenou emulgační schopností. Konjugace totiž snižuje pKa žlučových kyselin, a to z přibližně 6, což je hodnota typická pro nekonjugované molekuly, na přibližně 4 u kyseliny glykocholové a přibližně 2 u kyseliny taurocholové. To způsobuje, že konjugované žlučové kyseliny jsou ionizovány v širším rozmezí pH za vzniku příslušných solí.
Hydrofilita běžných kyselin a žlučových solí klesá v následujícím pořadí: glycin-konjugovaná < taurin-konjugovaná < kyselina litocholová < kyselina deoxycholová < kyselina chenodeoxycholová < kyselina cholová < kyselinaursodeoxycholová.
Konjugace také snižuje cytotoxicitu primárních žlučových kyselin.
Sekundární žlučové kyseliny vznikají z primárních žlučových kyselin, které nebyly reabsorbovány z tenkého střeva. Jakmile se dostanou do tlustého střeva, mohou projít několika modifikacemi střevní mikrobiotou a vytvořit sekundární žlučové kyseliny (viz níže). Ty tvoří zbývajících 20 % rezervoáru žlučových kyselin v těle.
Jiný způsob kategorizace žlučových solí je založen na jejich konjugaci s glycinem a taurinem a na stupni jejich hydroxylace. Na tomto základě se rozlišují tři kategorie.
- Trihydroxykonjugáty, jako je kyselina taurocholová a kyselina glykocholová.
- Dihydroxykonjugáty, jako je kyselina glykodeoxycholová, kyselina glykochenodeoxycholová, kyselina taurochenodeoxycholová a kyselina taurodeoxycholová. Tvoří asi 60 % žlučových solí přítomných ve žluči.
- Nekonjugované formy, jako je kyselina cholová, kyselina deoxycholová, kyselina chenodeoxycholová a kyselina litocholová.
Funkce žlučových kyselin
Všechny své fyziologické funkce plní v konjugované formě.
- Jsou hlavní cestou pro vylučování cholesterolu z lidského těla.
Člověk totiž nemá enzymy, které by rozbíjely cyklohexanové kruhy nebo cyklopentanový kruh steroidního jádra, ani enzymy, které by oxidovaly cholesterol na CO2 a vodu.
Druhý mechanismus vylučování steroidů z těla je jako cholesterol jako takový ve žluči. - Žlučové soli jsou silné povrchově aktivní látky. A zejména di- a trihydroxykonjugáty jsou nejlepšími povrchově aktivními látkami mezi žlučovými kyselinami, mnohem účinnějšími než nekonjugované protějšky, protože mají více polárních skupin.
Po kontaktu s apolárními lipidy v lumen tenkého střeva interaguje konvexní apolární povrch s apolárními lipidy, jako jsou triglyceridy, estery cholesterolu a estery vitaminů rozpustných v tucích, zatímco konkávní polární povrch interaguje s okolním vodným prostředím. To zvyšuje disperzi apolárních lipidů ve vodném prostředí, protože umožňuje tvorbu drobných lipidových kapiček, čímž se zvětšuje povrch pro:
lipázovou aktivitu, především pankreatickou lipázu, (žlučové soli hrají také přímou roli při aktivaci tohoto enzymu);
aktivitu střevní esterázy.
Podle toho usnadňují vstřebávání produktů trávení lipidů a také vitaminů rozpustných v tucích střevní sliznicí díky tvorbě smíšených micel.
Žlučové kyseliny plní podobnou funkci ve žlučníku, kde tvorbou smíšených micel s fosfolipidy zabraňují vysrážení cholesterolu.
Poznámka: V důsledku uspořádání polárních a nepolárních skupin tvoří žlučové kyseliny ve vodném roztoku micely, které jsou obvykle tvořeny méně než 10 monomery, pokud je jejich koncentrace vyšší než tzv. kritická micelární koncentrace neboli CMC.
- Na střevní úrovni modulují sekreci pankreatických enzymů a cholecystokininu.
- V tenkém a tlustém střevě mají silnou antimikrobiální aktivitu, především kyselina deoxycholová, zejména proti grampozitivním bakteriím. Tato aktivita může být způsobena oxidačním poškozením DNA a/nebo poškozením buněčné membrány. Proto hrají důležitou roli v prevenci bakteriálního přerůstání, ale také v regulaci složení střevní mikrobioty.
- V posledních několika letech se ukazuje jejich regulační role v řízení energetického metabolismu, a to zejména pro manipulaci s glukózou v játrech.
Enterohepatální cirkulace žlučových solí
Po příjmu tuku vylučují enteroendokrinní buňky dvanáctníku do krevního oběhu cholecystokinin. Vazba hormonu na receptory na buňkách hladkého svalstva žlučníku podporuje jejich kontrakci; hormon také způsobuje relaxaci Oddiho svěrače. To vše má za následek sekreci žluči, a tedy i žlučových kyselin do dvanáctníku.
Za fyziologických podmínek je lidský pool žlučových solí konstantní a činí asi 3-5 g. To je umožněno dvěma procesy:
- jejich střevní reabsorpce;
- jejich de novo syntéza (viz níže).
Až 95 % vylučovaných žlučových solí se zpětně vstřebává ze střeva, a to nikoliv společně s produkty trávení lipidů, ale prostřednictvím procesu zvaného enterohepatální cirkulace.
Jde o mimořádně účinný recyklační systém, který zřejmě probíhá nejméně dvakrát u každého jídla a zahrnuje játra, žlučový strom, tenké střevo, tlusté střevo a portální cirkulaci, kterou se reabsorbované molekuly vracejí do jater. Tato recirkulace je nezbytná, protože schopnost jater syntetizovat žlučové kyseliny je omezená a nestačí k uspokojení střevních potřeb, pokud by se žlučové soli vylučovaly ve velkém množství stolicí.
Většina žlučových solí je reabsorbována do distálního ilea, dolní části tenkého střeva, pomocí transportéru závislého na sodíku v kartáčovém okraji enterocytů, tzv. sodium-dependentního transportéru žlučových kyselin neboli ASBT, který uskutečňuje kotransport molekuly žlučové kyseliny a dvou sodíkových iontů.
Předpokládá se, že uvnitř enterocytu jsou žlučové kyseliny transportovány přes cytosol k bazolaterální membráně pomocí proteinu vázajícího ileální žlučové kyseliny neboli IBABP. Přes bazolaterální membránu se dostávají pomocí transportéru organických solutů alfa-beta neboli OSTα/OSTβ, přecházejí do portálního oběhu a navázané na albumin se dostávají do jater.
Je třeba poznamenat, že malé procento žlučových kyselin se do jater dostává jaterní tepnou.
Na úrovni jater je jejich extrakce velmi účinná, přičemž frakce extrakce při prvním průchodu se pohybuje od 50 do 90 %, přičemž toto procento závisí na struktuře žlučových kyselin. Vychytávání konjugovaných žlučových kyselin je zprostředkováno především aktivním transportním systémem závislým na Na+, tj. na sodíku závislým taurocholátovým kotransportním polypeptidem neboli NTCP. Může však docházet i k vychytávání nezávislému na sodíku, které je prováděno proteiny z rodiny polypeptidů transportujících organické anionty neboli OATP, především OATP1B1 a OATP1B3.
Rychlost limitujícím krokem v enterohepatálním oběhu je jejich kanálová sekrece, z velké části zprostředkovaná exportní pumpou žlučových solí neboli BSEP, v procesu závislém na ATP. Tato pumpa přenáší monoaniontové žlučové soli, které jsou nejhojnější. Žlučové kyseliny konjugované s kyselinou glukuronovou nebo sulfátem, které jsou dianiontové, jsou transportovány různými přenašeči, jako jsou MRP2 a BCRP.
Poznámka: Sérové hladiny žlučových kyselin se mění na základě rychlosti jejich reabsorpce, a proto jsou vyšší během jídla, kdy je enterohepatální oběh aktivnější.
Střevní metabolismus žlučových kyselin
Žlučové kyseliny, které uniknou ileální absorpci, přecházejí do tlustého střeva, kde částečně podléhají modifikaci střevní mikrobiotou a jsou přeměněny na sekundární žlučové kyseliny.
Hlavní reakce jsou uvedeny níže.
- Dekonjugace
Na postranním řetězci může dojít k hydrolýze N-acyl amidové vazby C24 s uvolněním nekonjugovaných žlučových kyselin a glycinu nebo taurinu. Tuto reakci katalyzují bakteriální hydrolasy přítomné jak v tenkém střevě, tak v tlustém střevě. - 7α-dehydroxylace
Kvantitativně se jedná o nejdůležitější reakci, kterou provádějí dehydratasy bakterií tlustého střeva, které odstraňují hydroxylovou skupinu v poloze 7 za vzniku 7-deoxy žlučových kyselin. Konkrétně z kyseliny cholové vzniká kyselina deoxycholová a z kyseliny chenodeoxycholové kyselina litocholová, toxická sekundární žlučová kyselina.
Je třeba poznamenat, že 7α-dehydroxylace, na rozdíl od oxidace a epimerizace (viz níže), může probíhat pouze u nekonjugovaných žlučových kyselin, a proto je dekonjugace nezbytným předpokladem. - Oxidace a epimerizace
Jsou reakce zahrnující hydroxylové skupiny v polohách 3, 7 a 12, katalyzované bakteriálními hydroxysteroiddehydrogenázami. Například kyselina ursodeoxycholová vzniká epimerizací kyseliny chenodeoxycholové.
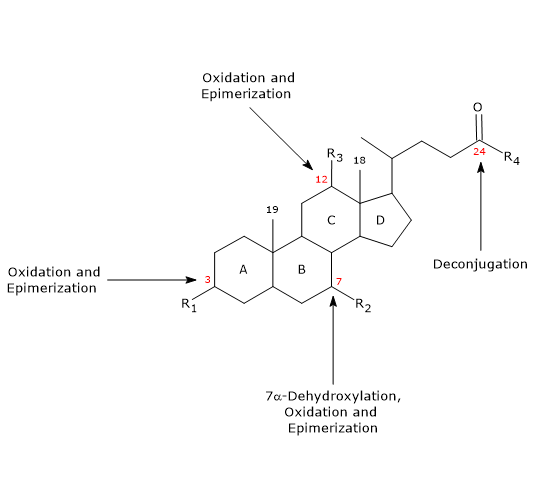
Některé ze sekundárních žlučových kyselin se pak reabsorbují z tlustého střeva a vracejí se do jater. V hepatocytech jsou v případě potřeby rekonjugovány a znovu vylučovány. Zatímco oxidaci a dekonjugaci provádí široké spektrum anaerobních bakterií, 7α-dehydroxylaci provádí omezený počet anaerobů tlustého střeva.
7α-dehydroxylace a dekonjugace zvyšují pKa žlučových kyselin, a tedy jejich hydrofobicitu, což umožňuje určitý stupeň pasivní absorpce přes stěnu tlustého střeva.
Zvýšení hydrofobicity je také spojeno se zvýšenou toxicitou těchto molekul. A vysoká koncentrace sekundárních žlučových kyselin ve žluči, krvi a stolici je spojována s patogenezí rakoviny tlustého střeva.
Rozpustná vláknina a zpětné vstřebávání žlučových solí
Zpětné vstřebávání žlučových solí může být sníženo chelatačním působením rozpustných vláknin, které se nacházejí například v čerstvém ovoci, luštěninách, ovsu a ovesných otrubách, které je vážou a snižují jejich vstřebávání. To následně zvyšuje syntézu žlučových kyselin de novo, zvyšuje expresi 7α-hydroxylázy a sterol 12α-hydroxylázy (viz níže), a tím snižuje koncentraci cholesterolu v hepatocytech.
Deplece jaterního cholesterolu zvyšuje expresi LDL receptoru, a tím snižuje plazmatickou koncentraci LDL cholesterolu. Na druhé straně také stimuluje syntézu HMG-CoA reduktázy, klíčového enzymu v biosyntéze cholesterolu.
Poznámka: Některé anticholesterolové léky působí tak, že vážou žlučové kyseliny ve střevě, čímž zabraňují jejich reabsorpci.
Syntéza primárních žlučových kyselin
Kvantitativně jsou žlučové kyseliny hlavním produktem metabolismu cholesterolu.
Jak již bylo řečeno, enterohepatální cirkulace a jejich de novo syntéza udržují konstantní velikost poolu žlučových kyselin. Syntéza de novo umožňuje zejména náhradu žlučových solí vyloučených v obličeji, a to asi 5-10 % tělesného poolu, konkrétně ~ 0,5 g/den.
Níže je popsána syntéza kyseliny cholové a chenodeoxycholové a jejich konjugace s aminokyselinami taurinem a glycinem.
Existují dvě hlavní cesty syntézy žlučových kyselin: klasická cesta a alternativní cesta. Kromě toho budou popsány i některé další vedlejší cesty.
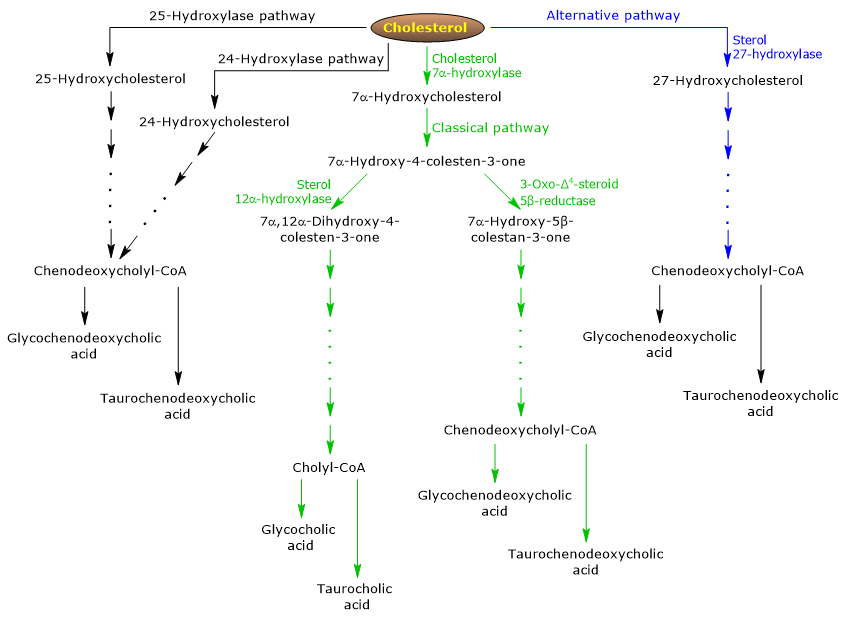
Klasická neboli neutrální cesta
U člověka vzniká až 90 % žlučových solí klasickou cestou (viz obr. 5), označovanou také jako „neutrální“, protože meziprodukty jsou neutrální molekuly.
Jedná se o metabolickou dráhu přítomnou pouze v játrech, která se skládá z reakcí katalyzovaných enzymy lokalizovanými v cytosolu, endoplazmatickém retikulu, peroxizomech a mitochondriích a jejímiž konečnými produkty jsou konjugáty kyseliny cholové a chenodeoxycholové.
- První reakcí je hydroxylace v poloze 7 cholesterolu za vzniku 7α-hydroxycholesterolu. Reakci katalyzuje 7α-hydroxyláza cholesterolu neboli CYP7A1 (E.C. 1.14.14.23). Je to enzym lokalizovaný v endoplazmatickém retikulu a katalyzuje rychlost limitující krok této dráhy.
Cholesterol + NADPH + H+ + O2 → 7α-Hydroxycholesterol + NADP+ + H2O
- 7α-Hydroxycholesterol podléhá oxidaci 3β-hydroxylové skupiny a posunu dvojné vazby z polohy 5,6 do polohy 4,5 za vzniku 7α-hydroxy-4-cholesten-3-onu. Reakci katalyzuje 3β-hydroxy-Δ5-C27-steroid oxidoreduktasa neboli HSD3B7 (E.C. 1.1.1.181), enzym lokalizovaný v endoplazmatickém retikulu.
- 7α-hydroxy-4-cholesten-3-on může vstupovat dvěma cestami:
do dráhy, která vede k syntéze kyseliny cholové, prostřednictvím reakce katalyzované 7α-hydroxy-4-cholesten-3-on 12α-monooxygenázou neboli sterol 12α-hydroxylázou neboli CYP8B1 (E.C. 1.14.18.8), enzym lokalizovaný v endoplazmatickém retikulu;
pro vstup do dráhy vedoucí k syntéze kyseliny chenodeoxycholové prostřednictvím reakce katalyzované 3-oxo-Δ4-steroid 5β-reduktázou neboli AKR1D1 (E.C. 1.3.1.3), cytosolického enzymu.
Je třeba zdůraznit, že aktivita sterol 12α-hydroxylázy určuje poměr kyseliny cholové a chenodeoxycholové a v konečném důsledku detergentní kapacitu poolu žlučových kyselin. A ve skutečnosti je regulace transkripce genu sterol 12α-hydroxylázy jedním z hlavních regulačních kroků klasické dráhy.
Pokud tedy 7α-hydroxy-4-cholesten-3-on probíhá prostřednictvím reakce katalyzované sterol 12α-hydroxylázou, dojde k následujícím reakcím.
- 7α-hydroxy-4-cholesten-3-on je hydroxylován v poloze 12 sterol 12α-hydroxylasou za vzniku 7α,12α-dihydroxy-4-cholesten-3-onu.
- 7α,12α-Dihydroxy-4-cholesten-3-on podléhá redukci dvojné vazby v poloze 4,5 v reakci katalyzované 3-oxo-Δ4-steroid 5β-reduktasou za vzniku 5β-cholestan-7α,12α-diol-3-onu.
- 5β-cholestan-7α,12α-diol-3-on podléhá redukci hydroxylové skupiny v poloze 4 v reakci katalyzované 3α-hydroxysteroiddehydrogenázou neboli AKR1C4 (EC 1.1.1.213), cytosolického enzymu, za vzniku 5β-cholestan-3α,7α,12α-triolu.
- 5β-cholestan-3α,7α,12α-triol podléhá oxidaci postranního řetězce prostřednictvím tří reakcí katalyzovaných sterol 27-hydroxylasou neboli CYP27A1 (EC 1.14.15.15). Jedná se o mitochondriální enzym přítomný také v extrahepatálních tkáních a makrofázích, který zavádí hydroxylovou skupinu v poloze 27. Hydroxylová skupina se oxiduje na aldehyd a poté na karboxylovou kyselinu za vzniku 3α,7α,12α-trihydroxy-5β-cholestanové kyseliny.
- 3α,7α,12α-trihydroxy-5β-cholestanoová kyselina je aktivována na svůj koenzymový ester A, 3α,7α,12α-trihydroxy-5β-cholestanoyl-CoA, v reakci katalyzované buď acyl-CoA syntetázou s velmi dlouhým řetězcem, nebo VLCS (EC 6.2.1.-) nebo syntetázou žlučových kyselin CoA neboli BACS (EC 6.2.1.7), obě lokalizované v endoplazmatickém retikulu.
- 3α,7α,12α-trihydroxy-5β-cholestanoyl-CoA je transportován do peroxisomů, kde prochází pěti po sobě následujícími reakcemi, z nichž každou katalyzuje jiný enzym. V posledních dvou reakcích se postranní řetězec zkracuje na čtyři atomy uhlíku a nakonec vzniká cholylCoA.
- V posledním kroku dochází ke konjugaci, prostřednictvím amidové vazby, skupiny karboxylové kyseliny postranního řetězce s aminokyselinou glycinem nebo taurinem. Reakci katalyzuje N-acyltransferáza žlučové kyseliny-CoA:aminokyseliny neboli BAAT (EC 2.3.1.65), která je převážně lokalizována v peroxisomech.
Reakčními produkty jsou tedy konjugované žlučové kyseliny: kyselina glykocholová a kyselina taurocholová.
Pokud 7α-hydroxy-4-cholesten-3-on neprobíhá reakcí katalyzovanou sterol 12α-hydroxylázou, vstupuje do dráhy, která vede k syntéze konjugátů kyseliny chenodeoxycholové, prostřednictvím reakcí popsaných níže.
- 7α-hydroxy-4-cholesten-3-on se přeměňuje na 7α-hydroxy-5β-cholestan-3-on v reakci katalyzované 3-oxo-Δ4-steroid 5β-reduktázou.
- 7α-hydroxy-5β-cholestan-3-on se přeměňuje na 5β-cholestan-3α,7α-diol v reakci katalyzované 3α-hydroxysteroid dehydrogenázou.
Poté vznikají konjugované žlučové kyseliny kyselina glykochenodeoxycholová a kyselina taurochenodeoxycholová podobnými modifikacemi jako při konjugaci kyseliny cholové a jsou katalyzovány většinou stejnými enzymy.
Poznámka: Nekonjugované žlučové kyseliny vzniklé ve střevě se musí dostat do jater, kde se znovu konjugují.
Alternativní neboli kyselá cesta
Převažuje u plodu a novorozenců, zatímco u dospělých vede k syntéze méně než 10 % žlučových solí.
Tato cesta (viz obr. 1) vede k syntéze žlučových kyselin. 5) se od klasické dráhy liší tím, že:
- meziprodukty jsou kyselé molekuly, z čehož vznikl alternativní název „kyselá dráha“;
- po oxidaci postranního řetězce následuje modifikace steroidního jádra, a nikoli naopak;
- konečnými produkty jsou konjugáty kyseliny chenodeoxycholové.
První krok zahrnuje přeměnu cholesterolu na 27-hydroxycholesterol v reakci katalyzované sterol 27-hydroxylázou.
27-hydroxycholesterol může jít dvěma cestami.
Cesta A
- 27-hydroxycholesterol se přeměňuje na kyselinu 3β-hydroxy-5-cholestenovou v reakci katalyzované sterol 27-hydroxylasou.
- 3β-hydroxy-5-cholestenová kyselina je hydroxylována v poloze 7 v reakci katalyzované oxysterol 7α-hydroxylázou neboli CYP7B1 (EC 1.14.13.100), enzymem lokalizovaným v endoplazmatickém retikulu, za vzniku 3β-7α-dihydroxy-5-cholestenové kyseliny.
- 3β-7α-dihydroxy-5-cholestenová kyselina se v reakci katalyzované 3β-hydroxy-Δ5-C27-steroid oxidoreduktasou přeměňuje na 3-oxo-7α-hydroxy-4-cholestenovou kyselinu.
- 3-Oxo-7α-hydroxy-4-cholestenová kyselina v důsledku modifikace postranního řetězce tvoří kyselinu chenodeoxycholovou a poté její konjugáty.
Cesta B
- 27-Hydroxycholesterol se přeměňuje na 7α,27-dihydroxycholesterol v reakci katalyzované oxysterol 7α-hydroxylasou a cholesterol 7α-hydroxylasou.
- 7α,27-dihydroxycholesterol se přeměňuje na 7α,26-dihydroxy-4-cholesten-3-on v reakci katalyzované 3β-hydroxy-Δ5-C27-steroid oxidoreduktasou;
7α,26-dihydroxy-4-cholesten-3-on se může přeměnit přímo na konjugáty kyseliny chenodeoxycholové nebo se může přeměnit na kyselinu 3-oxo-7α-hydroxy-4-kolestenovou a poté projít modifikací postranního řetězce a dalšími reakcemi, které vedou k syntéze konjugátů kyseliny chenodeoxycholové.
Minoritní dráhy
Existují také minoritní dráhy (viz obr. 5), které přispívají k syntéze žlučových solí, i když v menší míře než klasické a alternativní dráhy.
Například:
- Cholesterol 25-hydroxyláza (EC 1.14.99.38) je exprimována v játrech.
- A cholesterol 24-hydroxyláza neboli CYP46A1 (EC 1.14.14.25) je exprimována v mozku, a proto, i když tento orgán nemůže exportovat cholesterol, exportuje oxysteroly.
- Byla také objevena nespecifická 7α-hydroxyláza. Je exprimována ve všech tkáních a zřejmě se podílí na tvorbě oxysterolů, které mohou být transportovány do hepatocytů, kde se přemění na kyselinu chenodeoxycholovou.
Dále je v různých tkáních exprimována sterol 27-hydroxyláza, a proto musí být její reakční produkty transportovány do jater, kde se přemění na žlučové soli.
Žlučové soli: regulace syntézy
Regulace syntézy žlučových kyselin probíhá prostřednictvím mechanismu negativní zpětné vazby, zejména na expresi cholesterol 7α-hydroxylázy a sterol 12α-hydroxylázy.
Při nadbytku žlučových kyselin, volných i konjugovaných, se tyto molekuly vážou na jaderný receptor farnesoid X receptor neboli FRX a aktivují jej: nejúčinnější žlučovou kyselinou je kyselina chenodeoxycholová, zatímco ostatní, jako např. kyselina ursodeoxycholová, jej neaktivují.
FRX indukuje expresi transkripčního represoru small heterodimer partner neboli SHP, který následně interaguje s dalšími transkripčními faktory, jako je liver receptor homolog-1 neboli LRH-1 a hepatocytární jaderný faktor-4α neboli HNF-4α. Tyto transkripční faktory se vážou na sekvenci v promotorové oblasti genů 7α-hydroxylázy a 12α-hydroxylázy, oblasti nazývané prvky odpovědi na žlučové kyseliny neboli BARE, a inhibují jejich transkripci.
Jedním z důvodů, proč je syntéza žlučových solí přísně regulována, je skutečnost, že mnoho jejich metabolitů je toxických.
Chiang J.Y.L. Bile acids: regulation of synthesis. J Lipid Res 2009;50(10):1955-66. doi:10.1194/jlr.R900010-JLR200
Gropper S.S., Smith J.L. Advanced nutrition and human metabolism. Vydání 6h. Cengage Learning, 2012
Moghimipour E., Ameri A., and Handali S. Absorption-enhancing effects of bile salts. Molecules 2015;20(8); 14451-73. doi:10.3390/molecules200814451
Monte M.J., Marin J.J.G., Antelo A., Vazquez-Tato J. Bile acids: Chemistry, physiology, and pathophysiology. World J Gastroenterol 2009;15(7):804-16. doi:10.3748/wjg.15.804
Rawn J.D. Biochimica. Mc Graw-Hill, Neil Patterson Publishers, 1990
Rosenthal M.D., Glew R.H. Medical biochemistry – Human metabolism in health and disease. John Wiley J. & Sons, Inc, Publication, 2009
Sundaram S.S., Bove K.E., Lovell M.A. a Sokol R.J. Mechanisms of Disease: inborn errors of bile acid synthesis. Nat Clin Pract Gastroenterol Hepatol 2008;5(8):456-68. doi:10.1038/ncpgasthep1179
.