I sali biliari e gli acidi biliari sono derivati polari del colesterolo, e rappresentano la principale via di eliminazione dello steroide dall’organismo.
Sono molecole con strutture simili ma non identiche, e diverse caratteristiche fisiche e biologiche.
Sono sintetizzati nel fegato, immagazzinati nella cistifellea, secreti nel duodeno e infine, per la maggior parte, riassorbiti nell’ileo.
Perché a pH fisiologico queste molecole sono presenti come anioni, i termini acido biliare e sali biliari sono usati qui come sinonimi.
CONTENUTI
- Struttura chimica dei sali biliari
- Sali biliari primari, coniugati e secondari
- Funzione degli acidi biliari
- Circolazione enteroepatica dei sali biliari
- Metabolismo intestinale degli acidi biliari
- Fibre solubili e riassorbimento dei sali biliari
- Sintesi degli acidi biliari primari
- La via classica o neutra
- La via alternativa o acida
- Percorsi minori
- Sali biliari: regolazione della sintesi
- Struttura chimica dei sali biliari
- Sali biliari primari, coniugati e secondari
- Funzione degli acidi biliari
- Circolazione enteroepatica dei sali biliari
- Metabolismo intestinale degli acidi biliari
- Fibre solubili e riassorbimento dei sali biliari
- Sintesi degli acidi biliari primari
- La via classica o neutra
- La via alternativa o acida
- Percorsi minori
- Sali biliari: regolazione della sintesi
Struttura chimica dei sali biliari
I sali biliari hanno somiglianze e differenze con la molecola del colesterolo.
Come gli steroidi, hanno un nucleo composto da quattro anelli fusi: tre anelli cicloesani, etichettati A, B e C, e un anello ciclopentano, etichettato D. Questa struttura è il peridrociclopentanofenantrene, più comunemente conosciuto come nucleo steroideo.
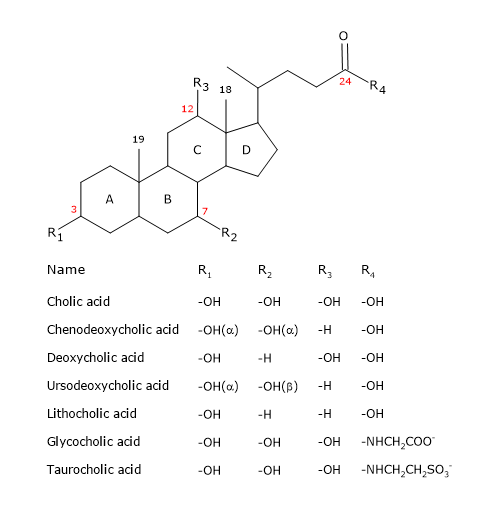
Nei vertebrati superiori, hanno 24 atomi di carbonio, poiché la catena laterale è tre carboni più corta dell’originale. Nei vertebrati inferiori, gli acidi biliari hanno 25, 26 o 27 atomi di carbonio. La catena laterale termina con un gruppo carbossilico, ionizzato a pH 7, che può essere legato all’aminoacido glicina o taurina (vedi sotto).
Oltre al gruppo idrossilico in posizione 3, hanno gruppi idrossilici in posizione 7 e/o 12.
Tutto questo li rende molto più polari del colesterolo.
Siccome gli anelli A e B sono fusi in configurazione cis, la struttura planare del nucleo dello steroide è curva, ed è possibile identificare:
- un lato concavo, che è idrofilo perché i gruppi idrossilici e il gruppo carbossilico della catena laterale, con o senza l’aminoacido collegato, sono orientati verso di esso;
- un lato convesso, che è idrofobico perché i gruppi metilici presenti in posizione 18 e 19 sono orientati verso di esso.
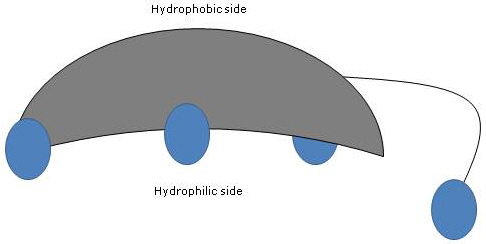
Quindi, avendo sia gruppi polari che non polari, sono molecole anfifile ed eccellenti tensioattivi. Tuttavia, la loro struttura chimica li rende diversi da molti altri tensioattivi, spesso composti da una regione di testa polare e una coda non polare.
Sali biliari primari, coniugati e secondari
Gli acidi biliari primari sono quelli sintetizzati direttamente dal colesterolo negli epatociti. Nell’uomo, i più importanti sono l’acido colico e l’acido chenodeossicolico, che costituiscono l’80% di tutti gli acidi biliari. Prima di essere secreti nell’albero biliare, sono quasi completamente coniugati, fino al 98%, con la glicina o la taurina, per formare rispettivamente glicoconiugati e tauroconiugati. In particolare, circa il 75% dell’acido colico e dell’acido chenodeossicolico sono coniugati con la glicina, per formare acido glicocolico e acido glicocenodeossicolico, il restante 25% con la taurina, per formare acido taurocolico e taurochenodeossicolico.
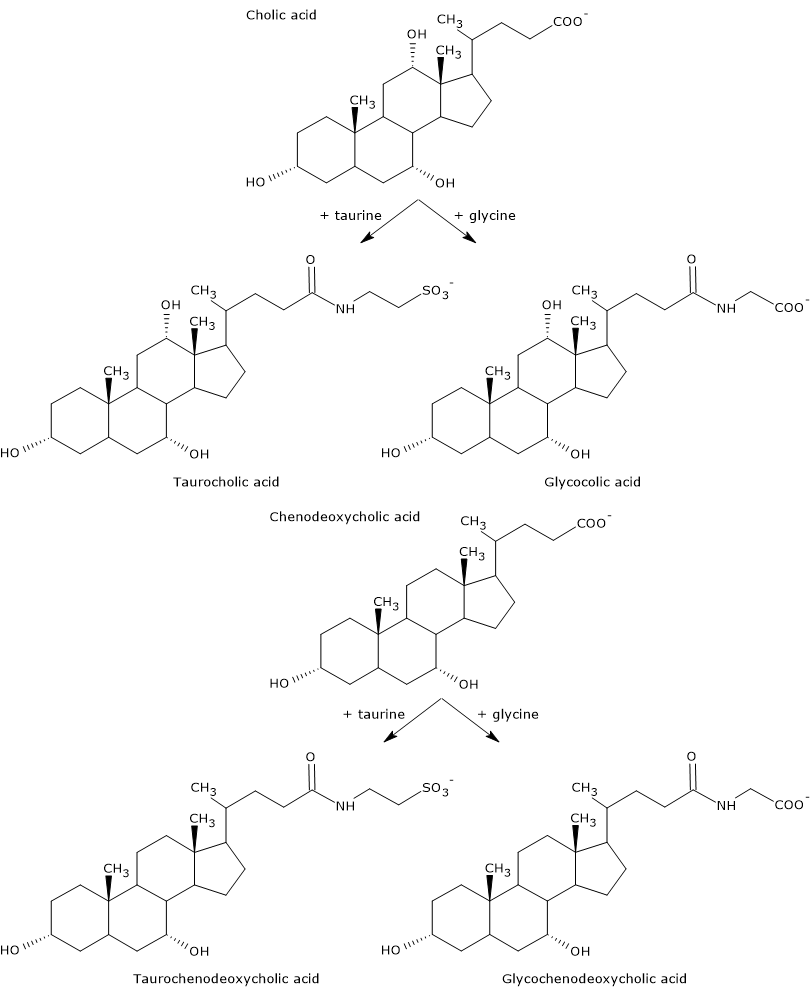
Gli acidi biliari coniugati sono molecole con più gruppi idrofili degli acidi biliari non coniugati, quindi con una maggiore capacità emulsionante. Infatti, la coniugazione diminuisce il pKa degli acidi biliari, da circa 6, valore tipico delle molecole non coniugate, a circa 4 per l’acido glicocolico, e circa 2 per l’acido taurocolico. Questo fa sì che gli acidi biliari coniugati siano ionizzati in un intervallo di pH più ampio per formare i sali corrispondenti.
L’idrofilia degli acidi comuni e dei sali biliari diminuisce nel seguente ordine: glicina coniugata < taurina coniugata < acido litocholico < acido desossicolico < acido chenodeossicolico < acido colico < acido urodesossicolico.
Infine, la coniugazione diminuisce anche la citotossicità degli acidi biliari primari.
Gli acidi biliari secondari sono formati da acidi biliari primari che non sono stati riassorbiti dall’intestino tenue. Una volta raggiunto il colon, possono subire diverse modifiche da parte del microbiota intestinale per formare acidi biliari secondari (vedi sotto). Costituiscono il restante 20% del pool di acidi biliari del corpo.
Un altro modo di classificare i sali biliari è basato sulla loro coniugazione con glicina e taurina e sul loro grado di idrossilazione. Su questa base, vengono identificate tre categorie.
- Coniugati triidrossi, come l’acido taurocolico e l’acido glicocolico.
- Coniugati diidrossi, come l’acido glicodossicolico, l’acido glicocenodeossicolico, l’acido taurochenodeossicolico e l’acido taurodeossicolico. Essi rappresentano circa il 60% dei sali biliari presenti nella bile.
- Forme non coniugate, come l’acido colico, l’acido desossicolico, l’acido chenodeossicolico e l’acido litocholico.
Funzione degli acidi biliari
Tutte le loro funzioni fisiologiche sono svolte nella forma coniugata.
- Sono la via principale per l’eliminazione del colesterolo dal corpo umano.
Infatti, gli esseri umani non hanno gli enzimi per rompere gli anelli cicloesani o l’anello ciclopentano del nucleo dello steroide, né per ossidare il colesterolo a CO2 e acqua.
L’altro meccanismo per eliminare lo steroide dal corpo è come colesterolo in sé nella bile. - I sali della bile sono forti tensioattivi. E in particolare, di- e triidrossi coniugati sono i migliori tensioattivi tra gli acidi biliari, molto più efficaci delle controparti non coniugate, poiché hanno più gruppi polari.
Una volta in contatto con i lipidi apolari nel lume dell’intestino tenue, la superficie apolare convessa interagisce con i lipidi apolari, come trigliceridi, esteri di colesterolo ed esteri di vitamine liposolubili, mentre la superficie polare concava interagisce con il mezzo acquoso circostante. Questo aumenta la dispersione dei lipidi apolari nel mezzo acquoso, in quanto permette la formazione di minuscole goccioline lipidiche, aumentando la superficie per:
l’attività della lipasi, principalmente la lipasi pancreatica, (i sali biliari hanno anche un ruolo diretto nell’attivazione di questo enzima);
l’attività dell’esterasi intestinale.
Di conseguenza, facilitano l’assorbimento dei prodotti della digestione dei lipidi, così come delle vitamine liposolubili da parte della mucosa intestinale grazie alla formazione di micelle miste.
Gli acidi biliari svolgono una funzione simile nella cistifellea dove, formando micelle miste con fosfolipidi, impediscono la precipitazione del colesterolo.
Nota: Come conseguenza della disposizione dei gruppi polari e non polari, gli acidi biliari formano micelle in soluzione acquosa, di solito composte da meno di 10 monomeri, purché la loro concentrazione sia superiore alla cosiddetta concentrazione micellare critica o CMC.
- A livello intestinale, modulano la secrezione degli enzimi pancreatici e della colecistochinina.
- Nell’intestino tenue e crasso, hanno una potente attività antimicrobica, soprattutto l’acido desossicolico, in particolare contro i batteri Gram-positivi. Questa attività può essere dovuta al danno ossidativo del DNA e/o al danno della membrana cellulare. Pertanto, giocano un ruolo importante nella prevenzione della crescita eccessiva dei batteri, ma anche nella regolazione della composizione del microbiota intestinale.
- Negli ultimi anni, diventa evidente il loro ruolo regolatore nel controllo del metabolismo energetico, e in particolare per la gestione del glucosio epatico.
Circolazione enteroepatica dei sali biliari
Dopo l’assunzione di grassi, le cellule enteroendocrine del duodeno secernono colecistochinina nel flusso sanguigno. L’ormone che si lega ai recettori delle cellule muscolari lisce della cistifellea promuove la loro contrazione; l’ormone causa anche il rilassamento dello sfintere di Oddi. Tutto questo si traduce nella secrezione della bile, e quindi degli acidi biliari nel duodeno.
In condizioni fisiologiche, il pool di sali biliari umani è costante, e pari a circa 3-5 g. Questo è reso possibile da due processi:
- il loro riassorbimento intestinale;
- la loro sintesi de novo (vedi sotto).
Fino al 95% dei sali biliari secreti viene riassorbito dall’intestino, non insieme ai prodotti della digestione lipidica, ma attraverso un processo chiamato circolazione enteroepatica.
È un sistema di riciclo estremamente efficiente, che sembra avvenire almeno due volte per ogni pasto, e comprende il fegato, l’albero biliare, l’intestino tenue, il colon, e la circolazione portale attraverso cui le molecole riassorbite ritornano al fegato. Tale ricircolo è necessario poiché la capacità del fegato di sintetizzare gli acidi biliari è limitata e insufficiente a soddisfare i bisogni intestinali se i sali biliari fossero escreti nelle feci in quantità elevate.
La maggior parte dei sali biliari sono riassorbiti nell’ileo distale, la parte inferiore dell’intestino tenue, da un trasportatore sodio-dipendente all’interno del bordo a spazzola degli enterociti, chiamato trasportatore sodio-dipendente degli acidi biliari o ASBT, che effettua il cotrasporto di una molecola di acido bile e due ioni di sodio.
Nell’enterocita, si pensa che gli acidi biliari siano trasportati attraverso il citosol alla membrana basolaterale dalla proteina ileale legante gli acidi biliari o IBABP. Attraversano la membrana basolaterale tramite il trasportatore di soluti organici alfa-beta o OSTα/OSTβ, passano nella circolazione portale e, legati all’albumina, raggiungono il fegato.
Si noti che una piccola percentuale di acidi biliari raggiunge il fegato attraverso l’arteria epatica.
A livello epatico, la loro estrazione è molto efficiente, con una frazione di primo passaggio che va dal 50 al 90%, una percentuale che dipende dalla struttura dell’acido biliare. L’assorbimento degli acidi biliari coniugati è principalmente mediato da un sistema di trasporto attivo Na+-dipendente, cioè il polipeptide cotrasportatore di taurocholato sodio-dipendente o NTCP. Tuttavia, può verificarsi anche un assorbimento indipendente dal sodio, effettuato da proteine della famiglia dei polipeptidi trasportatori di anioni organici o OATP, principalmente OATP1B1 e OATP1B3.
Il passo limitante nella circolazione enteroepatica è la loro secrezione canalicolare, in gran parte mediata dalla pompa di esportazione dei sali biliari o BSEP, in un processo ATP-dipendente. Questa pompa trasporta i sali biliari monoanionici, che sono i più abbondanti. Gli acidi biliari coniugati con acido glucuronico o solfato, che sono dianionici, sono trasportati da diversi trasportatori, come MRP2 e BCRP.
Nota: I livelli sierici di acidi biliari variano in base alla velocità del loro riassorbimento, e quindi sono più alti durante i pasti, quando la circolazione enteroepatica è più attiva.
Metabolismo intestinale degli acidi biliari
Gli acidi biliari che sfuggono all’assorbimento ileale passano nel colon dove subiscono in parte modifiche da parte del microbiota intestinale e vengono convertiti in acidi biliari secondari.
Le reazioni principali sono elencate di seguito.
- Deconiugazione
Sulla catena laterale può avvenire l’idrolisi del legame ammidico N-acile C24, con rilascio di acidi biliari non coniugati e glicina o taurina. Questa reazione è catalizzata da idrolasi batteriche presenti sia nell’intestino tenue che nel colon. - 7α-Deidrossilazione
Quantitativamente, è la reazione più importante, effettuata dalle deidratasi batteriche del colon che rimuovono il gruppo ossidrile in posizione 7 per formare acidi biliari 7-deossi. In particolare, l’acido desossicolico si forma dall’acido colico, e l’acido litocolico, un acido biliare secondario tossico, dall’acido chenodeossicolico.
Si noti che la 7α-deidrossilazione, a differenza dell’ossidazione e dell’epimerizzazione (vedi sotto), può avvenire solo su acidi biliari non coniugati, e quindi la deconiugazione è un prerequisito essenziale. - Ossidazione ed epimerizzazione
Sono reazioni che coinvolgono i gruppi ossidrilici nelle posizioni 3, 7 e 12, catalizzate dalle idrossisteroidi deidrogenasi batteriche. Per esempio, l’acido ursodeossicolico deriva dall’epimerizzazione dell’acido chenodeossicolico.
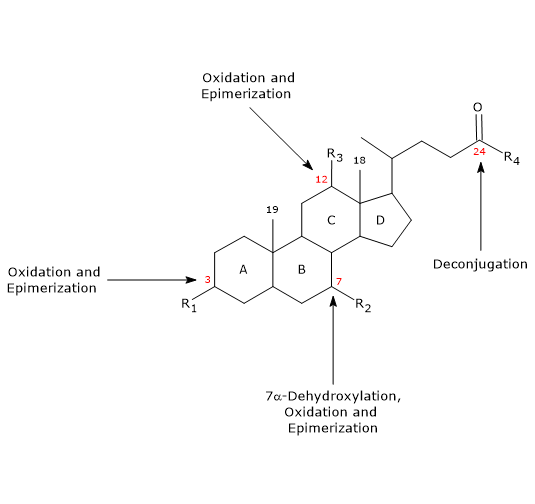
Alcuni degli acidi biliari secondari sono poi riassorbiti dal colon e ritornano al fegato. Negli epatociti, vengono ricongiunti, se necessario, e risecretati. Quelli che non vengono riassorbiti, vengono escreti nelle feci.
Mentre le ossidazioni e le deconiugazioni sono effettuate da un ampio spettro di batteri anaerobi, la 7α-deidrossilazione è effettuata da un numero limitato di anaerobi del colon.
Le 7α-deidrossilazioni e deconiugazioni aumentano il pKa degli acidi biliari, e quindi la loro idrofobicità, permettendo un certo grado di assorbimento passivo attraverso la parete del colon.
L’aumento dell’idrofobicità è anche associato a una maggiore tossicità di queste molecole. E un’alta concentrazione di acidi biliari secondari nella bile, nel sangue e nelle feci è stata associata alla patogenesi del cancro al colon.
Fibre solubili e riassorbimento dei sali biliari
Il riassorbimento dei sali biliari può essere ridotto dall’azione chelante delle fibre solubili, come quelle presenti in frutta fresca, legumi, avena e crusca di avena, che li legano, diminuendo il loro assorbimento. A sua volta, questo aumenta la sintesi de novo degli acidi biliari, up-regolando l’espressione della 7α-idrossilasi e della 12α-idrossilasi degli steroli (vedi sotto), e quindi riduce la concentrazione di colesterolo negli epatociti.
La deplezione del colesterolo epatico aumenta l’espressione del recettore LDL, e quindi riduce la concentrazione plasmatica del colesterolo LDL. D’altra parte, stimola anche la sintesi della HMG-CoA reduttasi, l’enzima chiave nella biosintesi del colesterolo.
Nota: Alcuni farmaci anti-colesterolo agiscono legando gli acidi biliari nell’intestino, impedendone così il riassorbimento.
Sintesi degli acidi biliari primari
Quantitativamente, gli acidi biliari sono il principale prodotto del metabolismo del colesterolo.
Come già detto, la circolazione enteroepatica e la loro sintesi de novo mantengono costante la dimensione del pool di acidi biliari. In particolare, la sintesi de novo permette la sostituzione dei sali biliari escreti nei volti, circa il 5-10% del pool corporeo, cioè ~ 0,5 g/giorno.
Di seguito, viene descritta la sintesi dell’acido colico e dell’acido chenodeossicolico, e la loro coniugazione con gli aminoacidi taurina e glicina.
Ci sono due vie principali per la sintesi degli acidi biliari: la via classica e la via alternativa. Inoltre, saranno descritte alcune altre vie minori.
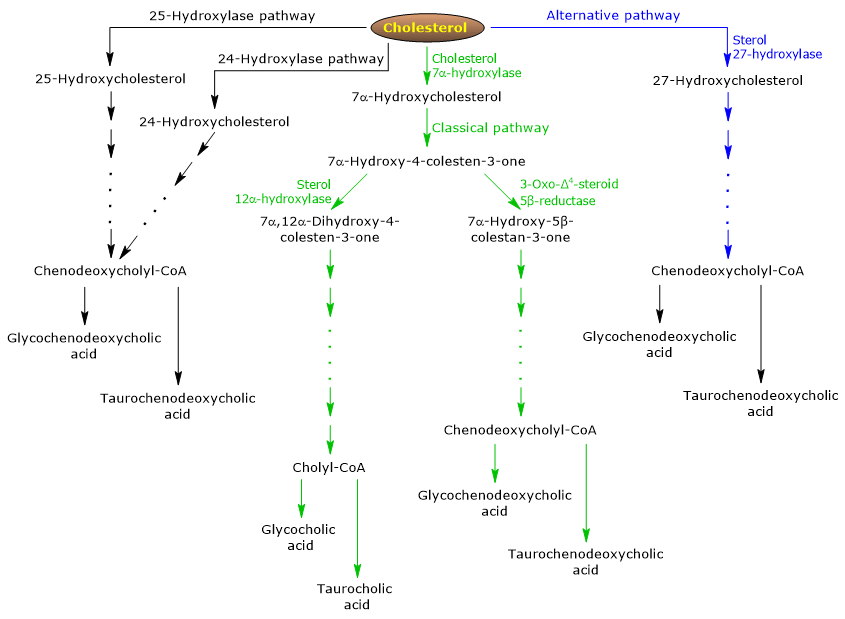
La via classica o neutra
Negli esseri umani, fino al 90% dei sali biliari sono prodotti attraverso la via classica (vedi fig. 5), chiamata anche via “neutra” poiché gli intermedi sono molecole neutre.
È una via metabolica presente solo nel fegato, che consiste in reazioni catalizzate da enzimi localizzati nel citosol, nel reticolo endoplasmatico, nei perossisomi e nei mitocondri, e i cui prodotti finali sono i coniugati dell’acido colico e dell’acido chenodeossicolico.
- La prima reazione è l’idrossilazione in posizione 7 del colesterolo, per formare 7α-idrossicolesterolo. La reazione è catalizzata dalla colesterolo 7α-idrossilasi o CYP7A1 (E.C. 1.14.14.23). È un enzima localizzato nel reticolo endoplasmatico, e catalizza il passo limitante della via.
Colesterolo + NADPH + H+ + O2 → 7α-idrossicolesterolo + NADP+ + H2O
- 7α-idrossicolesterolo subisce l’ossidazione del gruppo 3β-idrossile e lo spostamento del doppio legame dalla posizione 5,6 alla posizione 4,5, per formare 7α-idrossi-4-colestene-3-one. La reazione è catalizzata dalla 3β-idrossi-Δ5-C27-steroide ossidoreduttasi o HSD3B7 (E.C. 1.1.1.181), un enzima localizzato nel reticolo endoplasmatico.
- 7α-idrossi-4-colesten-3-one può seguire due vie:
entrare nella via che porta alla sintesi dell’acido colico, attraverso la reazione catalizzata dalla 7α-idrossi-4-colesten-3-one 12α-monoossigenasi o sterolo 12α-idrossilasi o CYP8B1 (E.C. 1.14.18.8), un enzima localizzato nel reticolo endoplasmatico;
per entrare nella via che porta alla sintesi dell’acido chenodeossicolico, attraverso la reazione catalizzata dalla 3-oxo-Δ4-steroide 5β-reduttasi o AKR1D1 (E.C. 1.3.1.3), un enzima citosolico.
Si deve sottolineare che l’attività della sterolo 12α-idrossilasi determina il rapporto tra acido colico e acido chenodeossicolico e, in definitiva, la capacità detergente del pool di acidi biliari. E infatti, la regolazione della trascrizione del gene della sterolo 12α-idrossilasi è una delle principali fasi di regolazione della via classica.
Pertanto, se il 7α-idrossi-4-colesten-3-one procede attraverso la reazione catalizzata dalla sterolo 12α-idrossilasi, si verificheranno le seguenti reazioni.
- 7α-idrossi-4-colesten-3-one viene idrossilato in posizione 12 dalla sterol 12α-idrossilasi, per formare 7α,12α-diidrossi-4-colesten-3-one.
- 7α,12α-diidrossi-4-colesten-3-one subisce la riduzione del doppio legame in posizione 4,5, nella reazione catalizzata dalla 3-oxo-Δ4-steroide 5β-reduttasi, per formare 5β-colestan-7α,12α-diol-3-one.
- 5β-Colestan-7α,12α-diol-3-one subisce la riduzione del gruppo idrossile in posizione 4, nella reazione catalizzata dalla 3α-idrossisteroide deidrogenasi o AKR1C4 (EC 1.1.1.213), un enzima citosolico, per formare 5β-colestan-3α,7α,12α-triolo.
- 5β-Colestan-3α,7α,12α-triolo subisce l’ossidazione della catena laterale attraverso tre reazioni catalizzate dalla sterolo 27-idrossilasi o CYP27A1 (EC 1.14.15.15). Si tratta di un enzima mitocondriale presente anche nei tessuti extraepatici e nei macrofagi, che introduce un gruppo idrossile in posizione 27. Il gruppo ossidrilico viene ossidato ad aldeide, e poi ad acido carbossilico, per formare acido 3α,7α,12α-triidrossi-5β-colestanoico.
- L’acido 3α,7α,12α-Triidrossi-5β-colestanoico viene attivato al suo estere coenzima A, 3α,7α,12α-triidrossi-5β-colestanoil-CoA, nella reazione catalizzata da un’acil-CoA sintetasi a catena molto lunga o VLCS (EC 6.2.1.-), o dalla CoA sintetasi degli acidi biliari o BACS (EC 6.2.1.7), entrambe localizzate nel reticolo endoplasmatico.
- 3α,7α,12α-Triidrossi-5β-colestanoil-CoA viene trasportato ai perossisomi dove subisce cinque reazioni successive, ciascuna catalizzata da un enzima diverso. Nelle ultime due reazioni, la catena laterale viene accorciata a quattro atomi di carbonio, e infine si forma il colilCoA.
- Nell’ultima fase, avviene la coniugazione, tramite legame ammidico, del gruppo acido carbossilico della catena laterale con l’amminoacido glicina o taurina. La reazione è catalizzata dall’acido biliare-CoA:aminoacido N-aciltransferasi o BAAT (EC 2.3.1.65), che è prevalentemente localizzato nei perossisomi.
I prodotti della reazione sono quindi gli acidi biliari coniugati: acido glicocolico e acido taurocolico.
Se il 7α-idrossi-4-colesten-3-one non procede attraverso la reazione catalizzata dalla sterolo 12α-idrossilasi, entra nella via che porta alla sintesi dei coniugati dell’acido chenodeossicolico, attraverso le reazioni descritte di seguito.
- 7α-Idrossi-4-colesten-3-one viene convertito in 7α-idrossi-5β-colestan-3-one nella reazione catalizzata dalla 3-oxo-Δ4-steroide 5β-reduttasi.
- 7α-idrossi-5β-colestan-3-one viene convertito in 5β-colestan-3α,7α-diolo nella reazione catalizzata dalla 3α-idrosteroide deidrogenasi.
Poi, gli acidi biliari coniugati acido glicocenodeossicolico e acido taurochenodeossicolico sono formati da modifiche simili a quelle viste per la coniugazione dell’acido colico, e catalizzati per lo più dagli stessi enzimi.
Nota: Gli acidi biliari non coniugati formati nell’intestino devono raggiungere il fegato per essere ricongiunti.
La via alternativa o acida
È prevalente nel feto e nel neonato, mentre negli adulti porta alla sintesi di meno del 10% dei sali biliari.
Questa via (vedi fig. 5) differisce dalla via classica in quanto:
- i prodotti intermedi sono molecole acide, da cui il nome alternativo “via acida”;
- l’ossidazione della catena laterale è seguita da modificazioni del nucleo steroideo, e non viceversa;
- i prodotti finali sono coniugati dell’acido chenodeossicolico.
Il primo passo comporta la conversione del colesterolo in 27-idrossicolesterolo nella reazione catalizzata dalla sterolo 27-idrossilasi.
Il 27-idrossicolesterolo può seguire due vie.
via A
- Il 27-idrossicolesterolo viene convertito in acido 3β-idrossi-5-colestenoico in una reazione catalizzata dalla sterolo 27-idrossilasi.
- L’acido 3β-idrossi-5-colestenoico viene idrossilato in posizione 7 nella reazione catalizzata dall’ossisterolo 7α-idrossilasi o CYP7B1 (EC 1.14.13.100), un enzima localizzato nel reticolo endoplasmatico, per formare acido 3β-7α-diidrossi-5-colestenoico.
- L’acido 3β-7α-diidrossi-5-colestenoico viene convertito in acido 3-oxo-7α-idrossi-4-colestenoico, nella reazione catalizzata dalla 3β-idrossi-Δ5-C27-steroide ossidoreduttasi.
- L’acido 3-Oxo-7α-idrossi-4-colestenoico, in seguito a modifiche della catena laterale, forma acido chenodeossicolico, e poi i suoi coniugati.
Corso B
- 27-Idrossicolesterolo viene convertito in 7α,27-diidrossicolesterolo nella reazione catalizzata da ossisterolo 7α-idrossilasi e colesterolo 7α-idrossilasi.
- Il 7α,27-diidrossicolesterolo viene convertito in 7α,26-diidrossi-4-colesten-3-one nella reazione catalizzata dalla 3β-idrossi-Δ5-C27-steroide ossidoreduttasi;
7α, 26-diidrossi-4-colesten-3-one può essere trasformato direttamente in coniugati dell’acido chenodeossicolico, o può essere convertito in acido 3-oxo-7α-idrossi-4-colestenoico, e poi subire modifiche della catena laterale e altre reazioni che portano alla sintesi dei coniugati dell’acido chenodeossicolico.
Percorsi minori
Ci sono anche percorsi minori (vedi fig. 5) che contribuiscono alla sintesi dei sali biliari, anche se in misura minore rispetto ai percorsi classici e alternativi.
Per esempio:
- Un colesterolo 25-idrossilasi (EC 1.14.99.38) è espressa nel fegato.
- Una colesterolo 24-idrossilasi o CYP46A1 (EC 1.14.14.25) è espressa nel cervello, e quindi, sebbene l’organo non possa esportare colesterolo, esporta ossisteroli.
- È stata anche scoperta una 7α-idrossilasi non specifica. È espressa in tutti i tessuti e sembra essere coinvolta nella generazione di ossisteroli, che possono essere trasportati agli epatociti per essere convertiti in acido chenodeossicolico.
Inoltre, la sterolo 27-idrossilasi è espressa in vari tessuti, e quindi i suoi prodotti di reazione devono essere trasportati al fegato per essere convertiti in sali biliari.
Sali biliari: regolazione della sintesi
La regolazione della sintesi degli acidi biliari avviene attraverso un meccanismo di feedback negativo, in particolare sull’espressione del colesterolo 7α-idrossilasi e della sterolo 12α-idrossilasi.
Quando si verifica un eccesso di acidi biliari, sia liberi che coniugati, queste molecole si legano al recettore nucleare recettore X farnesoide o FRX, attivandolo: l’acido bile più efficace è l’acido chenodeossicolico, mentre altri, come l’acido ursodeossicolico, non lo attivano.
FRX induce l’espressione del repressore trascrizionale small heterodimer partner o SHP, che a sua volta interagisce con altri fattori di trascrizione, come liver receptor homolog-1 o LRH-1, e hepatocyte nuclear factor-4α o HNF-4α. Questi fattori di trascrizione si legano a una sequenza nella regione promotrice dei geni 7α-idrossilasi e 12α-idrossilasi, regione chiamata bile acid response elements o BAREs, inibendo la loro trascrizione.
Una delle ragioni per cui la sintesi dei sali biliari è strettamente regolata è perché molti dei loro metaboliti sono tossici.
Chiang J.Y.L. Bile acids: regulation of synthesis. J Lipid Res 2009;50(10):1955-66. doi:10.1194/jlr.R900010-JLR200
Gropper S.S., Smith J.L. Advanced nutrition and human metabolism. 6a edizione. Cengage Learning, 2012
Moghimipour E., Ameri A., and Handali S. Absorption-enhancing effects of bile salts. Molecules 2015;20(8); 14451-73. doi:10.3390/molecules200814451
Monte M.J., Marin J.J.G., Antelo A., Vazquez-Tato J. Bile acids: Chemistry, physiology, and pathophysiology. World J Gastroenterol 2009;15(7):804-16. doi:10.3748/wjg.15.804
Rawn J.D. Biochimica. Mc Graw-Hill, Neil Patterson Publishers, 1990
Rosenthal M.D., Glew R.H. Medical biochemistry – Human metabolism in health and disease. John Wiley J. & Sons, Inc., Publication, 2009
Sundaram S.S., Bove K.E., Lovell M.A. and Sokol R.J. Mechanisms of Disease: inborn errors of bile acid synthesis. Nat Clin Pract Gastroenterol Hepatol 2008;5(8):456-68. doi:10.1038/ncpgasthep1179