Las sales biliares y los ácidos biliares son derivados polares del colesterol, y representan la principal vía de eliminación del esteroide del organismo.
Son moléculas con estructuras similares pero no idénticas, y con diversas características físicas y biológicas.
Se sintetizan en el hígado, se almacenan en la vesícula biliar, se secretan en el duodeno y finalmente, en su mayor parte, se reabsorben en el íleon.
Debido a que a pH fisiológico estas moléculas están presentes como aniones, los términos ácido biliar y sales biliares se utilizan aquí como sinónimos.
CONTENIDOS
- Estructura química de las sales biliares
- Primarias, conjugadas y secundarias
- Función de los ácidos biliares
- Circulación enterohepática de las sales biliares
- Metabolismo intestinal de los ácidos biliares
- Fibras solubles y reabsorción de las sales biliares
- Síntesis de los ácidos biliares primarios
- La vía clásica o neutra
- La vía alternativa o ácida
- Vías menores
- Sales biliares: regulación de la síntesis
- Estructura química de las sales biliares
- Sales biliares primarias, conjugadas y secundarias
- Función de los ácidos biliares
- Circulación enterohepática de sales biliares
- Metabolismo intestinal de los ácidos biliares
- Fibras solubles y reabsorción de sales biliares
- Síntesis de los ácidos biliares primarios
- La vía clásica o neutra
- La vía alternativa o ácida
- Vías menores
- Sales biliares: regulación de la síntesis
Estructura química de las sales biliares
Las sales biliares tienen similitudes y diferencias con la molécula de colesterol.
Al igual que el esteroide, tienen un núcleo compuesto por cuatro anillos fusionados: tres anillos de ciclohexano, etiquetados como A, B y C, y un anillo de ciclopentano, etiquetado como D. Esta estructura es el perhidrociclopentanofenantreno, más conocido como núcleo de esteroide.
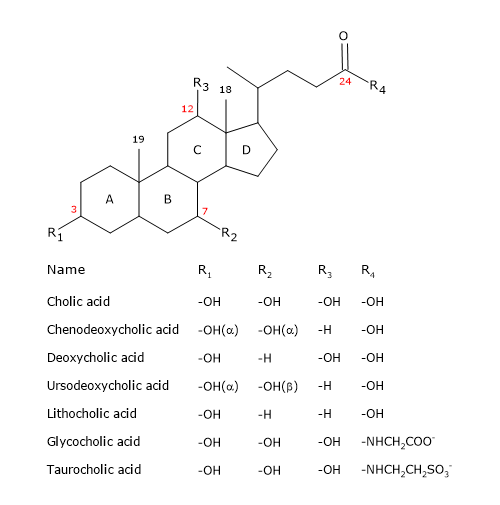
En los vertebrados superiores, tienen 24 átomos de carbono, ya que la cadena lateral es tres carbonos más corta que la original. En los vertebrados inferiores, los ácidos biliares tienen 25, 26 o 27 átomos de carbono. La cadena lateral termina con un grupo carboxilo, ionizado a pH 7, que puede unirse al aminoácido glicina o taurina (ver más adelante).
Además del grupo hidroxilo en la posición 3, tienen grupos hidroxilos en las posiciones 7 y/o 12.
Todo esto los hace mucho más polares que el colesterol.
Dado que los anillos A y B están fusionados en configuración cis, la estructura planar del núcleo del esteroide es curva, y es posible identificar:
- un lado cóncavo, que es hidrofílico porque los grupos hidroxilo y el grupo carboxilo de la cadena lateral, con o sin el aminoácido enlazado, están orientados hacia él;
- un lado convexo, que es hidrofóbico porque los grupos metilo presentes en la posición 18 y 19 están orientados hacia él.
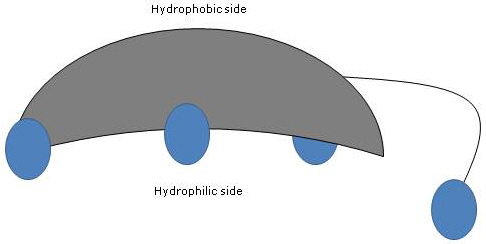
Por tanto, al tener grupos polares y no polares, son moléculas anfifílicas y excelentes tensioactivos. Sin embargo, su estructura química los hace diferentes de muchos otros surfactantes, a menudo compuestos por una región de cabeza polar y una cola no polar.
Sales biliares primarias, conjugadas y secundarias
Los ácidos biliares primarios son los que se sintetizan directamente a partir del colesterol en los hepatocitos. En el ser humano, los más importantes son el ácido cólico y el ácido quenodesoxicólico, que constituyen el 80% de todos los ácidos biliares. Antes de ser secretados en el árbol biliar, se conjugan casi por completo, hasta un 98%, con la glicina o la taurina, para formar glucoconjugados y tauroconjugados, respectivamente. En particular, aproximadamente el 75% del ácido cólico y el ácido quenodesoxicólico se conjugan con la glicina, para formar el ácido glicocólico y el ácido glicocenodesoxicólico, y el 25% restante con la taurina, para formar el ácido taurocólico y el taurochenodesoxicólico.
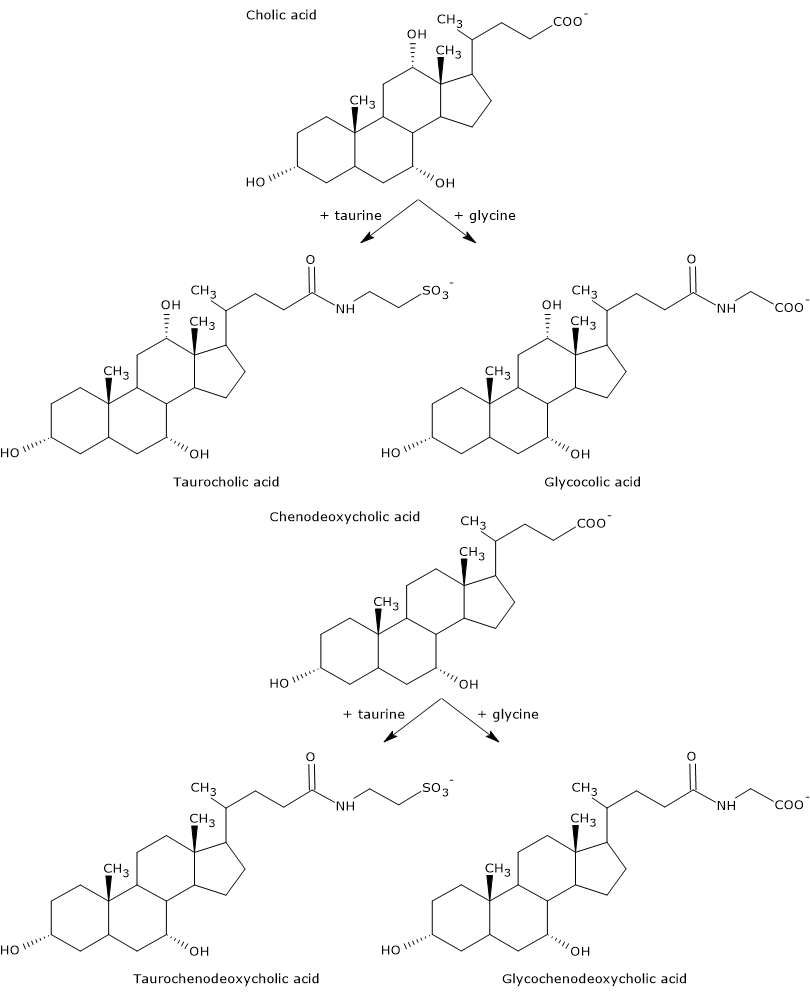
Los ácidos biliares conjugados son moléculas con más grupos hidrófilos que los ácidos biliares no conjugados, por tanto con una mayor capacidad emulsionante. De hecho, la conjugación disminuye el pKa de los ácidos biliares, desde aproximadamente 6, valor típico de las moléculas no conjugadas, hasta aproximadamente 4 para el ácido glicocólico, y aproximadamente 2 para el ácido taurocólico. Esto hace que los ácidos biliares conjugados se ionicen en un rango más amplio de pH para formar las sales correspondientes.
La hidrofilia del ácido común y de las sales biliares disminuye en el siguiente orden: glicina-conjugada < taurina-conjugada < ácido litocólico < ácido desoxicólico < ácido quenodesoxicólico < ácido cólico < ácido ursodesoxicólico.
Por último, la conjugación también disminuye la citotoxicidad de los ácidos biliares primarios.
Los ácidos biliares secundarios se forman a partir de los ácidos biliares primarios que no han sido reabsorbidos en el intestino delgado. Una vez que llegan al colon, pueden sufrir varias modificaciones por parte de la microbiota intestinal para formar ácidos biliares secundarios (véase más adelante). Constituyen el 20% restante de la reserva de ácidos biliares del organismo.
Otra forma de clasificar las sales biliares se basa en su conjugación con la glicina y la taurina y en su grado de hidroxilación. Sobre esta base, se identifican tres categorías.
- Conjugados trihidroxi, como el ácido taurocólico y el ácido glicocólico.
- Conjugados dihidroxi, como el ácido glicodeoxicólico, el ácido glicocénodeoxicólico, el ácido taurochenodeoxicólico y el ácido taurodeoxicólico. Representan aproximadamente el 60% de las sales biliares presentes en la bilis.
- Formas no conjugadas, como el ácido cólico, el ácido desoxicólico, el ácido quenodesoxicólico y el ácido litocólico.
Función de los ácidos biliares
Todas sus funciones fisiológicas se realizan en la forma conjugada.
- Son la principal vía de eliminación del colesterol del cuerpo humano.
De hecho, los humanos no tienen las enzimas para romper los anillos de ciclohexano o el anillo de ciclopentano del núcleo del esteroide, ni para oxidar el colesterol a CO2 y agua.
El otro mecanismo para eliminar el esteroide del cuerpo es como colesterol per se en la bilis. - Las sales biliares son fuertes surfactantes. Y en particular, los conjugados di- y trihidroxi son los mejores surfactantes entre los ácidos biliares, mucho más eficaces que los homólogos no conjugados, ya que tienen más grupos polares.
Una vez en contacto con los lípidos apolares en el lumen del intestino delgado, la superficie apolar convexa interactúa con los lípidos apolares, como los triglicéridos, los ésteres de colesterol y los ésteres de vitaminas liposolubles, mientras que la superficie polar cóncava interactúa con el medio acuoso circundante. Esto aumenta la dispersión de los lípidos apolares en el medio acuoso, ya que permite la formación de diminutas gotas de lípidos, aumentando la superficie para:
la actividad de la lipasa, principalmente la pancreática, (las sales biliares también desempeñan un papel directo en la activación de esta enzima);
la actividad de la esterasa intestinal.
Por consiguiente, facilitan la absorción de los productos de la digestión de los lípidos, así como de las vitaminas liposolubles por la mucosa intestinal gracias a la formación de micelas mixtas.
Los ácidos biliares desempeñan una función similar en la vesícula biliar, donde, formando micelas mixtas con los fosfolípidos, impiden la precipitación del colesterol.
Nota: Como consecuencia de la disposición de grupos polares y no polares, los ácidos biliares forman micelas en solución acuosa, generalmente compuestas por menos de 10 monómeros, siempre que su concentración sea superior a la llamada concentración micelar crítica o CMC.
- A nivel intestinal, modulan la secreción de enzimas pancreáticas y de colecistoquinina.
- En el intestino delgado y grueso, tienen una potente actividad antimicrobiana, principalmente el ácido desoxicólico, en particular contra las bacterias Gram-positivas. Esta actividad puede deberse al daño oxidativo del ADN, y/o al daño de la membrana celular. Por lo tanto, desempeñan un papel importante en la prevención del sobrecrecimiento bacteriano, pero también en la regulación de la composición de la microbiota intestinal.
- En los últimos años, se hace evidente su papel regulador en el control del metabolismo energético, y en particular para el manejo de la glucosa hepática.
Circulación enterohepática de sales biliares
Después de la ingesta de grasas, las células enteroendocrinas del duodeno secretan colecistoquinina al torrente sanguíneo. La hormona que se une a los receptores de las células musculares lisas de la vesícula biliar promueve su contracción; la hormona también provoca la relajación del esfínter de Oddi. Todo ello da lugar a la secreción de la bilis y, por tanto, de los ácidos biliares en el duodeno.
En condiciones fisiológicas, la reserva de sales biliares del ser humano es constante e igual a unos 3-5 g. Esto es posible gracias a dos procesos:
- su reabsorción intestinal;
- su síntesis de novo (véase más adelante).
Hasta el 95% de las sales biliares secretadas se reabsorbe desde el intestino, no junto con los productos de la digestión de los lípidos, sino a través de un proceso denominado circulación enterohepática.
Se trata de un sistema de reciclaje extremadamente eficaz, que parece producirse al menos dos veces por cada comida, y que incluye el hígado, el árbol biliar, el intestino delgado, el colon y la circulación portal, a través de la cual las moléculas reabsorbidas vuelven al hígado. Esta recirculación es necesaria ya que la capacidad del hígado para sintetizar ácidos biliares es limitada e insuficiente para satisfacer las necesidades intestinales si las sales biliares se excretaran en las heces en cantidades elevadas.
La mayor parte de las sales biliares se reabsorben en el íleon distal, la parte inferior del intestino delgado, mediante un transportador dependiente de sodio dentro del borde en cepillo de los enterocitos, denominado transportador de ácidos biliares dependiente de sodio o ASBT, que realiza el cotransporte de una molécula de ácido biliar y dos iones de sodio.
Dentro del enterocito, se cree que los ácidos biliares son transportados a través del citosol hasta la membrana basolateral por la proteína de unión a ácidos biliares ileal o IBABP. Atraviesan la membrana basolateral por el transportador de solutos orgánicos alfa-beta u OSTα/OSTβ, pasan a la circulación portal y, unidos a la albúmina, llegan al hígado.
Hay que tener en cuenta que un pequeño porcentaje de ácidos biliares llega al hígado a través de la arteria hepática.
A nivel hepático, su extracción es muy eficiente, con una fracción de extracción de primer paso que oscila entre el 50 y el 90%, porcentaje que depende de la estructura del ácido biliar. La captación de los ácidos biliares conjugados está mediada principalmente por un sistema de transporte activo dependiente de Na+, es decir, el polipéptido cotransportador de taurocolato dependiente de sodio o NTCP. Sin embargo, también puede producirse una captación independiente del sodio, llevada a cabo por proteínas de la familia de los polipéptidos transportadores de aniones orgánicos u OATP, principalmente OATP1B1 y OATP1B3.
El paso que limita la velocidad en la circulación enterohepática es su secreción canalicular, mediada en gran medida por la bomba de exportación de sales biliares o BSEP, en un proceso dependiente del ATP. Esta bomba transporta las sales biliares monoaniónicas, que son las más abundantes. Los ácidos biliares conjugados con ácido glucurónico o sulfato, que son dianiónicos, son transportados por diferentes transportadores, como MRP2 y BCRP.
Nota: Los niveles séricos de ácidos biliares varían en función de la velocidad de su reabsorción, por lo que son más elevados durante las comidas, cuando la circulación enterohepática es más activa.
Metabolismo intestinal de los ácidos biliares
Los ácidos biliares que escapan a la absorción ileal pasan al colon, donde sufren en parte modificaciones por parte de la microbiota intestinal y se convierten en ácidos biliares secundarios.
Las principales reacciones se enumeran a continuación.
- Desconjugación
En la cadena lateral puede producirse la hidrólisis del enlace N-acil amida C24, con liberación de ácidos biliares no conjugados y glicina o taurina. Esta reacción es catalizada por hidrolasas bacterianas presentes tanto en el intestino delgado como en el colon. - La 7α-Deshidroxilación
Cuantitativamente, es la reacción más importante, llevada a cabo por deshidrasas bacterianas colónicas que eliminan el grupo hidroxilo en la posición 7 para formar ácidos biliares 7-deoxi. En particular, el ácido desoxicólico se forma a partir del ácido cólico, y el ácido litocólico, un ácido biliar secundario tóxico, a partir del ácido quenodesoxicólico.
Debe tenerse en cuenta que la 7α-deshidroxilación, a diferencia de la oxidación y la epimerización (véase más adelante), sólo puede producirse en ácidos biliares no conjugados, y por lo tanto, la desconjugación es un requisito previo esencial. - Oxidación y epimerización
Son reacciones que implican a los grupos hidroxilo en las posiciones 3, 7 y 12, catalizadas por las hidroxiesteroides deshidrogenasas bacterianas. Por ejemplo, el ácido ursodesoxicólico deriva de la epimerización del ácido quenodesoxicólico.
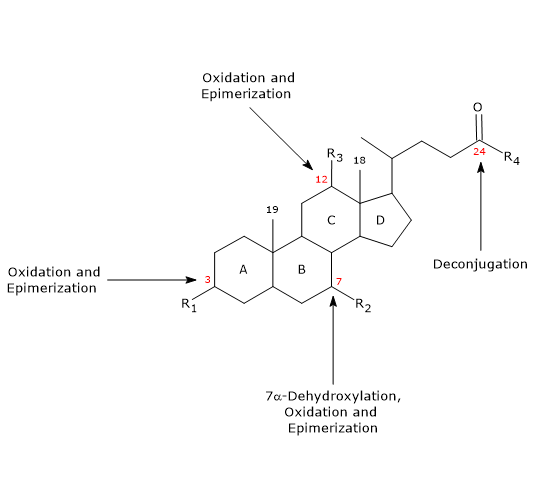
Algunos de los ácidos biliares secundarios se reabsorben del colon y vuelven al hígado. En los hepatocitos, se reconjugan, si es necesario, y se vuelven a secretar. Los que no se reabsorben, se excretan en las heces.
Mientras que las oxidaciones y las desconjugaciones son llevadas a cabo por un amplio espectro de bacterias anaerobias, la 7α-dehidroxilación es realizada por un número limitado de anaerobios colónicos.
Las 7α-deshidroxilaciones y deconjugaciones aumentan el pKa de los ácidos biliares y, por tanto, su hidrofobicidad, lo que permite un cierto grado de absorción pasiva a través de la pared colónica.
El aumento de la hidrofobicidad también se asocia con una mayor toxicidad de estas moléculas. Y una alta concentración de ácidos biliares secundarios en la bilis, la sangre y las heces se ha asociado a la patogénesis del cáncer de colon.
Fibras solubles y reabsorción de sales biliares
La reabsorción de sales biliares puede reducirse por la acción quelante de las fibras solubles, como las que se encuentran en las frutas frescas, las legumbres, la avena y el salvado de avena, que las aglutinan, disminuyendo su captación. A su vez, esto aumenta la síntesis de novo de los ácidos biliares, regulando al alza la expresión de la 7α-hidroxilasa y del esterol 12α-hidroxilasa (véase más adelante), y por lo tanto reduce la concentración de colesterol de los hepatocitos.
La depleción del colesterol hepático aumenta la expresión del receptor LDL, y por lo tanto reduce la concentración plasmática de colesterol LDL. Por otro lado, también estimula la síntesis de la HMG-CoA reductasa, la enzima clave en la biosíntesis del colesterol.
Nota: Algunos fármacos anticolesterol actúan uniendo los ácidos biliares en el intestino, impidiendo así su reabsorción.
Síntesis de los ácidos biliares primarios
Cuantitativamente, los ácidos biliares son el principal producto del metabolismo del colesterol.
Como se ha dicho anteriormente, la circulación enterohepática y su síntesis de novo mantienen un tamaño constante del pool de ácidos biliares. En particular, la síntesis de novo permite la reposición de las sales biliares excretadas en las caras, alrededor del 5-10% del pool corporal, es decir, ~ 0,5 g/día.
A continuación se describe la síntesis del ácido cólico y del ácido quenodesoxicólico, y su conjugación con los aminoácidos taurina y glicina.
Existen dos vías principales para la síntesis de los ácidos biliares: la vía clásica y la vía alternativa. Además, también se describirán algunas otras vías menores.
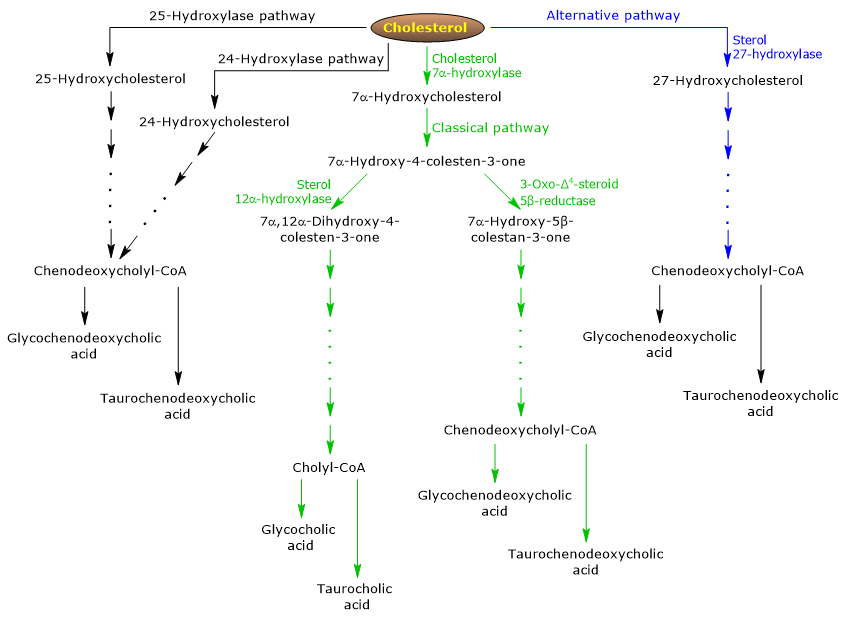
La vía clásica o neutra
En los seres humanos, hasta el 90% de las sales biliares se producen a través de la vía clásica (véase la fig. 5), también denominada vía «neutra» ya que los intermediarios son moléculas neutras.
Es una vía metabólica presente sólo en el hígado, que consta de reacciones catalizadas por enzimas localizadas en el citosol, el retículo endoplásmico, los peroxisomas y las mitocondrias, y cuyos productos finales son los conjugados del ácido cólico y el ácido quenodesoxicólico.
- La primera reacción es la hidroxilación en la posición 7 del colesterol, para formar 7α-hidroxicolesterol. La reacción es catalizada por la colesterol 7α-hidroxilasa o CYP7A1 (C.E. 1.14.14.23). Es una enzima localizada en el retículo endoplásmico, y cataliza el paso limitante de la vía.
Colesterol + NADPH + H+ + O2 → 7α-Hidroxicolesterol + NADP+ + H2O
- El 7α-Hidroxicolesterol sufre la oxidación del grupo 3β-hidroxilo y el desplazamiento del doble enlace de la posición 5,6 a la posición 4,5, para formar 7α-hidroxi-4-colesten-3-ona. La reacción es catalizada por la 3β-hidroxi-Δ5-C27-esteroide oxidorreductasa o HSD3B7 (C.E. 1.1.1.181), una enzima localizada en el retículo endoplásmico.
- La 7α-hidroxi-4-colesten-3-ona puede seguir dos rutas:
para entrar en la vía que conduce a la síntesis del ácido cólico, a través de la reacción catalizada por la 7α-hidroxi-4-colesten-3-ona 12α-monooxigenasa o esterol 12α-hidroxilasa o CYP8B1 (C.E. 1.14.18.8), una enzima localizada en el retículo endoplásmico;
para entrar en la vía que conduce a la síntesis del ácido quenodesoxicólico, a través de la reacción catalizada por la 3-oxo-Δ4-esteroide 5β-reductasa o AKR1D1 (C.E. 1.3.1.3), una enzima citosólica.
Hay que subrayar que la actividad de la esterol 12α-hidroxilasa determina la relación entre el ácido cólico y el ácido quenodesoxicólico y, en definitiva, la capacidad detergente del pool de ácidos biliares. Y de hecho, la regulación de la transcripción del gen de la esterol 12α-hidroxilasa es uno de los principales pasos reguladores de la vía clásica.
Por tanto, si la 7α-hidroxi-4-colesten-3-ona procede a través de la reacción catalizada por la esterol 12α-hidroxilasa, se producirán las siguientes reacciones.
- La 7α-hidroxi-4-colesten-3-ona es hidroxilada en la posición 12 por la esterol 12α-hidroxilasa, para formar 7α,12α-dihidroxi-4-colesten-3-ona.
- La 7α,12α-Dihidroxi-4-colesten-3-ona se somete a la reducción del doble enlace en la posición 4,5, en la reacción catalizada por la 3-oxo-Δ4-esteroide 5β-reductasa, para formar 5β-colestan-7α,12α-diol-3-ona.
- 5β-Colestan-7α,12α-diol-3-ona se somete a la reducción del grupo hidroxilo en la posición 4, en la reacción catalizada por la 3α-hidroxiesteroide deshidrogenasa o AKR1C4 (EC 1.1.1.213), una enzima citosólica, para formar 5β-colestán-3α,7α,12α-triol.
- 5β-colestán-3α,7α,12α-triol se somete a la oxidación de la cadena lateral mediante tres reacciones catalizadas por la esterol 27-hidroxilasa o CYP27A1 (EC 1.14.15.15). Se trata de una enzima mitocondrial también presente en los tejidos extrahepáticos y en los macrófagos, que introduce un grupo hidroxilo en la posición 27. El grupo hidroxilo se oxida a aldehído, y luego a ácido carboxílico, para formar el ácido 3α,7α,12α-trihidroxi-5β-colestanoico.
- El ácido 3α,7α,12α-trihidroxi-5β-colestanoico se activa a su éster de coenzima A, 3α,7α,12α-trihidroxi-5β-colestanoil-CoA, en la reacción catalizada por la acil-CoA sintetasa de cadena muy larga o VLCS (EC 6.2.1.-), o por la CoA sintetasa de ácidos biliares o BACS (EC 6.2.1.7), ambas localizadas en el retículo endoplásmico.
- 3α,7α,12α-Trihidroxi-5β-colestanoil-CoA es transportado a los peroxisomas, donde se somete a cinco reacciones sucesivas, cada una catalizada por una enzima diferente. En las dos últimas reacciones, la cadena lateral se acorta a cuatro átomos de carbono, y finalmente se forma la colilCoA.
- En el último paso, se produce la conjugación, mediante enlace amida, del grupo ácido carboxílico de la cadena lateral con el aminoácido glicina o taurina. La reacción es catalizada por la ácido biliar-CoA:aminoácido N-aciltransferasa o BAAT (EC 2.3.1.65), que se localiza predominantemente en los peroxisomas.
Los productos de la reacción son, por tanto, los ácidos biliares conjugados: ácido glicocólico y ácido taurocólico.
Si la 7α-hidroxi-4-colesten-3-ona no procede a través de la reacción catalizada por la esterol 12α-hidroxilasa, entra en la vía que conduce a la síntesis de los conjugados del ácido quenodesoxicólico, a través de las reacciones descritas a continuación.
- 7α-Hidroxi-4-colestan-3-ona se convierte en 7α-hidroxi-5β-colestan-3-ona en la reacción catalizada por la 3-oxo-Δ4-esteroide 5β-reductasa.
- 7α-Hidroxi-5β-colestan-3-ona se convierte en 5β-colestan-3α,7α-diol en la reacción catalizada por la 3α-hidroxiesteroide deshidrogenasa.
Entonces, los ácidos biliares conjugados ácido glicochenodeoxicólico y ácido taurochenodeoxicólico se forman mediante modificaciones similares a las observadas para la conjugación del ácido cólico, y catalizadas en su mayoría por las mismas enzimas.
Nota: Los ácidos biliares no conjugados que se forman en el intestino deben llegar al hígado para ser reconjugados.
La vía alternativa o ácida
Prevalece en el feto y en el neonato, mientras que en los adultos conduce a la síntesis de menos del 10% de las sales biliares.
Esta vía (ver fig. 5) difiere de la vía clásica en que:
- los productos intermedios son moléculas ácidas, de donde procede el nombre alternativo de «vía ácida»;
- la oxidación de la cadena lateral va seguida de modificaciones del núcleo del esteroide, y no al revés;
- los productos finales son conjugados del ácido quenodesoxicólico.
El primer paso implica la conversión del colesterol en 27-hidroxicolesterol en la reacción catalizada por la esterol 27-hidroxilasa.
El 27-hidroxicolesterol puede seguir dos rutas.
Ruta A
- El 27-hidroxicolesterol se convierte en ácido 3β-hidroxi-5-colestenoico en una reacción catalizada por la esterol 27-hidroxilasa.
- El ácido 3β-hidroxi-5-colestenoico se hidroxila en la posición 7 en la reacción catalizada por la oxisterol 7α-hidroxilasa o CYP7B1 (EC 1.14.13.100), una enzima localizada en el retículo endoplásmico, para formar el ácido 3β-7α-dihidroxi-5-colestenoico.
- El ácido 3β-7α-dihidroxi-5-colestenoico se convierte en ácido 3-oxo-7α-hidroxi-4-colestenoico, en la reacción catalizada por la 3β-hidroxi-Δ5-C27-esteroide oxidorreductasa.
- El ácido 3-oxo-7α-hidroxi-4-colestenoico, como resultado de las modificaciones de la cadena lateral, forma ácido quenodesoxicólico, y luego sus conjugados.
Ruta B
- 27-Hidroxicolesterol se convierte en 7α,27-dihidroxicolesterol en la reacción catalizada por la oxisterol 7α-hidroxilasa y la colesterol 7α-hidroxilasa.
- El 7α,27-dihidrocolesterol se convierte en 7α,26-dihidroxi-4-colesten-3-ona en la reacción catalizada por la 3β-hidroxi-Δ5-C27-esteroide oxidorreductasa;
La 7α, 26-Dihidroxi-4-colesten-3-ona puede transformarse directamente en conjugados del ácido quenodesoxicólico, o puede convertirse en ácido 3-oxo-7α-hidroxi-4-colestenoico, y luego sufrir modificaciones de la cadena lateral y otras reacciones que conducen a la síntesis de los conjugados del ácido quenodesoxicólico.
Vías menores
También hay vías menores (véase la fig. 5) que contribuyen a la síntesis de sales biliares, aunque en menor medida que las vías clásicas y alternativas.
Por ejemplo:
- Una colesterol 25-hidroxilasa (EC 1.14.99.38) se expresa en el hígado.
- Una colesterol 24-hidroxilasa o CYP46A1 (EC 1.14.14.25) se expresa en el cerebro y, por tanto, aunque el órgano no puede exportar colesterol, exporta oxiesteroles.
- También se ha descubierto una 7α-hidroxilasa no específica. Se expresa en todos los tejidos y parece estar implicada en la generación de oxiesteroles, que pueden ser transportados a los hepatocitos para ser convertidos en ácido quenodesoxicólico.
Además, la esterol 27-hidroxilasa se expresa en varios tejidos, por lo que sus productos de reacción deben ser transportados al hígado para ser convertidos en sales biliares.
Sales biliares: regulación de la síntesis
La regulación de la síntesis de ácidos biliares se produce a través de un mecanismo de retroalimentación negativa, en particular sobre la expresión de la colesterol 7α-hidroxilasa y la esterol 12α-hidroxilasa.
Cuando se produce un exceso de ácidos biliares, tanto libres como conjugados, estas moléculas se unen al receptor nuclear farnesoide X o FRX, activándolo: el ácido biliar más eficaz es el ácido quenodesoxicólico, mientras que otros, como el ácido ursodesoxicólico, no lo activan.
FRX induce la expresión del represor transcripcional small heterodimer partner o SHP, que a su vez interactúa con otros factores de transcripción, como el liver receptor homolog-1 o LRH-1, y el hepatocyte nuclear factor-4α o HNF-4α. Estos factores de transcripción se unen a una secuencia en la región promotora de los genes 7α-hidroxilasa y 12α-hidroxilasa, región denominada elementos de respuesta a los ácidos biliares o BAREs, inhibiendo su transcripción.
Una de las razones por las que la síntesis de sales biliares está fuertemente regulada es porque muchos de sus metabolitos son tóxicos.
Chiang J.Y.L. Bile acids: regulation of synthesis. J Lipid Res 2009;50(10):1955-66. doi:10.1194/jlr.R900010-JLR200
Gropper S.S., Smith J.L. Advanced nutrition and human metabolism. 6h Edición. Cengage Learning, 2012
Moghimipour E., Ameri A., y Handali S. Absorption-enhancing effects of bile salts. Molecules 2015;20(8); 14451-73. doi:10.3390/molecules200814451
Monte M.J., Marin J.J.G., Antelo A., Vazquez-Tato J. Bile acids: Chemistry, physiology, and pathophysiology. World J Gastroenterol 2009;15(7):804-16. doi:10.3748/wjg.15.804
Rawn J.D. Biochimica. Mc Graw-Hill, Neil Patterson Publishers, 1990
Rosenthal M.D., Glew R.H. Medical biochemistry – Human metabolism in health and disease. John Wiley J. & Sons, Inc., Publicación, 2009
Sundaram S.S., Bove K.E., Lovell M.A. y Sokol R.J. Mechanisms of Disease: inborn errors of bile acid synthesis. Nat Clin Pract Gastroenterol Hepatol 2008;5(8):456-68. doi:10.1038/ncpgasthep1179