VSEPR-teorien er i stand til at forklare og forudsige formen af molekyler, som indeholder ensomme par. I et sådant tilfælde anses de ensomme par såvel som de bindende par for at frastøde og undgå hinanden. Da der f.eks. er to bindinger i SnCl2-molekylet, kan man forvente, at det vil være lineært som BeCl2. Hvis vi tegner Lewis-diagrammet, finder vi imidlertid et lone pair såvel som to bindingspar i Sn-atomets valensskal:
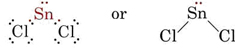_Chloride.jpg?revision=1&size=bestfit&width=235&height=48)
Et lone pair påvirker også strukturen af ammoniak, NH3. Da dette molekyle adlyder oktetreglen, er N-atomet omgivet af fire elektronpar:
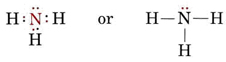
Hvis disse par alle var ækvivalente, ville vi forvente, at vinklen mellem dem ville være den regelmæssige tetraedriske vinkel på 109,5°. Eksperimentelt viser det sig, at vinklen er noget mindre, nemlig 107°. Dette skyldes igen, at det ensomme par er “tykkere” end bindingsparrene og er i stand til at presse dem tættere sammen.
Den elektroniske struktur i H2O-molekylet svarer til NH3-molekylets, bortset fra at det ene bindende par er erstattet af et ensomme par:
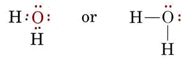
Eksempel \(\PageIndex{1}\) : Molekylær geometri
Skitsér og beskriv geometrien af følgende molekyler: (a) GaCl3, (b) AsCl3 og (c) AsOCl3.
Løsning
a) Da grundstoffet gallium tilhører gruppe III, har det tre valenselektroner. Lewis-diagrammet for GaCl3 er således
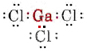
Da der er tre bindingspar og ingen ensomme par omkring Ga-atomet, konkluderer vi, at de tre Cl-atomer er anbragt trigonalt, og at alle fire atomer er i samme plan.
b) Arsen hører til gruppe V og har derfor fem valenselektroner. Lewis-strukturen for AsCl3 er således
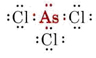
Da der er et enkeltpar til stede, er formen af dette molekyle en trigonal pyramide, hvor As-kernen ligger lidt over en ligesidet trekant af Cl-kerner.
c) Lewis-diagrammet for AsOCl3 ligner det for AsCl3.

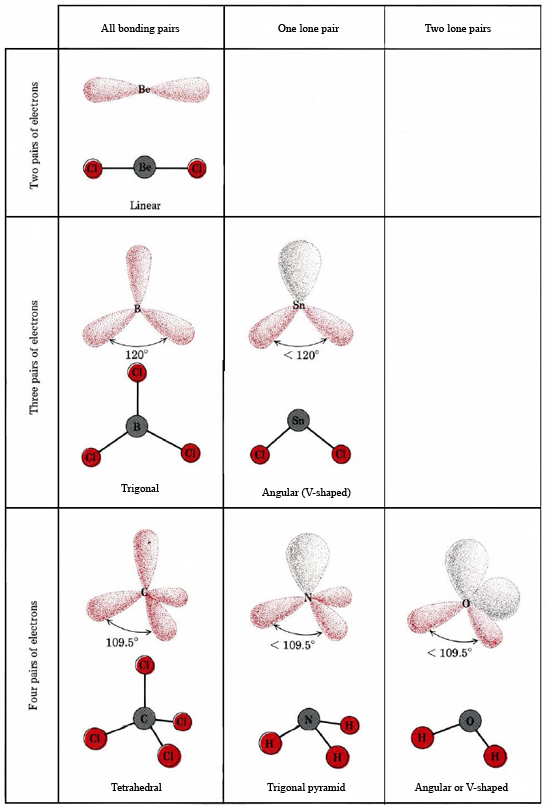
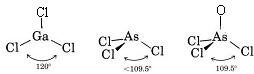
VSEPR-teorien kan også anvendes på molekyler, der indeholder fem og seks valenselektronpar, hvoraf nogle er ensomme par. Vi har ikke medtaget sådanne arter her, fordi størstedelen af forbindelserne falder ind under de kategorier, vi har beskrevet.
Medvirkende
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff og Adam Hahn.