Den 28. november hævdede He Jiankui over for et fyldt konferencerum på det andet internationale topmøde om redigering af det menneskelige genom i Hongkong, at han havde redigeret genomet af to tvillingepiger, Lulu og Nana, som blev født i Kina.
Videnskabsfolk ved Southern University of Science and Technology i Guangdong, Kina, fordømte He’s forskning og hævdede, at han “i alvorlig grad har overtrådt akademisk etik og adfærdskodekser”, og filosoffer og bioetikere var hurtige til at dykke ned i moradset omkring redigering af menneskers genomer. Så jeg vil ikke dække dette område. Det, jeg vil tage fat på, er det, vi har lært: hvordan han har lavet disse babyer.
Jeg er teoretisk set pensioneret professor i afdelingen for biomedicinske videnskaber ved Colorado State University. I mere end 50 år har jeg forsket i adskillige aspekter af assisteret reproduktionsteknologi, herunder kloning og genetiske ændringer af embryoner fra pattedyr, så jeg er interesseret i næsten al forskning vedrørende “designerbabyer” og de helbredsproblemer, de kan lide.
En første?
På konferencen gav han et generelt overblik over videnskaben. Selv om forskning som denne typisk ville blive præsenteret for det videnskabelige samfund ved at blive offentliggjort i et peer-reviewed tidsskrift, hvilket han hævder, at han har til hensigt at gøre, kan vi få en grov fornemmelse af, hvordan han har skabt disse modificerede babyer. Dette er noget, der med succes er blevet gjort på andre arter og så sent som sidste år på menneskelige embryoner – men sidstnævnte blev ikke implanteret i en kvinde. Han siger, at han brugte tre år på at afprøve proceduren på mus og aber, før han gik over til at arbejde på menneskelige embryoner.
Der er ingen tvivl om, at der kan foretages præcise genetiske ændringer i menneskelig sæd, æg, embryoner og endda nogle celler hos voksne mennesker. Sådanne ændringer er blevet foretaget ad nauseum i mus, svin og flere andre pattedyr. Det er derfor indlysende for forskere som mig selv, at de samme genetiske ændringer kan og vil blive foretaget på mennesker. Den nemmeste måde at foretage genetiske ændringer på begynder med embryoet.
Værktøjskassen
Den mest trendy strategi til ændring af DNA i disse dage involverer CRISPR/Cas-9-genredigeringsværktøjet, som kan foretage præcise genetiske ændringer i levende celler. Selv om andre værktøjer har været tilgængelige i årevis, er CRISPR/Cas-9-metoden enklere, nemmere, mere præcis og billigere.
Den måde, den fungerer på, er enkel i princippet. Cas-9-komponenten er en molekylær saks, der klipper DNA’et på det sted, der er angivet af et lille stykke RNA, kaldet “CRISPR-skabelonen”. Når DNA’et er klippet, kan et gen ændres på det pågældende sted. Klippet repareres derefter af enzymer, der allerede findes i cellerne.
I dette tilfælde målrettede han et gen, der producerer et protein på overfladen af cellerne kaldet CCR5. HIV-virussen bruger dette protein til at binde sig til cellen og inficere den. Hans idé var at ændre CCR5 genetisk, så hiv ikke længere kan inficere cellerne, hvilket gør pigerne resistente over for virussen.
På nuværende tidspunkt har han ikke givet en klar forklaring på, præcis hvordan han satte CCR5 ud af funktion og arten af den genetiske ændring. Men denne form for “deaktivering” bruges rutinemæssigt i forskningen.
Hvordan han gjorde det
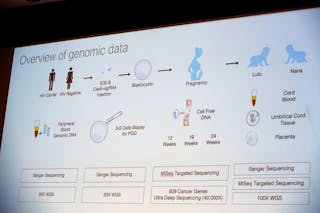
Af det diagram, som He præsenterede, fremgår det, at He injicerede CRISPR/Cas-9-systemet i et æg på samme tid, som han injicerede en sædcelle for at befrugte det. Herefter delte ægget sig og dannede en kugle af snesevis af celler – embryoet. På dette stadium fjernede han nogle få celler fra hvert embryo for at fastslå, om den ønskede genetiske ændring var foretaget. Baseret på min erfaring blev embryonerne sandsynligvis frosset ned på dette tidspunkt. Når analysen var færdig, tøede han sandsynligvis de modificerede embryoner op og overførte de bedste af dem tilbage til moderens livmoder, så de kunne blive drægtige til termin. Embryoner uden ændringerne eller med forkerte ændringer ville enten blive kasseret eller brugt til forskning.
For mange anvendelser er det ideelt at foretage eventuelle ændringer i generne på et-celle-stadiet. Når embryoet så duplikerer sit DNA og deler sig for at lave et tocellet embryo, bliver den genetiske ændring også duplikeret. Dette fortsætter således, at hver celle i det resulterende barn har den genetiske ændring.
Det ser imidlertid ud til, at den genetiske ændring i dette tilfælde ikke fandt sted før tocellestadiet eller senere, fordi nogle celler i babyerne havde ændringen, mens andre ikke havde den. Denne situation kaldes mosaikisme, fordi barnet er en mosaik af normale og modificerede celler.
Farer ved redigering af embryoner?
Hvad kan gå galt i et genredigeret embryon? Rigeligt.
Den første fejl er, at der ikke blev foretaget nogen ændring, hvilket sker hyppigt. En variant er, at ændringen sker i nogle celler i embryoet, men ikke i alle cellerne, som det skete hos disse babyer.
Den mest almindelige bekymring er de såkaldte non-target-effekter, hvor den genetiske modifikation foretages, men hvor andre utilsigtede redigering(er) forekommer andre steder i genomet. En ændring på det forkerte sted kan forårsage alle mulige udviklingsproblemer som f.eks. unormal organudvikling, abort og endog kræft.
Det fremgår af hans slide, at han sekventerede genomerne – det komplette genetiske blueprint for hvert barn – på flere stadier af graviditeten for at afgøre, om der var uønskede modifikationer, selv om disse ikke altid er lette at finde. Men før uafhængige forskere kan undersøge DNA’et fra disse to små piger, kender vi ikke resultaterne. Det fremgår heller ikke klart af de resultater, som han har delt indtil videre, om denne genetiske ændring kan overføres til den næste generation.
Et andet almindeligt problem, som allerede er blevet nævnt, er mosaikisme, som synes at være sket hos en af disse tvillinger. Hvis nogle celler er redigeret, og andre ikke, kan barnet f.eks. have leverceller, der indeholder det redigerede gen, og hjerteceller, der har den normale version. Dette kan føre til alvorlige problemer eller ej.

Et andet problem er, at manipulation af embryoner in vitro – uden for deres normale miljø i forplantningskanalen – hvor vi ikke præcist kan kopiere den normale ernæring, iltniveauer, hormoner og vækstfaktorer – kan føre til udviklingsmæssige abnormiteter, herunder overdimensionerede fostre, stofskifteproblemer og så videre. Dette sker undertiden ved rutineprocedurer som f.eks. in vitro-befrugtning, når der ikke forsøges at foretage genetiske ændringer.
Glægeligt nok er naturen ret god til at sortere unormale embryoner fra via embryonaldød og spontan abort. Selv i sunde menneskepopulationer, der reproducerer sig normalt, dør næsten halvdelen af embryonerne, før kvinden overhovedet ved, at hun var gravid.
Vi designer allerede babyer – og der er fordele
Selv om jeg har understreget, hvad der kan gå galt, tror jeg, at videnskaben vil udvikle sig således, at genetisk modificerede babyer vil være sundere end ikke-modificerede babyer. Og disse forbedringer vil blive givet videre til fremtidige generationer. Alvorligt invaliderende genetiske abnormiteter som Tay-Sachs syndrom vil kunne fjernes fra en familie ved hjælp af genetisk modifikation.
Designerbabyer fødes allerede nu ved hjælp af en teknik kaldet præimplantationsgenetisk diagnose (PGD). Nogle få celler fra embryoner screenes for dusinvis og potentielt hundredvis af genetiske abnormiteter som Downs syndrom, cystisk fibrose og Tay-Sachs syndrom, for blot at nævne nogle få. Forældrene kan også vælge de embryoner, der har det ønskede køn. Efter min mening er det at vælge, hvilke embryoner der skal implanteres, helt klart at lave designerbabyer.
Går vi et skridt videre, er PGD ikke begrænset til blot at fjerne sygdomme. En kommende forælder kan også vælge andre karaktertræk. Når en af de kommende forældre er ufrugtbar, findes der kataloger, der oplyser race, højde og vægt og endda uddannelsesniveauet for en sæd- eller ægdonor, som også er bestemt til at være fri for større genetiske defekter og fri for aids og andre kønssygdomme.

Såfremt procedurerne anses for etisk og moralsk acceptable, vil de fleste genetiske ændringer, der sandsynligvis vil blive foretaget ved redigering af embryoner, som han siger, han har gjort, efter min mening indebære fjernelse af skadelige træk snarere end tilføjelse af ønskværdige træk. Fordi ændringerne vil være målrettede, vil de være mere præcise og mindre skadelige end de mutationer, der forekommer tilfældigt i DNA’et i stort set alle sædceller og æg på naturlig vis.
Med al denne reproduktive teknologi er der en anden overvejelse: de enorme omkostninger ved de beskrevne procedurer. I hvilket omfang bør samfundet investere de knappe medicinske ressourcer i anvendelsen af sådanne teknikker, især fordi eventuelle fordele sandsynligvis mest vil tilfalde velhavende familier?
Disse perspektiver skal holdes for øje, når man vurderer potentielle genetiske manipulationer af mennesker.