Generisk navn: jern dextran
Doseringsform: injektion
Medicinsk gennemgået af Drugs.com. Sidst opdateret den 1. dec. 2019.
- Overblik
- Bivirkninger
- Dosering
- Professionel
- Interaktioner
- Videre
Anafylaktiske reaktioner, herunder dødsfald, har fulgt efter parenteral indgift af jerndextraninjektion.
- Hold genoplivningsudstyr og personale, der er uddannet i påvisning og behandling af reaktioner af anafylaktisk type, let tilgængelige under administration af Infed®.
- Administrer en testdosis Infed® før den første terapeutiske dosis. Hvis der ikke følger tegn eller symptomer på reaktioner af anafylaktisk type efter testdosis, administreres den fulde terapeutiske Infed®-dosis.
- Under alle Infed®-administrationer skal man observere for tegn eller symptomer på reaktioner af anafylaktisk type. Der er sket dødelige reaktioner efter testdosis af jerndextran-injektion. Der er også forekommet dødelige reaktioner i situationer, hvor testdosis blev tolereret.
- Anvend Infed® kun hos patienter, hos hvem kliniske og laboratorieundersøgelser har fastslået en jernmangeltilstand, der ikke kan behandles med oral jernbehandling.
- Patienter med en historie af lægemiddelallergi eller flere lægemiddelallergier kan have en øget risiko for reaktioner af anafylaktisk type på Infed®.
BESKRIVELSE:
Infed (Iron Dextran Injection USP) er et mørkebrunt, let viskøst sterilt væskekompleks af jernhydroxid og dextran til intravenøs eller intramuskulær brug.
Hver mL indeholder det tilsvarende 50 mg elementært jern (som et jerndextran-kompleks), ca. 0,9 % natriumklorid, i vand til injektion. Natriumhydroxid og/eller saltsyre kan være blevet anvendt til justering af pH. Opløsningens pH-værdi er mellem 4,5 og 7,0.
Terapeutisk klasse: Hæmatinikum
KLINISK Farmamakologi:
Allmentarisk: Efter intramuskulær injektion absorberes jerndextran fra injektionsstedet til kapillærerne og det lymfatiske system. Cirkulerende jerndextran fjernes fra plasmaet af celler i det reticuloendotheliale system, som splitter komplekset op i dets komponenter jern og dextran. Jernet bindes straks til de tilgængelige proteinerester for at danne hæmosiderin eller ferritin, som er de fysiologiske former for jern, eller i mindre grad til transferrin. Dette jern, som er underlagt fysiologisk kontrol, supplerer hæmoglobin og udtømte jernlagre.
Dextran, som er en polyglukose, bliver enten metaboliseret eller udskilt. Der tabes ubetydelige mængder jern via urin- eller fødevejene efter administration af jerndextran.
Den største del af intramuskulære injektioner af jerndextran absorberes inden for 72 timer; det meste af det resterende jern absorberes i løbet af de efterfølgende 3 til 4 uger.
Flere undersøgelser med intravenøst administreret 59Fe jerndextran til jernmangelfattige personer, hvoraf nogle havde samtidig eksisterende sygdomme, har givet halveringstider på mellem 5 timer og mere end 20 timer. 5 timers værdien blev bestemt for 59Fe jerndextran fra en undersøgelse, hvor der blev anvendt laboratoriemetoder til at adskille det cirkulerende 59Fe jerndextran fra det transferrin-bundne 59Fe. 20-timers-værdien afspejler en halveringstid, der er bestemt ved at måle det samlede 59Fe, både cirkulerende og bundet. Det skal forstås, at disse halveringstidsværdier ikke repræsenterer clearance af jern fra kroppen. Jern elimineres ikke let fra kroppen, og ophobning af jern kan være toksisk.
In vitro-undersøgelser har vist, at fjernelsen af jerndextran ved dialyse er ubetydelig.1,2 Seks forskellige dialysatormembraner blev undersøgt (polysulfon, cuprophan, celluloseacetat, cellulosetriacetat, polymethylmethacrylat og polyacrylonitril), herunder de membraner, der anses for at have høj effektivitet og høj flux.
INDIKATIONER OG ANVENDELSE:
Intravenøse eller intramuskulære injektioner af Infed er indiceret til behandling af patienter med dokumenteret jernmangel, hos hvem oral administration er utilfredsstillende eller umulig.
KONTRAINDIKATIONER:
Hypersensitivitet over for produktet. Alle anæmier, der ikke er forbundet med jernmangel.
ADVARSEL:
Risiko for reaktioner af anafylaktisk type: Reaktioner af anafylaktisk type, herunder dødsfald, har fulgt efter parenteral indgift af jerndextran. Der skal altid være genoplivningsudstyr og personale, der er uddannet i påvisning og behandling af reaktioner af anafylaktisk type, let tilgængelige under Infed-administration. Før den første terapeutiske dosis skal der administreres en testdosis Infed på 0,5 ml. (Se DOSERING OG ADMINISTRATION.) Selv om reaktioner normalt er tydelige inden for få minutter, skal patienterne observeres i mindst en time, før den terapeutiske dosis administreres. Under alle Infed-administrationer skal patienterne observeres for tegn eller symptomer på reaktioner af anafylaktisk type. Dødelige reaktioner har fulgt efter testdosis af jerndextran og er også forekommet i situationer, hvor testdosis blev tolereret. Brug kun Infed hos patienter, hos hvem kliniske og laboratorieundersøgelser har fastslået en jernmangeltilstand, der ikke kan behandles med oral jernbehandling.
De faktorer, der påvirker risikoen for reaktioner af anafylaktisk type på jerndextranprodukter, er ikke fuldt ud kendt, men begrænsede kliniske data tyder på, at risikoen kan være øget hos patienter med en historie med lægemiddelallergi eller flere lægemiddelallergier. Desuden kan samtidig brug af angiotensin-konverterende enzym-hæmmende lægemidler øge risikoen for reaktioner på et jerndextranprodukt. Omfanget af risikoen for reaktioner af anafylaktisk type efter eksponering for et specifikt jerndextranprodukt er ukendt og kan variere mellem produkterne.
Jerndextranprodukter adskiller sig fra hinanden med hensyn til kemiske egenskaber og kan variere med hensyn til kliniske virkninger. Jerndextranprodukter er ikke klinisk indbyrdes udskiftelige.
Delayed Reactions: Store intravenøse doser, som f.eks. anvendt ved totaldosisinfusioner (TDI), er blevet forbundet med en øget forekomst af bivirkninger. Bivirkningerne er ofte forsinkede (1-2 dage) reaktioner, der er karakteriseret ved et eller flere af følgende symptomer: arthralgi, rygsmerter, kuldegysninger, svimmelhed, moderat til høj feber, hovedpine, utilpashed, myalgi, kvalme og opkastninger. De indtræder normalt 24-48 timer efter indgift og symptomerne aftager generelt inden for 3-4 dage. Ætiologien for disse reaktioner er ikke kendt. Potentialet for en forsinket reaktion skal tages i betragtning ved vurdering af risiko/benefit ved behandling.
Den maksimale daglige dosis bør ikke overstige 2 ml ufortyndet jerndextran.
Risiko hos patienter med underliggende tilstande: Infed bør anvendes med yderste forsigtighed hos patienter med alvorlig nedsat leverfunktion. Det bør ikke anvendes i den akutte fase af infektiøs nyresygdom.
Bivirkninger, der opleves efter indgift af Infed, kan forværre kardiovaskulære komplikationer hos patienter med allerede eksisterende kardiovaskulær sygdom.
Carcinogenese: En risiko for carcinogenese kan være forbundet med den intramuskulære injektion af jern-kulhydratkomplekser. Sådanne komplekser har under eksperimentelle forhold vist sig at producere sarkomer, når store doser eller små doser, der blev injiceret gentagne gange på samme sted, blev givet til rotter, mus og kaniner og muligvis til hamstere.
Den lange latente periode mellem injektion af et potentielt carcinogen og fremkomsten af en tumor gør det umuligt at måle risikoen nøjagtigt hos mennesker. Der har dog været flere rapporter i litteraturen, der beskriver tumorer på injektionsstedet hos mennesker, der tidligere havde fået intramuskulære injektioner af jern-kulhydratkomplekser.
FORSIGTIGELSER:
Allmene: Uberettiget behandling med parenteralt jern vil medføre overskudslager af jern med deraf følgende mulighed for eksogen hæmosiderose. En sådan jernoverbelastning er særlig tilbøjelig til at forekomme hos patienter med hæmoglobinopatier og andre refraktære anæmier, der fejlagtigt kan blive diagnosticeret som jernmangelanæmier.
Infed bør anvendes med forsigtighed hos personer med historik med betydelige allergier og/eller astma. Anafylaksi og andre overfølsomhedsreaktioner er blevet rapporteret efter ubesmittede testdoser såvel som terapeutiske doser af jerndextraninjektion. Indgiv derfor en testdosis før den første terapeutiske dosis af Infed. (Se BIKET ADVARSEL og DOSERING OG ADMINISTRATION: ADMINISTRATION.)
Epinephrin skal være umiddelbart tilgængeligt i tilfælde af akutte overfølsomhedsreaktioner. (Sædvanlig voksendosis: 0,5 ml af en 1:1000 opløsning, ved subkutan eller intramuskulær injektion). Bemærk: Patienter, der bruger betablokkere, reagerer muligvis ikke tilstrækkeligt på epinephrin. Isoproterenol eller lignende beta-agonistmidler kan være påkrævet hos disse patienter.
Patienter med reumatoid arthritis kan få en akut forværring af ledsmerter og hævelse efter indgift af Infed.
Rapporter i litteraturen fra lande uden for USA (især New Zealand) har antydet, at brugen af intramuskulær jerndextran hos nyfødte har været forbundet med en øget forekomst af gramnegativ sepsis, primært på grund af E. Coli.
Informationer til patienterne: Patienter bør informeres om de potentielle bivirkninger, der er forbundet med brugen af Infed.
Medicin/laboratorieprøveinteraktioner: Store doser jerndextran (5 mL eller mere) er blevet rapporteret til at give en brun farve til serum fra en blodprøve udtaget 4 timer efter administration.
Lægemidlet kan forårsage falsk forhøjede værdier af serumbilirubin og falsk nedsatte værdier af serumkalcium. Serumjernbestemmelser (især ved kolorimetriske analyser) er muligvis ikke meningsfulde i 3 uger efter indgivelse af jerndextran.
Serumferritin topper ca. 7 til 9 dage efter en intravenøs dosis Infed og vender langsomt tilbage til baseline efter ca. 3 uger.
Undersøgelse af knoglemarven for jernlagre er muligvis ikke meningsfuld i længere perioder efter jerndextranbehandling, fordi resterende jerndextran kan forblive i de reticuloendotheliale celler.
Knoglescanninger med 99m Tc-diphosphonat er blevet rapporteret til at vise et tæt, halvmåneformet aktivitetsområde i balderne, der følger omridset af hoftekammen, 1 til 6 dage efter intramuskulære injektioner af jerndextran.
Knoglescanninger med 99m Tc-mærkede knoglesøgemidler, i tilstedeværelse af høje serumferritinniveauer eller efter jerndextraninfusioner, er blevet rapporteret at vise reduktion af knogleoptagelse, markant renal aktivitet og overdreven blodpulje og ophobning af blødt væv.
Karcinogenese, Mutagenese, Forringelse af fertilitet: Se ADVARSEL.
Graviditet: Jerndextran har vist sig at være teratogen og embryocidalt i mus, rotter, kaniner, hunde og aber, når det gives i doser på ca. 3 gange den maksimale dosis til mennesker.
Der blev ikke observeret nogen konsekvente skadelige fostervirkninger hos mus, rotter, kaniner, hunde og aber ved doser på 50 mg jern/kg eller mindre. Der er rapporteret føtal og maternel toksicitet hos aber ved en samlet intravenøs dosis på 90 mg jern/kg over en 14-dages periode. Lignende virkninger blev observeret hos mus og rotter ved indgift af en enkelt dosis på 125 mg jern/kg. Føtale abnormiteter hos rotter og hunde blev observeret ved doser på 250 mg jern/kg og højere. De dyr, der blev anvendt i disse forsøg, var ikke jernmanglende. Der findes ingen tilstrækkelige og velkontrollerede undersøgelser hos gravide kvinder. Infed bør kun anvendes under graviditet, hvis den potentielle fordel berettiger den potentielle risiko for fosteret.
Placental overførsel: Forskellige dyreforsøg og undersøgelser hos gravide mennesker har vist ufyldestgørende resultater med hensyn til placental overførsel af jerndextran som jerndextran. Det ser ud til, at noget jern når frem til fosteret, men det er uklart, i hvilken form det krydser placenta.
Samlevende mødre: Forsigtighed bør udvises, når Infed administreres til en ammende kvinde. Spor af umetaboliseret jerndextran udskilles i modermælk.
Pædiatrisk brug: Anbefales ikke til brug hos spædbørn under 4 måneder. (Se DOSERING OG ADMINISTRATION.)
ADVERSE REAKTIONER:
Svært/dødeligt: Der er rapporteret anafylaktiske reaktioner ved brug af jerndextran-injektion; i nogle tilfælde har disse reaktioner været dødelige. Sådanne reaktioner, som oftest forekommer inden for de første minutter efter indgift, har generelt været karakteriseret ved pludseligt indsættende åndedrætsbesvær og/eller kardiovaskulært kollaps. Da der er rapporteret om dødelige anafylaktiske reaktioner efter indgift af jerndextran-injektion, bør lægemidlet kun gives, når genoplivningsteknikker og behandling af anafylaktisk og anafylaktoidt chok er let tilgængelige. (Se ADVARSEL I BIXEN og FORSIGTIGELSER: GENERELT, vedrørende øjeblikkelig tilgængelighed af epinefrin.)
Kardiovaskulær: Brystsmerter, trykken i brystet, chok, hjertestop, hypotension, hypertension, takykardi, bradykardi, rødme, arytmier. (Skylning og hypotension kan forekomme ved for hurtig injektion ad intravenøs vej.)
Dermatologisk: Urticaria, pruritus, purpura, udslæt, cyanose.
Gastrointestinal: Abdominalsmerter, kvalme, opkastning, diarré.
Hæmatologi/lymfekræft:
Muskuloskeletalt/blødt væv: Leukocytose, lymfadenopati.
Muskuloskeletalt/blødt væv: Arthralgi, arthritis (kan repræsentere reaktivering hos patienter med hvilende reumatoid arthritis – se PRÆCAUTIONER: GENERELT), myalgi; rygsmerter; steril absces, atrofi/fibrose (intramuskulært injektionssted); brun misfarvning (farvning) af hud og/eller underliggende væv, ømhed eller smerte på eller nær intramuskulære injektionssteder; cellulitis; hævelse; inflammation; lokal flebitis på eller nær intravenøst injektionssted.
Neurologisk: Nervesygdomme: Konvulsioner, kramper, synkope, hovedpine, svaghed, manglende reaktionsevne, paræstesi, feberepisoder, kuldegysninger, svimmelhed, desorientering, følelsesløshed, bevidstløshed.
Respiratorisk: Respirationsstop, dyspnø, bronkospasme, hvæsende vejrtrækning.
Urologisk: Hæmaturi.
Delayed reactions: Reaktioner: : Arthralgi, rygsmerter, kuldegysninger, svimmelhed, feber, hovedpine, utilpashed, myalgi, kvalme, opkastninger. (Se ADVARSEL).
Diverse:
OVERDOSERING:
Overdosering med jerndextran er usandsynligt forbundet med nogen akutte manifestationer. Doser af jerndextran, der overstiger behovet for genoprettelse af hæmoglobin og genopfyldning af jerndepoter, kan føre til hæmosiderose. Periodisk kontrol af serumferritinniveauet kan være nyttig til at genkende en skadelig progressiv ophobning af jern som følge af nedsat optag af jern fra det reticuloendotheliale system ved samtidige medicinske tilstande som kronisk nyresvigt, Hodgkins sygdom og reumatoid arthritis. LD50 for jerndextran er ikke mindre end 500 mg/kg hos mus.
DOSERING OG ADMINISTRATION:
Oral jern bør seponeres før indgift af Infed.
Dosering:
I. Jernmangelanæmi: Periodisk hæmatologisk bestemmelse (hæmoglobin og hæmatokrit) er en enkel og præcis teknik til overvågning af det hæmatologiske respons og bør anvendes som vejledning i behandlingen. Det bør erkendes, at jernlagring kan være forsinket i forhold til fremkomsten af normal blodmorfologi. Serumjern, total jernbindingskapacitet (TIBC) og procentvis mætning af transferrin er andre vigtige tests til påvisning og overvågning af jernmangeltilstand.
Efter indgivelse af jerndextran kompleks kan beviser for et terapeutisk respons ses i løbet af få dage som en stigning i reticulocytantallet.
Og selv om serumferritin normalt er en god rettesnor for kroppens jernlagre, er korrelationen mellem kroppens jernlagre og serumferritin muligvis ikke gyldig hos patienter i kronisk nyredialyse, som også får jerndextran kompleks.
Og selv om der er betydelige variationer i kropsbygning og vægtfordeling blandt mænd og kvinder, udgør den medfølgende tabel og formel et praktisk middel til at estimere det samlede jernbehov. Dette samlede jernbehov afspejler den mængde jern, der er nødvendig for at genoprette hæmoglobinkoncentrationen til et normalt eller næsten normalt niveau plus en yderligere tilførsel for at sikre tilstrækkelig genopfyldning af jernlagrene hos de fleste personer med moderat eller stærkt nedsat hæmoglobinniveau. Det skal erindres, at jernmangelanæmi først opstår, når stort set alle jernlagre er opbrugt. Terapien bør derfor ikke kun sigte mod at genopbygge ikke blot hæmoglobinjern, men også jernlagrene.
Faktorer, der bidrager til formlen, er vist nedenfor.
 Baseret på ovenstående faktorer vil personer med et normalt hæmoglobinniveau have ca. 33 mg jern i blodet pr. kg kropsvægt (15 mg/lb).
Baseret på ovenstående faktorer vil personer med et normalt hæmoglobinniveau have ca. 33 mg jern i blodet pr. kg kropsvægt (15 mg/lb).
Bemærk: Tabellen og den medfølgende formel gælder kun for doseringsbestemmelser hos patienter med jernmangelanæmi; de må ikke anvendes til doseringsbestemmelser hos patienter, der har brug for jernerstatning for blodtab.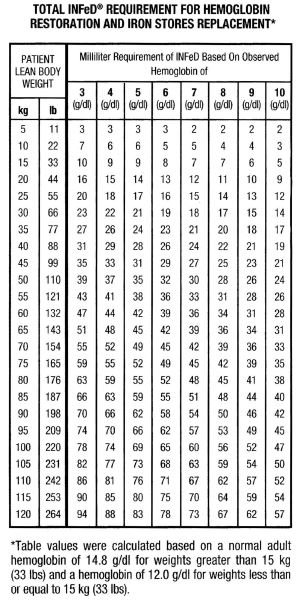
Den samlede mængde Infed i mL, der er nødvendig for at behandle anæmi og genopbygge jernlagrene, kan tilnærmes på følgende måde:
II. Jernerstatning ved blodtab: Nogle personer lider med mellemrum eller gentagne gange af blodtab. Sådanne blodtab kan forekomme periodisk hos patienter med hæmoragiske diatheder (familiær telangiektasi; hæmofili; gastrointestinal blødning) og gentagne gange i forbindelse med procedurer som f.eks. renal hæmodialyse.
Jernbehandling hos disse patienter bør være rettet mod erstatning af den tilsvarende mængde jern, der er repræsenteret i blodtabet. Tabellen og formlen, der er beskrevet under I. Jernmangelanæmi, kan ikke anvendes til simple jernerstatningsværdier.
Kvantitative skøn over individets periodiske blodtab og hæmatokrit under blødningsepisoden giver en praktisk metode til beregning af den nødvendige jerndosis.
Den nedenfor viste formel er baseret på den tilnærmelse, at 1 mL normocytære, normokromatiske røde blodlegemer indeholder 1 mg elementært jern:
Erstatningsjern (i mg) = Blodtab (i mL) x hæmatokrit
Eksempel: Blodtab på 500 mL med 20 % hæmatokrit
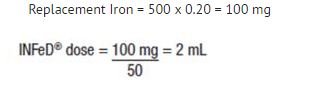
Administrering:
Den samlede mængde Infed, der kræves til behandling af jernmangelanæmi eller jernerstatning ved blodtab, bestemmes ud fra tabellen eller den relevante formel. (Se DOSERING).
1. Intravenøs injektion – INDEN DEN FØRSTE INTRAVENØSE Infed THERAPEUTISK Dosis, INDGIVERES EN INTRAVENØS TESTDOSER PÅ 0,5 ML. ADMINISTRER TESTDOSIS MED EN GRADVIS HASTIGHED OVER MINDST 30 SEKUNDER. Selv om anafylaktiske reaktioner, der vides at forekomme efter indgivelse af Infed, normalt er tydelige inden for få minutter eller hurtigere, anbefales det, at der går en periode på en time eller længere, før resten af den første terapeutiske dosis gives.
Individuelle doser på 2 ml eller mindre kan gives dagligt, indtil den beregnede samlede mængde, der er nødvendig, er nået. Infed gives ufortyndet med en langsom gradvis hastighed, der ikke må overstige 50 mg (1 mL) pr. minut.
2. Intramuskulær injektion – INDEN DEN FØRSTE INTRAMUSKULÆRE TERAPEUTISKE DOSER af Infed INDLÆGES EN INTRAMUSKULÆRE TESTDOSER PÅ 0,5 ML. (Se ADVARSEL OG FORANSTALTNINGER.) Testdosis skal administreres i balden ved hjælp af samme teknik som beskrevet i sidste afsnit i dette afsnit. Selv om anafylaktiske reaktioner, der vides at forekomme efter indgivelse af Infed, normalt er tydelige inden for få minutter eller hurtigere, anbefales det, at der går mindst en time eller længere tid, før resten af den første terapeutiske dosis gives.
Hvis der ikke observeres bivirkninger, kan Infed gives i henhold til følgende skema, indtil den beregnede samlede nødvendige mængde er nået. Hver dagsdosis bør normalt ikke overstige 0,5 mL (25 mg jern) til spædbørn under 5 kg (11 lbs); 1,0 mL (50 mg jern) til børn under 10 kg (22 lbs); og 2,0 mL (100 mg jern) til andre patienter.
Infed bør kun injiceres i muskelmassen i den øverste ydre kvadrant af balden – aldrig i armen eller andre udsatte områder – og bør injiceres dybt med en 2 tommer eller 3 tommer 19 eller 20 gauge-nål. Hvis patienten står, skal han/hun bære sin vægt på det ben, der er modsat injektionsstedet, eller hvis han/hun ligger i sengen, skal han/hun ligge i sideleje med injektionsstedet længst oppe. For at undgå injektion eller lækage i subkutant væv anbefales en Z-track teknik (forskydning af huden lateralt før injektion).
BEMÆRK: Infed må ikke blandes med andre lægemidler eller tilsættes til parenterale ernæringsopløsninger til intravenøs infusion.
Parenterale lægemiddelprodukter skal inspiceres visuelt for partikler og misfarvning før administration, når opløsningen og beholderen tillader det.
Hvordan leveres:
Infed (Iron Dextran Injection USP), der indeholder 50 mg elementært jern pr. mL, fås i 2 mL enkeltdosis amberfarvede hætteglas (til intramuskulær eller intravenøs brug) i kartoner med 10 stk. (NDC 0023-6082-10).
Lagres ved 20 -25°C (68 -77°F) .
Rx Only

For alle medicinske forespørgsler kontakt:
Allergan
Medical Communications
1-800-678-1605
Distribueret af:
Allergan
Medical Communications
1-800-678-1605
Distribueret af:
Allergan USA, Inc.
Madison, NJ 07940
Fremstillet af:
Patheon Italia S.p.A.
Ferentino, Italien 03013
© 2019 Allergan. Alle rettigheder forbeholdes.
Infed® er et registreret varemærke tilhørende Allergan Sales, LLC.
Allergan® og dets design er varemærker tilhørende Allergan, Inc.
Indholdet er opdateret: November 2018
v.1.1USPI6082
Etiketeksempel


| Infed Jern dextran injektion |
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
Mærkningssted – Generelle injektionsvarer & Vacciner, Inc. (108250663)
Mere om Infed (jerndextran)
- Bivirkninger
- Under graviditet eller amning
- Doseringsinformation
- Medikamentinteraktioner
- Prisfastsættelse & Kuponer
- En Español
- Lægemiddelklasse: jernprodukter
Forbrugerressourcer
- Patientinformation
- Infed (Avanceret læsning)
Faglige ressourcer
- Oplysningsinformation
- Jern Hydrogeneret Dextran (FDA)
Andre mærker Dexferrum
Relaterede behandlingsvejledninger
Medicinsk ansvarsfraskrivelse