Generiskt namn: järndextran
Doseringsform: injektion
Medicinskt granskad av Drugs.com. Senast uppdaterad den 1 december 2019.
- Översikt
- Biverkningar
- Dosering
- Professionell
- Interaktioner
- Mer
Reaktioner av anafylaktisk typ, inklusive dödsfall, har följt efter parenteral administrering av järndextraninjektion.
- Har återupplivningsutrustning och personal som är utbildad i upptäckt och behandling av reaktioner av anafylaktisk typ lättillgängliga under administrering av Infed®.
- Administrera en testdos Infed® före den första terapeutiska dosen. Om inga tecken eller symtom på reaktioner av anafylaktisk typ följer på testdosen, administrera hela den terapeutiska Infed®-dosen.
- Under all administrering av Infed®, observera om det finns tecken eller symtom på reaktioner av anafylaktisk typ. Dödliga reaktioner har följt efter testdosen av järndextraninjektion. Dödliga reaktioner har också inträffat i situationer där testdosen tolererades.
- Använd Infed® endast hos patienter hos vilka kliniska och laboratorieundersökningar har fastställt ett järnbristtillstånd som inte är mottagligt för oral järnbehandling.
- Patienter med läkemedelsallergi i anamnesen eller multipla läkemedelsallergier kan löpa en ökad risk för reaktioner av anafylaktisk typ mot Infed®.
- BESKRIVNING:
- KLINISK FARMACOLOGI:
- INDIKATIONER OCH ANVÄNDNING:
- KONTRAINDIKATIONER:
- VARNINGAR:
- Försiktighetsåtgärder:
- Nedbrytande reaktioner:
- ÖVERDOSERING:
- DOSERING OCH ADMINISTRATION:
- HUR DET ÄR FÖRSÖRJAT:
- MÖNSTERSETIKETT
- Mer om Infed (järndextran)
- Konsumentresurser
- Professionella resurser
- Relaterade behandlingsguider
BESKRIVNING:
Infed (Iron Dextran Injection USP) är ett mörkbrunt, lätt visköst sterilt vätskekomplex av järnhydroxid och dextran för intravenös eller intramuskulär användning.
Varje ml innehåller motsvarande 50 mg elementärt järn (som ett järndextran-komplex), cirka 0,9 % natriumklorid, i vatten för injektion. Natriumhydroxid och/eller saltsyra kan ha använts för att justera pH. Lösningens pH är mellan 4,5 och 7,0.
Therapeutisk klass:
KLINISK FARMACOLOGI:
Allmänt: Efter intramuskulär injektion absorberas järendextran från injektionsstället till kapillärerna och lymfsystemet. Cirkulerande järendextran avlägsnas från plasman av celler i det retikuloendoteliala systemet, som delar upp komplexet i dess komponenter järn och dextran. Järnet binds omedelbart till tillgängliga proteinkomponenter för att bilda hemosiderin eller ferritin, de fysiologiska formerna av järn, eller i mindre utsträckning till transferrin. Detta järn som är föremål för fysiologisk kontroll fyller på hemoglobin och utarmade järndepåer.
Dextran, en polyglukos, metaboliseras eller utsöndras. Försumbara mängder järn förloras via urin- eller matsmältningsvägarna efter administrering av järendextran.
Den största delen av intramuskulära injektioner av järendextran absorberas inom 72 timmar; det mesta av det återstående järnet absorberas under de efterföljande 3 till 4 veckorna.
Flera studier med intravenöst administrerat 59Fe-järndextran till järnbristande personer, varav några hade samtidiga sjukdomar, har gett halveringsvärden som sträcker sig från 5 timmar till mer än 20 timmar. Värdet på 5 timmar fastställdes för 59Fe-järndextran från en studie där laboratoriemetoder användes för att separera det cirkulerande 59Fe-järndextranet från det transferrinbundna 59Fe. 20-timmarsvärdet återspeglar en halveringstid som bestämts genom att mäta totalt 59Fe, både cirkulerande och bundet. Man bör vara medveten om att dessa halveringstider inte representerar clearance av järn från kroppen. Järn elimineras inte lätt från kroppen och ackumulering av järn kan vara toxiskt.
In vitro-studier har visat att avlägsnandet av järendextran genom dialys är försumbart.1,2 Sex olika dialysatormembran undersöktes (polysulfon, cuprofan, cellulosaacetat, cellulosatriacetat, polymetylmetakrylat och polyakrylonitril), inklusive de som anses ha hög effektivitet och högt flöde.
INDIKATIONER OCH ANVÄNDNING:
Intravenösa eller intramuskulära injektioner av Infed är indicerade för behandling av patienter med dokumenterad järnbrist hos vilka oral administrering är otillfredsställande eller omöjlig.
KONTRAINDIKATIONER:
Överkänslighet mot produkten. Alla anemier som inte är associerade med järnbrist.
VARNINGAR:
Risk för reaktioner av anafylaktisk typ: Reaktioner av anafylaktisk typ, inklusive dödsfall har följt efter parenteral administrering av järndextran. Ha alltid återupplivningsutrustning och personal som är utbildad i upptäckt och behandling av reaktioner av anafylaktisk typ lättillgängliga under Infed-administrationen. Före den första terapeutiska dosen ska en testdos Infed på 0,5 ml administreras. (Se DOSERING OCH ADMINISTRATION.) Även om reaktionerna vanligtvis är uppenbara inom några minuter, observera patienterna i minst en timme innan den terapeutiska dosen administreras. Under alla Infed-administrationer, observera patienterna för tecken eller symtom på reaktioner av anafylaktisk typ. Dödliga reaktioner har följt efter testdosen av järndextran och har även inträffat i situationer där testdosen tolererades. Använd Infed endast hos patienter hos vilka kliniska och laboratorieundersökningar har fastställt ett järnbristtillstånd som inte är mottagligt för oral järnbehandling.
De faktorer som påverkar risken för reaktioner av anafylaktisk typ på järndextranprodukter är inte helt kända, men begränsade kliniska data tyder på att risken kan vara förhöjd hos patienter med anamnestisk läkemedelsallergi eller multipla läkemedelsallergier. Dessutom kan samtidig användning av läkemedel som hämmar angiotensinkonverterande enzymer öka risken för reaktioner på en järndextranprodukt. Omfattningen av risken för reaktioner av anafylaktisk typ efter exponering för en specifik järndextranprodukt är okänd och kan variera mellan produkterna.
Järndextranprodukter skiljer sig åt vad gäller kemiska egenskaper och kan skilja sig åt vad gäller kliniska effekter. Järendextranprodukter är inte kliniskt utbytbara.
Detaljerade reaktioner: Stora intravenösa doser, såsom de som används vid totaldosinfusioner (TDI), har förknippats med en ökad förekomst av biverkningar. Biverkningarna är ofta fördröjda (1-2 dagar) reaktioner som kännetecknas av ett eller flera av följande symtom: arthralgi, ryggvärk, frossa, yrsel, måttlig till hög feber, huvudvärk, illamående, myalgi, illamående och kräkningar. Debuten är vanligen 24-48 timmar efter administrering och symtomen avtar i allmänhet inom 3-4 dagar. Etiologin för dessa reaktioner är inte känd. Potentialen för en fördröjd reaktion måste beaktas vid uppskattning av risk/nytta med behandlingen.
Den maximala dagliga dosen bör inte överstiga 2 ml outspädd järndextran.
Risk hos patienter med underliggande tillstånd: Infed ska användas med yttersta försiktighet hos patienter med allvarligt nedsatt leverfunktion. Det ska inte användas under den akuta fasen av infektiös njursjukdom.
Biverkningar som upplevs efter administrering av Infed kan förvärra kardiovaskulära komplikationer hos patienter med redan befintlig kardiovaskulär sjukdom.
Carcinogenes: En risk för karcinogenes kan följa med den intramuskulära injektionen av järn-kolhydratkomplex. Sådana komplex har under experimentella förhållanden visat sig ge sarkom när stora doser eller små doser som injicerades upprepade gånger på samma ställe gavs till råttor, möss och kaniner och möjligen till hamstrar.
Den långa latenta perioden mellan injektionen av en potentiell carcinogen och uppkomsten av en tumör gör att det är omöjligt att exakt mäta risken hos människan. Det har dock funnits flera rapporter i litteraturen som beskriver tumörer på injektionsstället hos människor som tidigare fått intramuskulära injektioner av järnkolhydratkomplex.
Försiktighetsåtgärder:
Allmänt: Obefogad behandling med parenteralt järn kommer att orsaka överskottslagring av järn med den därav följande möjligheten till exogen hemosideros. Sådan järnöverbelastning är särskilt benägen att inträffa hos patienter med hemoglobinopatier och andra refraktära anemier som felaktigt kan diagnostiseras som järnbristanemi.
Infed ska användas med försiktighet hos personer med historik av betydande allergier och/eller astma. Anafylaxi och andra överkänslighetsreaktioner har rapporterats efter händelselösa testdoser såväl som terapeutiska doser av järndextraninjektion. Administrera därför en testdos före den första terapeutiska dosen av Infed. (Se VARNINGSFÖRTECKNING och DOSERING OCH ADMINISTRATION: ADMINISTRATION.)
Epinefrin ska vara omedelbart tillgängligt vid akuta överkänslighetsreaktioner. (Vanlig vuxendos: 0,5 ml av en lösning 1:1000, genom subkutan eller intramuskulär injektion). Anmärkning: Patienter som använder betablockerare kanske inte svarar adekvat på adrenalin. Isoproterenol eller liknande beta-agonistmedel kan krävas hos dessa patienter.
Patienter med reumatoid artrit kan få en akut exacerbation av ledvärk och svullnad efter administrering av Infed.
Rapporter i litteraturen från länder utanför USA (särskilt Nya Zeeland) har antytt att användningen av intramuskulärt järendextran hos nyfödda har varit förknippad med en ökad incidens av gramnegativ sepsis, främst på grund av E. Coli.
Information till patienterna: Patienter bör informeras om de potentiella biverkningar som är förknippade med användningen av Infed.
Läkemedels-/laboratorietestinteraktioner: Stora doser av järndextran (5 mL eller mer) har rapporterats ge en brun färg till serum från ett blodprov som tagits 4 timmar efter administrering.
Läkemedlet kan orsaka falskt förhöjda värden av serumbilirubin och falskt sänkta värden av serumkalcium. Serumjärnbestämningar (särskilt genom kolorimetriska analyser) kan vara meningslösa under 3 veckor efter administrering av järendextran.
Serumferritin når en topp ungefär 7 till 9 dagar efter en intravenös dos av Infed och återgår långsamt till baslinjen efter ungefär 3 veckor.
Undersökning av benmärgen med avseende på järndepåer kan vara meningslös under längre perioder efter behandling med järendextran, eftersom kvarvarande järendextran kan finnas kvar i de retikuloendoteliala cellerna.
Benskörningar med 99m Tc-difosfonat har rapporterats visa ett tätt, halvmåneformigt aktivitetsområde i skinkan, som följer konturen av iliac crest, 1 till 6 dagar efter intramuskulära injektioner av järendextran.
Benscanningar med 99m Tc-märkta bensökande medel, i närvaro av höga serumferritinnivåer eller efter järndextraninfusioner, har rapporterats visa minskad benupptagning, markerad njuraktivitet och överdriven blodpool- och mjukvävnadsackumulering.
Karcinogenes, mutagenes, försämrad fertilitet: Se Varningar.
Graviditet: Järendextran har visat sig vara teratogent och embryocidalt hos möss, råttor, kaniner, hundar och apor när det ges i doser som är ungefär 3 gånger högre än den maximala dosen för människor.
Ingen konsekventa negativa effekter på foster har observerats hos möss, råttor, kaniner, hundar och apor vid doser på 50 mg järn/kg eller mindre. Fetal och maternell toxicitet har rapporterats hos apor vid en total intravenös dos på 90 mg järn/kg under en 14-dagarsperiod. Liknande effekter observerades hos möss och råttor vid administrering av en engångsdos på 125 mg järn/kg. Fosteranomalier hos råttor och hundar observerades vid doser på 250 mg järn/kg och högre. Djuren som användes i dessa tester var inte järnfattiga. Det finns inga adekvata och välkontrollerade studier på gravida kvinnor. Infed bör användas under graviditet endast om den potentiella nyttan motiverar den potentiella risken för fostret.
Placental överföring: Olika djurstudier och studier på gravida människor har visat på icke entydiga resultat när det gäller placenta-överföring av järndextran som järndextran. Det verkar som om en del järn når fostret, men i vilken form det passerar placentan är oklart.
Sjuksköterskor: Försiktighet bör iakttas när Infed administreras till en ammande kvinna. Spår av ometaboliserat järendextran utsöndras i mänsklig mjölk.
Pediatrisk användning: Rekommenderas inte för användning till spädbarn under 4 månader. (Se DOSERING OCH ADMINISTRATION.)
Nedbrytande reaktioner:
Svårt/dödligt: Anafylaktiska reaktioner har rapporterats i samband med användning av injektion av järendextran; vid enstaka tillfällen har dessa reaktioner varit dödliga. Sådana reaktioner, som oftast inträffar inom de första minuterna efter administrering, har i allmänhet kännetecknats av plötsligt insättande av andningssvårigheter och/eller kardiovaskulär kollaps. Eftersom dödliga anafylaktiska reaktioner har rapporterats efter administrering av järndextraninjektion bör läkemedlet endast ges när återupplivningstekniker och behandling av anafylaktisk och anafylaktoid chock är lättillgängliga. (Se VARNINGSFÖRSLAG och FÖRSKRITIGHETER:
Kardiovaskulärt: Bröstsmärta, trånghet i bröstet, chock, hjärtstillestånd, hypotoni, hypertoni, takykardi, bradykardi, rodnad, arytmier. (Rödhet och hypotoni kan uppstå vid för snabba injektioner via intravenös väg.)
Dermatologiskt: Urtikaria, pruritus, purpura, utslag, cyanos.
Gastrointestinal:
Hematologiskt/lymfatiskt: Abdominal smärta, illamående, kräkningar, diarré: Leukocytos, lymfadenopati.
Muskuloskeletala/ mjuka vävnader: Arthralgi, artrit (kan representera reaktivering hos patienter med vilande reumatoid artrit – se VIKTIGHETER: Allmänt), myalgi; ryggvärk; steril abscess, atrofi/fibros (intramuskulärt injektionsställe); brun missfärgning (färgning) av hud och/eller underliggande vävnad, ömhet eller smärta vid eller i närheten av intramuskulära injektionsställen; cellulit; svullnad; inflammation; lokal flebit vid eller i närheten av intravenöst injektionsställe.
Neurologiskt: Konvulsioner, kramper, synkope, huvudvärk, svaghet, bristande reaktionsförmåga, parestesi, feberepisoder, frossa, yrsel, desorientering, domningar, medvetslöshet.
Respiratoriskt: Respiratoriskt: Andningsstopp, dyspné, bronkospasm, väsande andning.
Urologiskt: Hematuri.
Fördröjda reaktioner: Arthralgi, ryggvärk, frossa, yrsel, feber, huvudvärk, illamående, myalgi, illamående, kräkningar. (Se Varningar).
Diverse: Febril episoder, svettning, rysning, frossa, illamående, förändrad smak.
ÖVERDOSERING:
Överdosering med järendextran är osannolikt förknippad med några akuta manifestationer. Doser av järndextran som överstiger kraven för återställande av hemoglobin och påfyllning av järndepåer kan leda till hemosideros. Periodisk övervakning av serumferritinnivåer kan vara till hjälp för att upptäcka en skadlig progressiv ackumulering av järn till följd av försämrat upptag av järn från det retikuloendoteliala systemet vid samtidiga medicinska tillstånd som kronisk njursvikt, Hodgkins sjukdom och reumatoid artrit. LD50 för järndextran är inte mindre än 500 mg/kg hos musen.
DOSERING OCH ADMINISTRATION:
Oralt järn ska avbrytas före administrering av Infed.
Dosering:
I. Järnbristanemi: Periodisk hematologisk bestämning (hemoglobin och hematokrit) är en enkel och noggrann teknik för att övervaka det hematologiska svaret och bör användas som vägledning i behandlingen. Man bör vara medveten om att järninlagring kan släpa efter förekomsten av normal blodmorfologi. Serumjärn, total järnbindningskapacitet (TIBC) och procentuell mättnad av transferrin är andra viktiga tester för att upptäcka och övervaka järnbristtillstånd.
Efter administrering av järndextran-komplex kan bevis på ett terapeutiskt svar ses inom några dagar i form av en ökning av antalet retikulocyter.
Men även om serumferritin vanligtvis är en god vägledning för kroppens järnförråd, är korrelationen mellan kroppens järnförråd och serumferritin kanske inte giltig hos patienter med kronisk njurdialys som också får järndextrankomplex.
Men även om det finns betydande variationer i kroppsstorlek och viktfördelning bland män och kvinnor utgör den medföljande tabellen och formeln ett bekvämt sätt att uppskatta det totala järnbehovet. Detta totala järnbehov återspeglar den mängd järn som behövs för att återställa hemoglobinkoncentrationen till normala eller nära normala nivåer plus ett extra tillskott för att ge adekvat påfyllning av järndepåerna hos de flesta individer med måttligt eller kraftigt nedsatt hemoglobinhalt. Man bör komma ihåg att järnbristanemi inte uppträder förrän i stort sett alla järndepåer har tömts. Terapin bör därför syfta till att inte bara fylla på hemoglobinjärnet utan även järnlagren.
Faktorer som bidrar till formeln visas nedan.
 Baserat på ovanstående faktorer kommer individer med normala hemoglobinnivåer att ha cirka 33 mg järn i blodet per kilo kroppsvikt (15 mg/lb).
Baserat på ovanstående faktorer kommer individer med normala hemoglobinnivåer att ha cirka 33 mg järn i blodet per kilo kroppsvikt (15 mg/lb).
Anmärkning: Tabellen och den medföljande formeln kan endast användas för doseringsbestämningar hos patienter med järnbristanemi; de ska inte användas för doseringsbestämningar hos patienter som behöver järnersättning för blodförlust.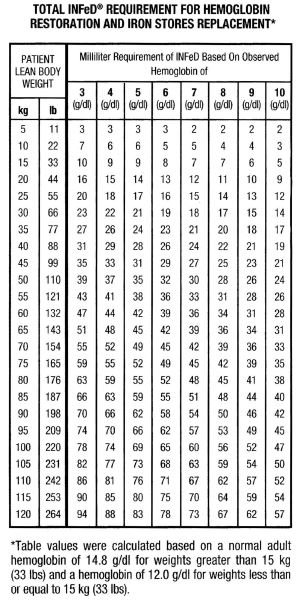
Den totala mängden Infed i mL som krävs för att behandla anemin och fylla på järndepåerna kan uppskattas på följande sätt:
II. Järnersättning vid blodförlust: Vissa personer drabbas av blodförlust med jämna mellanrum eller vid upprepade tillfällen. Sådana blodförluster kan inträffa periodiskt hos patienter med hemorragiska diater (familjär telangiektasi; hemofili; gastrointestinal blödning) och på upprepad basis från förfaranden som renal hemodialys.
Järnterapi hos dessa patienter bör inriktas på att ersätta den motsvarande mängd järn som representeras i blodförlusten. Tabellen och formeln som beskrivs under I. Järnbristanemi är inte tillämpliga för enkla järnersättningsvärden.
Kvantitativa uppskattningar av individens periodiska blodförlust och hematokrit under blödningsepisoden ger en bekväm metod för beräkning av erforderlig järndos.
Formeln som visas nedan är baserad på approximationen att 1 mL normocytära, normokroma erytrocyter innehåller 1 mg elementärt järn:
Ersättningsjärn (i mg) = Blodförlust (i mL) x hematokrit
Exempel: Blodförlust 500 ml med 20 % hematokrit
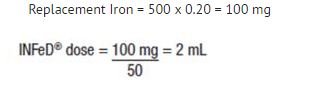
Administrering:
Den totala mängden Infed som krävs för behandling av järnbristanemi eller järnersättning vid blodförlust bestäms utifrån tabellen eller lämplig formel. (Se dosering).
1. Intravenös injektion – INNAN DEN FÖRSTA INTRAVENÖA DOSEN Infed THERAPEUTIC DOSE, GIV EN INTRAVENÖA TESTDOS AV 0,5 ML. ADMINISTRERA TESTDOSEN I EN GRADVIS TAKT UNDER MINST 30 SEKUNDER. Även om anafylaktiska reaktioner som är kända för att inträffa efter administrering av Infed vanligtvis är uppenbara inom några minuter, eller tidigare, rekommenderas att en period på en timme eller längre förflyter innan resten av den första terapeutiska dosen ges.
Enskilda doser på 2 ML eller mindre kan ges dagligen tills den beräknade totala mängden som krävs har uppnåtts. Infed ges outspädd i en långsam gradvis hastighet som inte får överstiga 50 mg (1 mL) per minut.
2. Intramuskulär injektion – INNAN DEN FÖRSTA INTRAMUSKULÄRTERAPETISKA DOSEN Infed, GIV EN INTRAMUSKULÄR TESTDOS AV 0,5 ML. (Se VARNINGSFÖRTECKNING och FÖRSKRITIGHETER.) Testdosen ska administreras i skinkan med samma teknik som beskrivs i sista stycket i detta avsnitt. Även om anafylaktiska reaktioner som är kända för att inträffa efter administrering av Infed vanligtvis är uppenbara inom några minuter eller tidigare, rekommenderas att minst en timme eller längre tid förflyter innan resten av den första terapeutiska dosen ges.
Om inga biverkningar observeras kan Infed ges enligt följande schema tills den beräknade totala mängden som krävs har uppnåtts. Varje dagsdos bör normalt inte överstiga 0,5 ml (25 mg järn) för spädbarn under 5 kg (11 lbs), 1,0 ml (50 mg järn) för barn under 10 kg (22 lbs) och 2,0 ml (100 mg järn) för övriga patienter.
Infed ska injiceras endast i muskelmassan i den övre yttre kvadranten av skinkan – aldrig i armen eller andra utsatta områden – och ska injiceras djupt, med en 2-tums eller 3-tums 19 eller 20 gauge nål. Om patienten står ska han/hon bära sin vikt på benet mittemot injektionsstället, eller om han/hon ligger i sängen ska han/hon ligga i sidoläge med injektionsstället överst. För att undvika injektion eller läckage i subkutan vävnad rekommenderas en Z-spårteknik (förskjutning av huden i sidled före injektion).
OBSERVERA: Blanda inte Infed med andra läkemedel och tillsätt inte Infed till parenterala nutritionslösningar för intravenös infusion.
Parenterala läkemedelsprodukter ska inspekteras visuellt för partiklar och missfärgningar före administrering, när lösningen och behållaren så tillåter.
HUR DET ÄR FÖRSÖRJAT:
Infed (Iron Dextran Injection USP) som innehåller 50 mg elementärt järn per ml, finns tillgängligt i 2 ml bärnstensfärgade injektionsflaskor för engångsdos (för intramuskulär eller intravenös användning) i kartonger om 10 stycken (NDC 0023-6082-10).
Lagra vid 20 -25°C (68 -77°F) .
Rx Only

För alla medicinska förfrågningar kontakta:
Allergan
Medical Communications
1-800-678-1605
Distributed by:
Allergan USA, Inc.
Madison, NJ 07940
Hanterat av:
Patheon Italia S.p.A.
Ferentino, Italien 03013
© 2019 Allergan. Alla rättigheter förbehållna.
Infed® är ett registrerat varumärke som tillhör Allergan Sales, LLC.
Allergan® och dess design är varumärken som tillhör Allergan, Inc.
Innehåll uppdaterat: November 2018
v.1.1USPI6082
MÖNSTERSETIKETT


| Infed järn dextran injektion |
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
Etikett – Allmänna injektionsartiklar & Vacciner, Inc. (108250663)
Mer om Infed (järndextran)
- Biverkningar
- Under graviditet eller amning
- Doseringsinformation
- Läkemedelsinteraktioner
- Prissättning & Kuponger
- En Español
- Läkemedelsklass: Järnprodukter
Konsumentresurser
- Patientinformation
- Infed (Avancerad läsning)
Professionella resurser
- Ordineringsinformation
- Järn Hydrogenated Dextran (FDA)
Andra varumärken Dexferrum
Relaterade behandlingsguider
- Anemi associerad med kronisk njursvikt
- Ironbristanemi
Medicinsk ansvarsfriskrivning