Det kemiske grundstof klor er klassificeret som halogen og et nonmetal. Det blev opdaget i 1774 af Carl Wilhelm Scheele.

Datazone
| Klassifikation: | Klor er et halogen og et ikke-metal | |
| Farve: | grønlig-gul | |
| Atomvægt: | 35.453 | |
| Status: | gas | |
| Smeltepunkt: | -101 oC , 172 K | |
| Skoldningspunkt: | -34 oC , 239 K | |
| Elektroner: | 17 | |
| Protoner: | 17 | |
| Protoner: | 17 | |
| Neutroner i den hyppigste isotop: | 18 | |
| Elektronskaller: | 18 | |
| Elektronskaller: | 2,8,7 | |
| Elektronkonfiguration: | 1s2 2s2 2p6 3s2 3p5 | |
| Densitet @ 20oC: | 0.003214 g/cm3 |
Vis flere, herunder: Varme, energi, oxidation, reaktioner,
forbindelser, radier, ledningsevner
| Atomvolumen: | 22,7 cm3/mol | |
| Struktur: | lag af Cl2 i fast stof | |
| Hårdhed: | Hårdhed: | |
| Specifik varmekapacitet | 0,48 J g-1 K-1 | |
| Smeltningsvarme | 6.406 kJ mol-1 af Cl2 | |
| Forstøvningsvarme | 122 kJ mol-1 | |
| Fordampevarme | 20.41 kJ mol-1 af Cl2 | |
| 1. ioniseringsenergi | 1251,1 kJ mol-1 | |
| 2. ioniseringsenergi | 2297.3 kJ mol-1 | |
| 3. ioniseringsenergi | 3821.8 kJ mol-1 | |
| Elektronaffinitet | 349 kJ mol-1 | |
| Minimum oxidationstal | -1 | |
| Min. fælles oxidationsnummer | -1 | |
| Maksimalt oxidationsnummer | 7 | |
| Maksimalt fælles oxidationsnummer | ||
| Maks. | 7 | |
| Elektronegativitet (Pauling-skalaen) | 3,16 | |
| Polarisérbarhedsmængde | 2.2 Å3 | |
| Reaktion med luft | ingen | |
| Reaktion med 15 M HNO3 | mild, ⇒ HClOx, NOxCl, NOx | |
| Reaktion med 6 M HCl | mild, ⇒ HOCl, Cl- | |
| Reaktionen med 6 M NaOH | mild, ⇒ OCl-, Cl- | |
| Oxid(er) | Cl2O, ClO2, Cl2O7 | |
| Hydrid(er) | HCl | |
| Chlorid(er) | Cl2 | |
| Atomradius | 100 pm | |
| Ionisk(e) radius (1+ ion) | – | |
| Ionisk radius (2+ ion) | – | |
| Ionisk radius (3+ ion) | – | |
| Ionisk radius (1- ion) | 167 pm | |
| Ionisk radius (2-ion) | – | |
| Ionisk radius (3-ion) | – | |
| Varmeledningsevne | 0.0089 W m-1 K-1 | |
| Elektrisk ledningsevne | – | |
| Frost-/smeltepunkt: | -101 oC , 172 K |

Klor i reagensglas (Foto: Ben Mills)
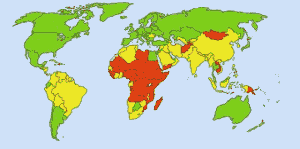
Sikkert drikkevand:

Sikkert drikkevand: Billede: Ionut_Cojocaru. I grønne områder kan alle få sikkert vand. I de røde områder kan mindst 25 procent af befolkningen ikke få behandlet vand. Gule områder er mellemliggende. Før den rutinemæssige anvendelse af klor i USA’s vandforsyninger krævede tyfus 25 000 dødsfald hvert år. I dag er 98 % af de offentlige vandforsyninger behandlet med klor eller en klorforbindelse. Tyfusfeber kræver nu i gennemsnit omkring et offer om året. (4)

Carl Wilhelm Scheele, der opdagede klor i 1774.
Offentliggørelse af klor
Klor blev først fremstillet i 1774 af Carl Wilhelm Scheele i Sverige. Scheele opsamlede den gas, der blev frigivet ved reaktionen af pyrolusit med spiritus salis – et alkymistisk udtryk, der betyder ånd/udånding af salt. Den nye gas havde ifølge Scheele “en meget mærkbar kvælende lugt, som var meget undertrykkende for lungerne … og giver vandet en let syrlig smag … luften i det får en gul farve …”. (1)
Scheele bemærkede også den høje reaktivitet og de blegende egenskaber ved den nye gas, som han havde fremstillet: “… alle metaller blev angrebet… fast alkali blev omdannet til almindeligt salt… alle vegetabilske blomster – røde, blå og gule – blev hvide i løbet af kort tid; det samme skete også med grønne planter… insekter døde straks. (1)
På trods af nøjagtigheden af hans observationer troede Scheele fejlagtigt, at den nye gas var en dephlostiganeret form af muriatsyre.
Den berømte franske kemiker Antoine Lavoisier mente, at den nye gas burde kaldes oxymuriatsyre baseret på det endnu ikke opdagede grundstof murium. (2)
* Forvirringen om klors sande identitet skyldtes phlogiston-teorien; phlogiston havde været accepteret af kemikere i det meste af 1700-tallet – indtil Lavoisier selv afkræftede den. Phlogiston var et “stof”, der blev brugt til at forklare det dengang uforklarlige. Det havde praktisk nok negativ vægt, når det var nødvendigt, og “forklarede” reaktioner som rust og forbrænding.
Lavoisier var arkitekten bag phlogistons undergang, idet han viste, at iltens kemi var en bedre forklaring på kemiske reaktioner end phlogiston var. (3)
I 1810 var der videnskabelig konsensus om, at det grundstof, vi nu kalder klor, faktisk var en forbindelse, der indeholdt ilt. Den engelske kemiker Sir Humphry Davy fandt ud af, at konsensus var forkert; han kunne ikke få den nye gulgrønne gas til at reagere med en kulelektrode, hvilket fik ham til at tro, at den måske ikke indeholdt ilt. Ved reaktioner med fosfor og ammoniak viste han, at den nye gas ikke indeholdt ilt. Han brugte en kæmpestor, 2000 pladevoltacelle for at se, om han kunne udvinde ilt fra gassens fosfor- og svovlforbindelser, men igen fandt han ingen ilt. (1a)
I 1811 konkluderede Davy, at den nye gas i virkeligheden var et nyt grundstof. (1b) Han gav det navnet klor, fra det græske ord ‘chloros’, der betyder lysegrøn eller gulgrøn.
Interessante fakta om klor
- Den første kædereaktion, der blev opdaget, var ikke en atomreaktion; det var en kemisk kædereaktion. Den blev opdaget i 1913 af Max Bodenstein, som så en blanding af klor- og brintgasser eksplodere, når den blev udløst af lys. Kædereaktionsmekanismen blev fuldt ud forklaret i 1918 af Walther Nernst.
- Der er en stor mængde klor i Jordens oceaner. Hvis dette klor blev frigivet som en gas, ville dets vægt være 5 gange større end Jordens samlede nuværende atmosfære. (Vores oceaner indeholder ca. 2,6 x 1016 tons klor, hovedsagelig i form af natriumchlorid.)
- Klor er ikke kun rigeligt til stede i vores oceaner; det er det sjette hyppigste grundstof i Jordens skorpe.
- Eksponering for små mængder klor, selv i kort tid, kan være dødbringende. Der forventes dødsfald ved 1 promille klor i luften (eller nogle gange ved endnu lavere koncentrationer). (5)
- Klor er tungere end luft. Når det frigives, danner det et giftigt tæppe, der driver med vinden. Klor blev brugt som kemisk våben under Første Verdenskrig, først i 1915 af den tyske hær og derefter af de vestlige allierede. Det var ikke så “effektivt”, som man havde håbet, fordi klor let kan opdages på grund af sin stærke lugt. Det er også vandopløseligt, og soldaterne kunne derfor beskytte sig mod de værste virkninger ved at trække vejret gennem fugtige klude.

Udseende og karakteristika
Skadelige virkninger:
Klor er en giftig gas, der irriterer huden, øjnene og åndedrætsorganerne.
Egenskaber:
Klor er en grønlig-gul, toatomig, tæt gas med en skarp lugt (lugten af blegemiddel).
Det findes ikke frit i naturen, da det let kombineres med næsten alle andre grundstoffer.
Klor forekommer i naturen hovedsageligt som almindeligt salt (NaCl), carnallit , og sylvit (KCl).
I flydende og fast form er det et kraftigt blegnings-, oxidations- og desinfektionsmiddel.
Anvendelser af klor
Klor anvendes til fremstilling af sikkert drikkevand.
Klorforbindelser anvendes især til sanering, blegning af papirmasse, desinfektionsmidler og tekstilbehandling.
Klor anvendes også til fremstilling af chlorater, og det er vigtigt i organisk kemi, idet det danner forbindelser som chloroform, tetrachlormethan, polyvinylchlorid og syntetisk gummi.
Andre anvendelser af klorforbindelser omfatter farvestoffer, olieprodukter, lægemidler, antiseptika, insekticider, fødevarer, opløsningsmidler, maling og plastik.
Forsyning og isotoper
Forsyning jordskorpen: 145 vægtdele pr. million, 85 moldele pr. million
Forsyning solsystemet: 8 vægtdele pr. million, 0,3 moldele pr. million
Omkostninger, ren: $0,15 pr. 100 g
Omkostninger, bulk: $ pr. 100 g
Kilde: Klorgas fremstilles kommercielt ved elektrolyse af natriumklorid (NaCl) fra havvand eller saltlage fra saltminer.
Isotoper: Klor har 16 isotoper, hvis halveringstider er kendt, med massetal 31 til 46. Naturligt forekommende klor er en blanding af de to stabile isotoper 35Cl og 37Cl med naturlige hyppigheder på henholdsvis 75,8 % og 24,3 %.

- Henry M. Leicester, Herbert S. Klickstein, A Source Book in Chemistry, 1400-1900., (1969) Harvard University Press. s111; 1a. s241.; 1b. s257.
- J.W. Mellor, A Comprehensive Treatise on Inorganic and Theoretical Chemistry., 1922, bd. 2, Longmans, Green and Co., s21.
- Antoine Lavoisier, Memoires de l’ Academie royale des sciences 1783., 1786, s505-538.
- The Chlorine Tree.
- OSHA, Occupational Safety and Health Guideline for Chlorine.
Citér denne side
For online linking, please copy and paste one of the following:
<a href="https://www.chemicool.com/elements/chlorine.html">Chlorine</a>
or
<a href="https://www.chemicool.com/elements/chlorine.html">Chlorine Element Facts</a>
To cite this page in a academic document, please use the following MLA compliant citation:
"Chlorine." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/chlorine.html>.