Elementul chimic clor este clasificat ca fiind un halogen și un nemetal. A fost descoperit în 1774 de Carl Wilhelm Scheele.

Zona de date
| Clasificare: | Clorul este un halogen și un nemetal | |
| Culoare: | galben-verzui | |
| Greutate atomică: | 35.453 | |
| Stare: | gaz | |
| Punctul de topire: | -101 oC , 172 K | |
| Punctul de fierbere: | ||
| Punctul de fierbere: | ||
| Punctul de fierbere: | : | -34 oC , 239 K |
| Electroni: | 17 | |
| Protoni: | 17 | |
| Neutroni în cel mai abundent izotop: | 18 | |
| Capacele de electroni: | 2,8,7 | |
| Configurația electronilor: | 1s2 2s2 2p6 3s2 3p5 | |
| Densitate la 20oC: | 0.003214 g/cm3 |
Afișați mai multe, inclusiv: Călduri, Energii, Oxidare, Reacții,
Compuși, Radii, Conductivități
| Volumetrie atomică: | 22,7 cm3/mol | |
| Structură: | straturi de Cl2 în solid | |
| Durețe: | ||
| Capacitatea termică specifică | 0,48 J g-1 K-1 | |
| Căldura de fuziune | 6.406 kJ mol-1 de Cl2 | |
| Căldura de atomizare | 122 kJ mol-1 | |
| Căldura de vaporizare | 20.41 kJ mol-1 de Cl2 | |
| 1-a energie de ionizare | 1251,1 kJ mol-1 | |
| 2-a energie de ionizare | 2297.3 kJ mol-1 | |
| 3-a energie de ionizare | 3821.8 kJ mol-1 | |
| Afinitatea electronică | 349 kJ mol-1 | |
| Numărul minim de oxidare | -1 | |
| Min. număr de oxidare comun | -1 | |
| Număr maxim de oxidare | 7 | |
| Număr maxim de oxidare comun | ||
| Număr maxim de oxidare comun. | 7 | |
| Electronegativitate (scara Pauling) | 3,16 | |
| Volum de polarizabilitate | 2.2 Å3 | |
| Reacție cu aerul | niciuna | |
| Reacție cu HNO3 15 M | ușoară, ⇒ HClOx, NOxCl, NOx | |
| Reacție cu HCl 6 M | ușoară, ⇒ HOCl, Cl- | |
| Reacția cu 6 M NaOH | ușoară, ⇒ OCl-, Cl- | |
| Oxid(i) | Cl2O, ClO2, Cl2O7 | |
| Hidrură(s) | HCl | |
| Clorură(s) | Cl2 | |
| Rază atomică | 100 pm | |
| Ionic (1+ ion) | – | |
| Rază ionică (2+ ion) | – | |
| Rază ionică (3+ ion) | – | |
| Rază ionică (1- ion) | 167 pm | |
| Raza ionică (ion 2-) | – | |
| Raza ionică (ion 3-) | – | |
| Conductivitatea termică | 0.0089 W m-1 K-1 | |
| Conductivitate electrică | – | |
| Punctul de congelare/topire: | ||
| Punctul de congelare/fundare: | -101 oC , 172 K |

Clor în eprubetă (Foto: Ben Mills)
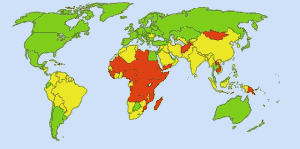
Apă potabilă sigură: Imagine: Ionut_Cojocaru. În zonele verzi toată lumea poate obține apă sigură. În zonele roșii, cel puțin 25 la sută dintre oameni nu pot obține apă tratată. Zonele galbene sunt intermediare. Înainte de utilizarea de rutină a clorului în rezervele de apă din SUA, febra tifoidă făcea 25 000 de morți în fiecare an. Astăzi, 98% din rezervele publice de apă sunt tratate cu clor sau cu un compus de clor. În prezent, febra tifoidă face, în medie, aproximativ o victimă pe an. (4)

Carl Wilhelm Scheele, care a descoperit clorul în 1774.
Descoperirea clorului
Clorul a fost produs pentru prima dată în 1774 de Carl Wilhelm Scheele în Suedia. Scheele a colectat gazul eliberat de reacția pirolusitului cu spiritus salis – un termen alchimic care înseamnă spirit/suflet de sare. Noul gaz avea, potrivit lui Scheele, „un miros sufocant foarte perceptibil, care era foarte opresiv pentru plămâni… și dă apei un gust ușor acid… aerul din ea capătă o culoare galbenă…”. (1)
Scheele a remarcat, de asemenea, reactivitatea ridicată și calitățile de înălbire ale noului gaz pe care îl fabricase: „…toate metalele au fost atacate… alcali fix a fost transformat în sare comună… toate florile vegetale – roșii, albastre și galbene – au devenit albe în scurt timp; același lucru s-a întâmplat și cu plantele verzi… insectele au murit imediat. (1)
În ciuda acurateței observațiilor sale, Scheele a crezut, în mod eronat, că noul gaz era o formă desființată a acidului muriatic.
Celebrul chimist francez Antoine Lavoisier credea că noul gaz ar trebui să se numească acid oximuriatic, pe baza elementului încă nedescoperit murium. (2)
* Confuzia cu privire la adevărata identitate a clorului a fost cauzată de teoria flogistonului; flogistonul fusese acceptat de chimiști în cea mai mare parte a anilor 1700 – până când Lavoisier însuși a demascat-o. Flogistonul era o „substanță” folosită pentru a explica inexplicabilul de atunci. În mod convenabil, avea o greutate negativă atunci când era nevoie și „explica” reacții precum ruginirea și arderea.
Lavoisier a fost arhitectul căderii flogistonului, arătând că chimia oxigenului era o explicație mai bună în reacțiile chimice decât era flogistonul. (3)
Până în 1810, consensul științific era că elementul pe care acum îl numim clor era de fapt un compus care conținea oxigen. Chimistul englez Sir Humphry Davy a constatat că consensul era greșit; el nu a putut face ca noul gaz galben-verzui să reacționeze cu un electrod de cărbune, ceea ce l-a făcut să creadă că este posibil să nu conțină oxigen. În reacții cu fosfor și amoniac, el a demonstrat că noul gaz nu conținea oxigen. A folosit o grămadă uriașă de 2000 de plăci voltaice pentru a vedea dacă poate extrage oxigenul din compușii de fosfor și sulf ai gazului, dar, din nou, nu a găsit oxigen. (1a)
În 1811, Davy a concluzionat că noul gaz era, de fapt, un element nou. (1b) L-a numit clor, de la cuvântul grecesc „chloros”, care înseamnă verde pal sau verde-gălbui.
Fapte interesante despre clor
- Prima reacție în lanț descoperită nu a fost o reacție nucleară; a fost o reacție chimică în lanț. A fost descoperită în 1913 de Max Bodenstein, care a văzut cum un amestec de gaze de clor și hidrogen explodează atunci când este declanșat de lumină. Mecanismul reacției în lanț a fost explicat pe deplin în 1918 de către Walther Nernst.
- Oceanul terestru conține o cantitate mare de clor. Dacă acest clor ar fi eliberat sub formă de gaz, greutatea sa ar fi de 5 ori mai mare decât totalul atmosferei actuale a Pământului. (Oceanele noastre conțin aproximativ 2,6 x 1016 tone metrice de clor, în cea mai mare parte sub formă de clorură de sodiu.)
- Clorul nu este doar abundent în oceanele noastre; este al șaselea cel mai abundent element din scoarța Pământului.
- Expunerea la cantități mici de clor, chiar și pentru o perioadă scurtă de timp, poate fi mortală. Sunt așteptate fatalități la 1 parte dintr-o mie de clor în aer (sau uneori la concentrații chiar mai mici). (5)
- Clorul este mai greu decât aerul. Când este eliberat, formează o pătură otrăvitoare care plutește în derivă odată cu vântul. Clorul a fost folosit ca armă chimică în Primul Război Mondial, mai întâi în 1915 de către armata germană și apoi de către Aliații occidentali. Nu a fost atât de „eficientă” pe cât se spera, deoarece clorul este ușor de detectat datorită mirosului său puternic. De asemenea, este solubil în apă, astfel că soldații se puteau proteja de cele mai grave efecte ale sale respirând prin cârpe umede.

Aparență și caracteristici
Efecte nocive:
Clorul este un gaz toxic care irită pielea, ochii și sistemul respirator.
Caracteristici:
Clorul este un gaz galben-verzui, diatomic, dens, cu un miros ascuțit (miros de înălbitor).
Nu se găsește liber în natură, deoarece se combină ușor cu aproape toate celelalte elemente.
Clorul se găsește în natură în principal sub formă de sare comună (NaCl), carnalită , și silvită (KCl).
În forma sa lichidă și solidă este un puternic agent de albire, oxidare și dezinfectare.
Utilizări ale clorului
Clorul este folosit pentru producerea de apă potabilă sigură.
Compușii clorurați sunt folosiți mai ales pentru salubritate, albirea pastei de hârtie, dezinfectanți și prelucrarea textilelor.
Clorul este, de asemenea, utilizat pentru fabricarea de clorați și este important în chimia organică, formând compuși precum cloroformul, tetraclorura de carbon, policlorura de vinil și cauciucul sintetic.
Alte utilizări ale compușilor de clor includ coloranți, produse petroliere, medicamente, antiseptice, insecticide, produse alimentare, solvenți, vopsele și materiale plastice.
Abundanță și izotopi
Abundanță scoarța terestră: 145 părți pe milion în greutate, 85 părți pe milion în moli
Abundență sistem solar: 8 părți pe milion în greutate, 0,3 părți pe milion în moli
Cost, pur: 0,15 dolari la 100g
Cost, vrac: $ la 100g
Sursă: Clorul gazos este produs în comerț prin electroliza clorurii de sodiu (NaCl) din apa de mare sau din saramura din minele de sare.
Izotopi: Clorul are 16 izotopi ale căror perioade de înjumătățire sunt cunoscute, cu numerele de masă de la 31 la 46. Clorul natural este un amestec al celor doi izotopi stabili ai săi, 35Cl și 37Cl, cu abundențe naturale de 75,8% și, respectiv, 24,3%.

- Henry M. Leicester, Herbert S. Klickstein, A Source Book in Chemistry, 1400-1900., (1969) Harvard University Press. p111; 1a. p241.; 1b. p257.
- J.W. Mellor, A Comprehensive Treatise on Inorganic and Theoretical Chemistry., 1922, vol 2, Longmans, Green and Co., p21.
- Antoine Lavoisier, Memoires de l’ Academie royale des sciences 1783., 1786, p505-538.
- The Chlorine Tree.
- OSHA, Occupational Safety and Health Guideline for Chlorine.
Citează această pagină
Pentru o legătură online, vă rugăm să copiați și să lipiți una dintre următoarele:
<a href="https://www.chemicool.com/elements/chlorine.html">Chlorine</a>
sau
<a href="https://www.chemicool.com/elements/chlorine.html">Chlorine Element Facts</a>
Pentru a cita această pagină într-un document academic, vă rugăm să folosiți următoarea citare conform MLA:
"Chlorine." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/chlorine.html>.
.