Det kemiska grundämnet klor klassas som halogen och är en ickemetall. Det upptäcktes 1774 av Carl Wilhelm Scheele.

Datazon
| Klassificering: | Klor är ett halogen och en icke-metallisk |
| Färg: | Gröngul |
| Atomvikt: | 35.453 |
| Tillstånd: | gas |
| Smältpunkt: | -101 oC , 172 K |
| Skokpunkt: | -34 oC , 239 K |
| Elektroner: | 17 |
| Protoner: | 17 |
| Neutroner i den vanligaste isotopen: | 18 |
| Elektronskal: | 2,8,7 |
| Elektronkonfiguration: | 1s2 2s2 2p6 3s2 3p5 |
| Täthet vid 20oC: | 0.003214 g/cm3 |
Visa mer, inklusive: Värmekällor, energier, oxidation, reaktioner,
föreningar, radier, ledningsförmåga
| Atomvolym: | 22,7 cm3/mol | |
| Struktur: | skikt av Cl2 i fast ämne | |
| Hårdhet: | ||
| Hårdhet: | ||
| Specifik värmekapacitet | 0,48 J g-1 K-1 | |
| Fusionsvärme | 6.406 kJ mol-1 av Cl2 | |
| Förbränningsvärme | 122 kJ mol-1 | |
| Förångningsvärme | 20.41 kJ mol-1 av Cl2 | |
| 1:a joniseringsenergi | 1251,1 kJ mol-1 | |
| 2:a joniseringsenergi | 2297.3 kJ mol-1 | |
| 3:e joniseringsenergin | 3821.8 kJ mol-1 | |
| Elektronaffinitet | 349 kJ mol-1 | |
| Minimalt oxidationstal | -1 | |
| Min. | -1 | |
| Maximalt oxidationsnummer | 7 | |
| Maximalt gemensamt oxidationsnummer | ||
| 7 | ||
| Elektronegativitet (Paulingskala) | 3,16 | |
| Volym för polariserbarhet | 2.2 Å3 | |
| Reaktion med luft | ingen | |
| Reaktion med 15 M HNO3 | mild, ⇒ HClOx, NOxCl, NOx | |
| Reaktion med 6 M HCl | mild, ⇒ HOCl, Cl- | |
| Reaktion med 6 M NaOH | mild, ⇒ OCl-, Cl- | |
| Oxid(er) | Cl2O, ClO2, Cl2O7 | |
| Hydrid(er) | HCl | |
| Klorid(er) | Cl2 | |
| Atomradie | 100 pm | |
| Ionisk(er) radie (1+ jon) | – | |
| Ionisk radie (2+ jon) | – | |
| Ionisk radie (3+ jon) | – | |
| Jonisk radie (1- jon) | 167 pm | |
| Jonisk radie (2-jon) | – | |
| Jonisk radie (3-jon) | – | |
| Värmeledningsförmåga | 0.0089 W m-1 K-1 | |
| Elektrisk ledningsförmåga | – | |
| Frys-/smältpunkt: | -101 oC , 172 K |

Klorin i provrör (Foto: Ben Mills)
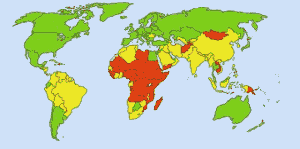
Säkert dricksvatten: Bild: Bild: Ionut_Cojocaru. I gröna områden kan alla få säkert vatten. I röda områden kan minst 25 procent av människorna inte få behandlat vatten. Gula områden ligger på mellannivå. Innan klor användes rutinmässigt i USA:s vattenförsörjning krävde tyfus 25 000 dödsfall varje år. I dag behandlas 98 procent av de offentliga vattentäkterna med klor eller en klorförening. Tyfusfeber skördar nu i genomsnitt ett offer per år. (4)

Carl Wilhelm Scheele, som upptäckte klor 1774.
Detektering av klor
Klor framställdes för första gången 1774 av Carl Wilhelm Scheele i Sverige. Scheele samlade in den gas som frigjordes vid reaktionen av pyrolusit med spiritus salis – en alkemisk term som betyder ande/andedräkt av salt. Den nya gasen hade enligt Scheele ”en mycket märkbar kvävande lukt, som var mycket tryckande för lungorna … och ger vattnet en lätt sur smak … luften i den får en gul färg …”. (1)
Scheele noterade också den höga reaktiviteten och de blekande egenskaperna hos den nya gasen som han hade tillverkat: ”… alla metaller angreps… fast alkali omvandlades till vanligt salt… alla vegetabiliska blommor – röda, blå och gula – blev vita på kort tid; samma sak hände också med gröna växter… insekter dog omedelbart. (1)
Trots noggrannheten i sina observationer trodde Scheele felaktigt att den nya gasen var en dephlostiganerad form av myrsyra.
Den berömde franske kemisten Antoine Lavoisier ansåg att den nya gasen borde kallas oxymuriasyra baserat på det ännu oupptäckta grundämnet murium. (2)
* Förvirringen om klors verkliga identitet orsakades av phlogistonteorin; phlogiston hade accepterats av kemister under större delen av 1700-talet – tills Lavoisier själv avfärdade den. Phlogiston var en ”substans” som användes för att förklara det då oförklarliga. Det var praktiskt nog en negativ vikt när det behövdes och ”förklarade” reaktioner som rostning och bränning.
Lavoisier var arkitekten bakom phlogistons fall och visade att syrets kemi var en bättre förklaring till kemiska reaktioner än vad phlogiston var. (3)
År 1810 var det vetenskapliga samförståndet att det grundämne som vi nu kallar klor faktiskt var en förening som innehöll syre. Den engelske kemisten Sir Humphry Davy fann att konsensus var fel; han kunde inte få den nya gulgröna gasen att reagera med en kolelektrod, vilket fick honom att tro att den kanske inte innehöll syre. I reaktioner med fosfor och ammoniak visade han att den nya gasen inte innehöll syre. Han använde sig av en enorm, 2000-plattvoltaiska hög för att se om han kunde utvinna syre ur gasens fosfor- och svavelföreningar, men återigen fann han inget syre. (1a)
1811 drog Davy slutsatsen att den nya gasen faktiskt var ett nytt grundämne. (1b) Han gav det namnet klor, från det grekiska ordet ”chloros” som betyder ljusgrön eller gulgrön.
Interessanta fakta om klor
- Den första kedjereaktion som upptäcktes var inte en kärnreaktion utan en kemisk kedjereaktion. Den upptäcktes 1913 av Max Bodenstein, som såg en blandning av klor- och vätegaser explodera när den utlöstes av ljus. Kedjereaktionens mekanism förklarades fullständigt 1918 av Walther Nernst.
- Jordhavets oceaner innehåller en stor mängd klor. Om detta klor släpptes ut som en gas skulle dess vikt vara fem gånger större än jordens totala nuvarande atmosfär. (Våra hav innehåller cirka 2,6 x 1016 metriska ton klor, mestadels som natriumklorid.)
- Klor finns inte bara rikligt i våra hav; det är det sjätte vanligaste grundämnet i jordskorpan.
- Exponering för små mängder klor, även under en kortare tid, kan vara dödlig. Dödsfall förväntas vid 1 promille klor i luften (eller ibland vid ännu lägre koncentrationer). (5)
- Klor är tyngre än luft. När det släpps ut bildar det en giftig filt som driver med vinden. Klor användes som kemiskt vapen under första världskriget, först 1915 av den tyska armén och sedan av de västallierade. Det var inte så ”effektivt” som man hade hoppats, eftersom klor lätt upptäcks genom sin starka lukt. Det är också vattenlösligt och soldater kunde därför skydda sig mot de värsta effekterna genom att andas in genom fuktiga trasor.

Uppträdande och egenskaper
Skadliga effekter:
Klor är en giftig gas som irriterar huden, ögonen och andningsorganen.
Egenskaper:
Klor är en gröngul, tvåatomig, tät gas med skarp lukt (lukten av blekmedel).
Det förekommer inte fritt i naturen eftersom det lätt kombineras med nästan alla andra grundämnen.
Klor förekommer i naturen främst som vanligt salt (NaCl), carnallit , och sylvit (KCl).
I flytande och fast form är det ett kraftfullt bleknings-, oxidations- och desinfektionsmedel.
Användningsområden för klor
Klor används för att framställa säkert dricksvatten.
Klorföreningar används främst för sanering, blekning av pappersmassa, desinfektionsmedel och textilbehandling.
Klor används också för tillverkning av klorater och är viktigt i organisk kemi, där det bildar föreningar som kloroform, koltetraklorid, polyvinylklorid och syntetgummi.
Andra användningsområden för klorföreningar är bland annat färgämnen, petroleumprodukter, läkemedel, antiseptiska medel, insekticider, livsmedel, lösningsmedel, färger och plaster.
Förråd och isotoper
Förråd jordskorpan: 145 delar per miljon i vikt, 85 delar per miljon i mol
Förråd solsystemet: 8 delar per miljon i vikt, 0,3 delar per miljon i mol
Kostnad, ren: 0,15 dollar per 100 g
Kostnad, bulk: $ per 100 g
Källa: Klorgas framställs kommersiellt genom elektrolys av natriumklorid (NaCl) från havsvatten eller saltlake från saltgruvor.
Isotoper: Klor har 16 isotoper vars halveringstider är kända, med masstal 31 till 46. Naturligt förekommande klor är en blandning av de två stabila isotoperna 35Cl och 37Cl med naturliga halter på 75,8 % respektive 24,3 %.

- Henry M. Leicester, Herbert S. Klickstein, A Source Book in Chemistry, 1400-1900., (1969) Harvard University Press. s111; 1a. s241.; 1b. s257.
- J.W. Mellor, A Comprehensive Treatise on Inorganic and Theoretical Chemistry., 1922, vol 2, Longmans, Green and Co., s21.
- Antoine Lavoisier, Memoires de l’ Academie royale des sciences 1783., 1786, s505-538.
- The Chlorine Tree.
- OSHA, Occupational Safety and Health Guideline for Chlorine.
Citera den här sidan
För att länka online, vänligen kopiera och klistra in något av följande:
<a href="https://www.chemicool.com/elements/chlorine.html">Chlorine</a>
eller
<a href="https://www.chemicool.com/elements/chlorine.html">Chlorine Element Facts</a>
För att citera den här sidan i ett akademiskt dokument, vänligen använd följande MLA-kompatibla citat:
"Chlorine." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/chlorine.html>.