El elemento químico cloro se clasifica como halógeno y no es un metal. Fue descubierto en 1774 por Carl Wilhelm Scheele.

Zona de datos
| Clasificación: | El cloro es un halógeno y un no metal |
| Color: | amarillo verdoso |
| Peso atómico: | 35.453 |
| Estado: | gas |
| Punto de fusión: | -101 oC , 172 K |
| Punto de ebullición: | -34 oC , 239 K |
| Electrones: | 17 |
| Protones: | 17 |
| Neutrones en el isótopo más abundante: | 18 |
| Capas de electrones: | 2,8,7 |
| Configuración de electrones: | 1s2 2s2 2p6 3s2 3p5 |
| Densidad a 20oC: | 0.003214 g/cm3 |
Mostrar más, incluyendo: Calores, Energías, Oxidación, Reacciones,
Compuestos, Radios, Conductividades
| Volumen atómico: | 22,7 cm3/mol |
| Estructura: | capas de Cl2 en sólido |
| Dureza: | |
| Capacidad calorífica específica | 0,48 J g-1 K-1 |
| Calor de fusión | 6.406 kJ mol-1 de Cl2 |
| Calor de atomización | 122 kJ mol-1 |
| Calor de vaporización | 20.41 kJ mol-1 de Cl2 |
| Primera energía de ionización | 1251,1 kJ mol-1 |
| Segunda energía de ionización | 2297.3 kJ mol-1 |
| 3ª energía de ionización | 3821.8 kJ mol-1 |
| Afinidad de los electrones | 349 kJ mol-1 |
| Número de oxidación mínimo | -1 |
| Min. número de oxidación común | -1 |
| Número de oxidación máximo | 7 |
| Número de oxidación común máximo | 7 |
| Electronegatividad (escala de Pauling) | 3,16 |
| Volumen de polarizabilidad | 2.2 Å3 |
| Reacción con aire | ninguna |
| Reacción con 15 M HNO3 | suave, ⇒ HClOx, NOxCl, NOx |
| Reacción con 6 M HCl | suave, ⇒ HOCl, Cl- |
| Reacción con 6 M NaOH | suave, ⇒ OCl-, Cl- |
| Óxido(s) | Cl2O, ClO2, Cl2O7 |
| Hidruro(s) | HCl |
| Cloruro(s) | Cl2 |
| Radio atómico | 100 pm |
| Radio iónico (1+ ion) | – |
| Radio iónico (2+ ion) | – |
| Radio iónico (3+ ion) | – |
| Radio iónico (1- ion) | 167 pm |
| Radio iónico (2- ion) | – |
| Radio iónico (3- ion) | – |
| Conductividad térmica | 0.0089 W m-1 K-1 |
| Conductividad eléctrica | – |
| Punto de congelación/fusión | -101 oC , 172 K |

Cloro en tubo de ensayo (Foto: Ben Mills)
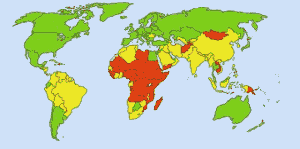
Agua potable segura: Imagen: Ionut_Cojocaru. En las zonas verdes todo el mundo puede obtener agua potable. En las zonas rojas, al menos el 25% de las personas no pueden obtener agua tratada. Las zonas amarillas son intermedias. Antes del uso rutinario de cloro en los suministros de agua de Estados Unidos, la fiebre tifoidea se cobraba 25.000 víctimas mortales cada año. Hoy en día, el 98% de los suministros públicos de agua están tratados con cloro o un compuesto de cloro. La fiebre tifoidea se cobra ahora una víctima al año, por término medio. (4)

Carl Wilhelm Scheele, que descubrió el cloro en 1774.
Descubrimiento del cloro
El cloro fue producido por primera vez en 1774 por Carl Wilhelm Scheele en Suecia. Scheele recogió el gas liberado por la reacción de la pirolusita con el spiritus salis, un término alquímico que significa espíritu/respiración de la sal. El nuevo gas tenía, según Scheele, «un olor sofocante muy perceptible, que resultaba muy opresivo para los pulmones… y da al agua un sabor ligeramente ácido… el aire que contiene adquiere un color amarillo…» (1)
Scheele también señaló la alta reactividad y las cualidades blanqueadoras del nuevo gas que había fabricado: «…todos los metales fueron atacados… el álcali fijo se convirtió en sal común… todas las flores vegetales -rojas, azules y amarillas- se volvieron blancas en poco tiempo; lo mismo ocurrió también con las plantas verdes… los insectos murieron inmediatamente». (1)
A pesar de la exactitud de sus observaciones, Scheele pensó erróneamente que el nuevo gas era una forma desfosforescente del ácido muriático.
El famoso químico francés Antoine Lavoisier creía que el nuevo gas debía llamarse ácido oximurático, basándose en el elemento aún no descubierto, el murio. (2)
* La confusión sobre la verdadera identidad del cloro fue causada por la teoría del flogisto; el flogisto había sido aceptado por los químicos durante la mayor parte del siglo XVIII, hasta que el propio Lavoisier lo desmintió. El flogisto era una «sustancia» utilizada para explicar lo entonces inexplicable. Convenientemente, tenía peso negativo cuando era necesario, y ‘explicaba’ reacciones como la oxidación y la combustión.
Lavoisier fue el artífice de la caída del flogisto, demostrando que la química del oxígeno era una mejor explicación en las reacciones químicas que el flogisto. (3)
En 1810 el consenso científico era que el elemento que ahora llamamos cloro era en realidad un compuesto que contenía oxígeno. El químico inglés Sir Humphry Davy descubrió que el consenso era erróneo; no pudo conseguir que el nuevo gas amarillo-verdoso reaccionara con un electrodo de carbón, lo que le hizo creer que podría no contener oxígeno. En reacciones con fósforo y amoníaco, demostró que el nuevo gas no contenía oxígeno. Utilizó una enorme pila voltaica de 2000 placas para ver si podía extraer oxígeno de los compuestos de fósforo y azufre del gas, pero de nuevo no encontró oxígeno. (1a)
En 1811, Davy concluyó que el nuevo gas era de hecho un nuevo elemento. (1b) Lo llamó cloro, de la palabra griega ‘chloros’, que significa verde pálido o amarillo-verde.
Hechos interesantes sobre el cloro
- La primera reacción en cadena descubierta no fue una reacción nuclear; fue una reacción química en cadena. Fue descubierta en 1913 por Max Bodenstein, que vio cómo una mezcla de gases de cloro e hidrógeno explotaba al ser provocada por la luz. El mecanismo de la reacción en cadena fue completamente explicado en 1918 por Walther Nernst.
- Los océanos de la Tierra contienen una gran cantidad de cloro. Si este cloro se liberara como gas, su peso sería 5 veces mayor que el total de la atmósfera actual de la Tierra. (Nuestros océanos contienen alrededor de 2,6 x 1016 toneladas métricas de cloro, principalmente en forma de cloruro de sodio.)
- El cloro no sólo es abundante en nuestros océanos; es el sexto elemento más abundante en la corteza terrestre.
- La exposición a pequeñas cantidades de cloro, incluso durante un corto período de tiempo, puede ser mortal. Se espera que haya víctimas mortales con 1 parte por mil de cloro en el aire (o a veces con concentraciones incluso menores). (5)
- El cloro es más pesado que el aire. Cuando se libera, forma un manto venenoso que se desplaza con el viento. El cloro se utilizó como arma química en la Primera Guerra Mundial, primero en 1915 por el ejército alemán y luego por los aliados occidentales. No fue tan «eficaz» como se esperaba, porque el cloro se detecta fácilmente por su fuerte olor. También es soluble en agua, por lo que los soldados podían protegerse de sus peores efectos respirando a través de paños húmedos.

Aspecto y características
Efectos nocivos:
El cloro es un gas tóxico que irrita la piel, los ojos y el sistema respiratorio.
Características:
El cloro es un gas amarillo verdoso, diatómico y denso con un olor penetrante (el olor de la lejía).
No se encuentra libre en la naturaleza ya que se combina fácilmente con casi todos los demás elementos.
El cloro se encuentra en la naturaleza principalmente en forma de sal común (NaCl), carnallita y silvita (KCl).
En su forma líquida y sólida es un potente agente blanqueador, oxidante y desinfectante.
Usos del cloro
El cloro se utiliza para producir agua potable.
Los compuestos clorados se utilizan principalmente para el saneamiento, el blanqueo de la pasta de papel, los desinfectantes y el procesamiento de textiles.
El cloro también se utiliza para la fabricación de cloratos y es importante en la química orgánica, formando compuestos como el cloroformo, el tetracloruro de carbono, el cloruro de polivinilo y el caucho sintético.
Otros usos de los compuestos de cloro son los colorantes, los productos petrolíferos, los medicamentos, los antisépticos, los insecticidas, los productos alimenticios, los disolventes, las pinturas y los plásticos.
Abundancia e isótopos
Abundancia corteza terrestre: 145 partes por millón en peso, 85 partes por millón en moles
Abundancia sistema solar: 8 partes por millón en peso, 0,3 partes por millón en moles
Coste, puro: $0,15 por 100g
Coste, a granel: $ por 100g
Fuente: El cloro gaseoso se produce comercialmente mediante la electrólisis del cloruro de sodio (NaCl) del agua de mar o de la salmuera de las minas de sal.
Isótopos: El cloro tiene 16 isótopos cuya vida media se conoce, con números de masa del 31 al 46. El cloro natural es una mezcla de sus dos isótopos estables 35Cl y 37Cl con abundancias naturales de 75,8% y 24,3% respectivamente.

- Henry M. Leicester, Herbert S. Klickstein, A Source Book in Chemistry, 1400-1900., (1969) Harvard University Press. p111; 1a. p241.; 1b. p257.
- J.W. Mellor, A Comprehensive Treatise on Inorganic and Theoretical Chemistry., 1922, vol 2, Longmans, Green and Co., p21.
- Antoine Lavoisier, Memoires de l’ Academie royale des sciences 1783., 1786, p505-538.
- The Chlorine Tree.
- OSHA, Occupational Safety and Health Guideline for Chlorine.
Cite esta página
Para enlazarla en línea, por favor copie y pegue uno de los siguientes:
<a href="https://www.chemicool.com/elements/chlorine.html">Chlorine</a>
o
<a href="https://www.chemicool.com/elements/chlorine.html">Chlorine Element Facts</a>
Para citar esta página en un documento académico, por favor utilice la siguiente cita conforme a MLA:
"Chlorine." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/chlorine.html>.