Galdesalte og galdesyrer er polære kolesterolderivater og udgør den vigtigste rute for udskillelse af steroidet fra kroppen.
De er molekyler med lignende, men ikke identiske strukturer og forskellige fysiske og biologiske egenskaber.
De syntetiseres i leveren, lagres i galdeblæren, udskilles i tolvfingertarmen og reabsorberes til sidst for størstedelen i ileum.
Da disse molekyler ved fysiologisk pH er til stede som anioner, anvendes udtrykkene galdesyre og galdesalte heri som synonymer.
INDSTILLING
- Galdesaltes kemiske struktur
- Primært, konjugerede og sekundære galdesalte
- Galdesyrernes funktion
- Enterohepatisk cirkulation af galdesalte
- Intestinal metabolisme af galdesyrer
- Opløselige fibre og reabsorption af galdesalte
- Syntese af primære galdesyrer
- Den klassiske eller neutrale vej
- Den alternative eller sure vej
- Mindre veje
- Mindre veje
- Galdesalte: Regulering af syntesen
- Galdesaltes kemiske struktur
- Primære, konjugerede og sekundære galdesalte
- Galdesyrernes funktion
- Enterohepatisk cirkulation af galdesalte
- Intestinal metabolisme af galdesyrer
- Opløselige fibre og reabsorption af galdesalte
- Syntese af primære galdesyrer
- Den klassiske eller neutrale vej
- Den alternative eller sure vej
- Mindre veje
- Galdesalte: regulering af syntesen
Galdesaltes kemiske struktur
Galdesalte har ligheder og forskelle med kolesterolmolekylet.
Som steroidet har de en kerne bestående af fire fusionerede ringe: tre cyclohexanringe, mærket A, B og C, og en cyclopentanring, mærket D. Denne struktur er perhydrocyclopentanophenanthren, mere almindeligt kendt som steroidkernen.
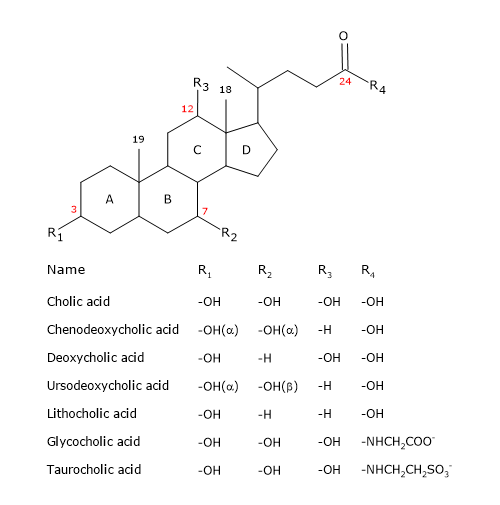
I højere hvirveldyr har de 24 kulstofatomer, da sidekæden er tre kulstofatomer kortere end den oprindelige. Hos lavere hvirveldyr har galdesyrerne 25, 26 eller 27 kulstofatomer. Sidekæden ender med en carboxylgruppe, der er ioniseret ved pH 7, og som kan være bundet til aminosyren glycin eller taurin (se nedenfor).
Ud over hydroxylgruppen i position 3 har de hydroxylgrupper i position 7 og/eller 12.
Alt dette gør dem meget mere polære end kolesterol.
Da A- og B-ringene er fusioneret i cis-konfiguration, er steroidkernens planare struktur buet, og det er muligt at identificere:
- en konkav side, som er hydrofil, fordi hydroxylgrupperne og carboxylgruppen i sidekæden, med eller uden den tilknyttede aminosyre, er orienteret mod den;
- en konveks side, som er hydrofob, fordi de methylgrupper, der er til stede i position 18 og 19, er orienteret mod den.
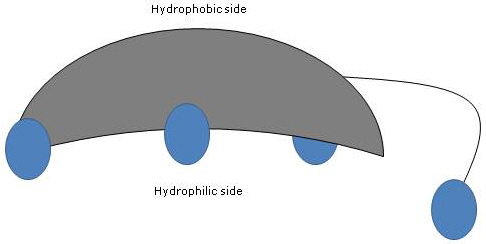
Som har både polære og upolære grupper, er de derfor amfifile molekyler og fremragende overfladeaktive stoffer. Deres kemiske struktur gør dem imidlertid forskellige fra mange andre overfladeaktive stoffer, der ofte består af et polært hovedområde og en upolær hale.
Primære, konjugerede og sekundære galdesalte
Primære galdesyrer er de syrer, der syntetiseres direkte fra kolesterol i hepatocytterne. Hos mennesker er de vigtigste cholsyre og chenodeoxycholsyre, som udgør 80 % af alle galdesyrer. Inden de udskilles i galdetræet, er de næsten fuldstændigt konjugeret, op til 98 %, med glycin eller taurin, for at danne henholdsvis glykokonjugater og taurokonjugater. Ca. 75 % af cholsyre og chenodeoxycholsyre konjugeres med glycin for at danne glycocholsyre og glycochenodeoxycholsyre, de resterende 25 % med taurin for at danne taurocholsyre og taurochenodeoxycholsyre.
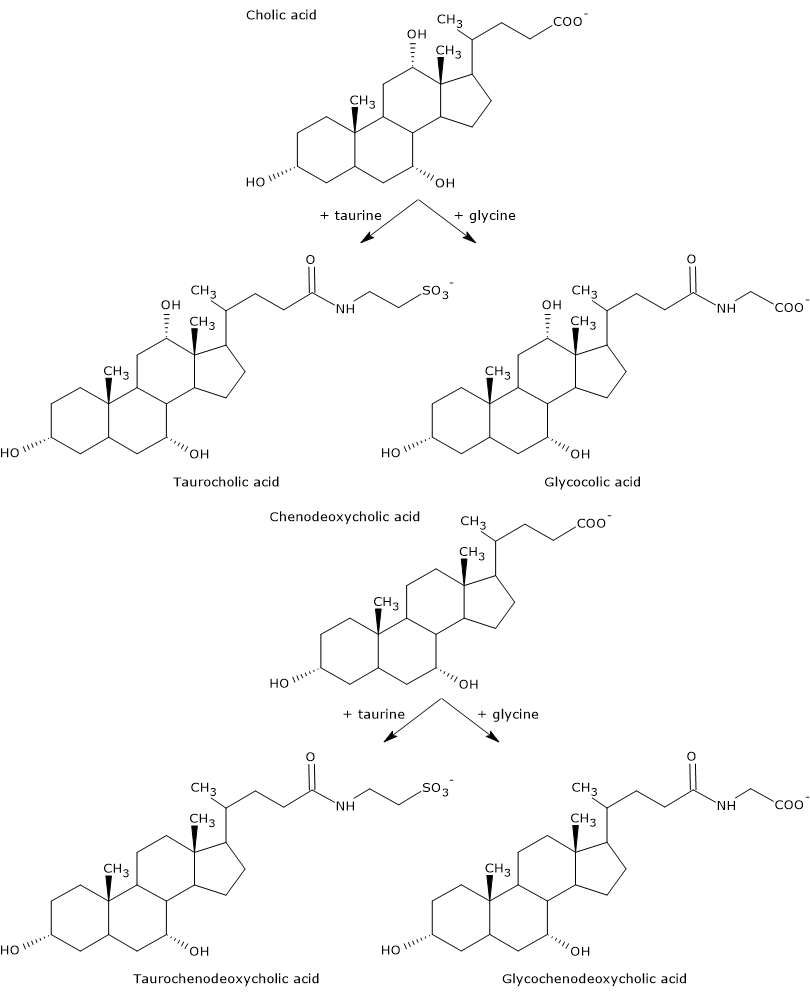
Konjugerede galdesyrer er molekyler med flere hydrofile grupper end ukonjugerede galdesyrer, og derfor med en øget emulgeringsevne. Konjugering nedsætter faktisk galdesyrernes pKa fra ca. 6, en værdi, der er typisk for ikke-konjugerede molekyler, til ca. 4 for glycocholsyre og ca. 2 for taurocholsyre. Dette gør, at konjugerede galdesyrer ioniseres i et bredere pH-område for at danne de tilsvarende salte.
Hydrofiliciteten af de almindelige syre- og galdesalte falder i følgende rækkefølge: glycin-konjugeret < taurin-konjugeret < lithocholsyre < deoxocholsyre < chenodeoxycholsyre < cholsyre <ursodeoxycholsyre.
Endeligt nedsætter konjugering også cytotoksiciteten af primære galdesyrer.
Sekundære galdesyrer dannes af primære galdesyrer, som ikke er blevet reabsorberet fra tyndtarmen. Når de når frem til tyktarmen, kan de undergå flere modifikationer af tarmmikrobiotaen for at danne sekundære galdesyrer (se nedenfor). De udgør de resterende 20 % af kroppens galdesyrepulje.
En anden måde at kategorisere galdesalte på er baseret på deres konjugering med glycin og taurin og deres grad af hydroxylering. På dette grundlag identificeres tre kategorier.
- Trihydroxykonjugater, såsom taurocholsyre og glycocholsyre.
- Dihydroxykonjugater, såsom glycodeoxycholsyre, glycochenodeoxycholsyre, taurochenodeoxycholsyre og taurodeoxycholsyre. De udgør ca. 60 % af de galdesalte, der er til stede i galde.
- Ukonjugerede former, såsom cholsyre, deoxycholsyre, chenodeoxycholsyre og lithocholsyre.
Galdesyrernes funktion
Alle deres fysiologiske funktioner udføres i den konjugerede form.
- De er den vigtigste vej til udskillelse af kolesterol fra det menneskelige legeme.
Mennesket har nemlig ikke enzymer til at bryde cyclohexanringen eller cyclopentanringen i steroidkernen op og heller ikke til at oxidere kolesterol til CO2 og vand.
Den anden mekanisme til at fjerne steroidet fra kroppen er som kolesterol i sig selv i galden. - Galdesalte er stærke overfladeaktive stoffer. Og især di- og trihydroxykonjugater er de bedste overfladeaktive stoffer blandt galdesyrerne, meget mere effektive end ukonjugerede modstykker, da de har flere polære grupper.
Når de er i kontakt med apolære lipider i tyndtarmens lumen, interagerer den konvekse apolære overflade med de apolære lipider, såsom triglycerider, kolesterolestere og ester af fedtopløselige vitaminer, mens den konkave polære overflade interagerer med det omgivende vandige medium. Dette øger spredningen af apolære lipider i det vandige medium, da det giver mulighed for dannelse af små lipiddråber, hvilket øger overfladearealet for:
lipaseaktivitet, hovedsagelig pancreaslipase, (galdesalte spiller også en direkte rolle i aktiveringen af dette enzym);
intestinal esteraseaktivitet.
Som følge heraf letter de absorptionen af lipidfordøjelsesprodukter samt af fedtopløselige vitaminer af tarmslimhinden takket være dannelsen af blandede miceller.
Galdesyrerne har en lignende funktion i galdeblæren, hvor de ved at danne blandede miceller med fosfolipider forhindrer udfældning af kolesterol.
OBS: Som følge af arrangementet af polære og upolære grupper danner galdesyrerne miceller i vandig opløsning, der normalt består af mindre end 10 monomerer, så længe deres koncentration er over den såkaldte kritiske micellære koncentration eller CMC.
- På tarmniveau modulerer de sekretionen af pancreasenzymer og cholecystokininin.
- I tynd- og tyktarmen har de en potent antimikrobiel aktivitet, hovedsagelig deoxycholsyre, især mod Gram-positive bakterier. Denne aktivitet kan skyldes oxidativ DNA-skade og/eller beskadigelse af cellemembranen. Derfor spiller de en vigtig rolle i forebyggelsen af bakteriel overvækst, men også i reguleringen af tarmmikrobiotaens sammensætning.
- I de sidste par år er det blevet tydeligt, at de spiller en regulerende rolle i kontrollen af energistofskiftet og især for den hepatiske glukosehåndtering.
Enterohepatisk cirkulation af galdesalte
Efter fedtindtag udskiller enteroendokrine celler i duodenum cholecystokinin i blodstrømmen. Hormonet binder sig til receptorer på glatte muskelceller i galdeblæren og fremmer deres sammentrækning; hormonet forårsager også afslapning af Oddis sphincter of Oddi. Alt dette resulterer i udskillelse af galde og dermed af galdesyrer i duodenum.
Under fysiologiske forhold er menneskets galdesaltpulje konstant og svarer til ca. 3-5 g. Dette er muliggjort af to processer:
- deres tarmreabsorption;
- deres de novo-syntese (se nedenfor).
Op til 95 % af de udskiltes galdesalte reabsorberes fra tarmen, ikke sammen med produkterne fra lipidfordøjelsen, men gennem en proces kaldet enterohepatisk cirkulation.
Det er et yderst effektivt genbrugssystem, som synes at foregå mindst to gange for hvert måltid, og som omfatter leveren, galdetræet, tyndtarmen, tyktarmen, tyktarmen og portalkredsløbet, gennem hvilket de reabsorberede molekyler vender tilbage til leveren. En sådan recirkulation er nødvendig, da leverens kapacitet til at syntetisere galdesyrer er begrænset og utilstrækkelig til at dække tarmens behov, hvis galdesaltene blev udskilt i store mængder i fæces.
De fleste galdesalte reabsorberes i det distale ileum, den nederste del af tyndtarmen, af en natriumafhængig transportør i enterocytternes børstegrænse, kaldet natriumafhængig galdesyretransportør eller ASBT, som udfører samtransport af et galdesyremolekyle og to natriumioner.
Inden for enterocytten menes det, at galdesyrer transporteres gennem cytosolen til den basolaterale membran af det ileale galdesyrebindende protein eller IBABP. De krydser den basolaterale membran ved organic solute transporter alpha-beta eller OSTα/OSTβ, passerer ind i portalkredsløbet og når, bundet til albumin, leveren.
Det skal bemærkes, at en lille procentdel af galdesyrerne når leveren gennem leverarterien.
På leverniveau er deres ekstraktion meget effektiv med en first-pass ekstraktionsfraktion, der varierer fra 50 til 90 %, en procentdel, der afhænger af galdesyrernes struktur. Optagelsen af konjugerede galdesyrer formidles hovedsageligt af et Na+ -afhængigt aktivt transportsystem, dvs. det natriumafhængige taurocholatkotransporterende polypeptid eller NTCP. Der kan dog også forekomme en natriumuafhængig optagelse, som udføres af proteiner fra familien af organiske aniontransporterende polypeptider eller OATP, hovedsagelig OATP1B1 og OATP1B3.
Det hastighedsbegrænsende trin i det enterohepatiske kredsløb er deres kanalikulære sekretion, som i vid udstrækning formidles af galdesalteksportpumpen eller BSEP, i en ATP-afhængig proces. Denne pumpe transporterer monoanioniske galdesalte, som er de hyppigst forekommende. Gallesyrer, der er konjugeret med glucuronsyre eller sulfat, som er dianioniske, transporteres af forskellige transportører, såsom MRP2 og BCRP.
Bemærkning: Serumniveauerne af gallesyrer varierer på grundlag af deres reabsorptionshastighed, og de er derfor højere under måltider, hvor den enterohepatiske cirkulation er mere aktiv.
Intestinal metabolisme af galdesyrer
Galdesyrer, der undslipper ileal absorption, passerer ind i colon, hvor de delvist undergår modifikationer af tarmmikrobiota og omdannes til sekundære galdesyrer.
De vigtigste reaktioner er anført nedenfor.
- Dekonjugering
På sidekæden kan der ske hydrolyse af C24 N-acylamidbindingen med frigivelse af ukonjugerede galdesyrer og glycin eller taurin. Denne reaktion katalyseres af bakterielle hydrolaser, der er til stede både i tyndtarmen og i tyktarmen. - 7α-dehydroxylering
Kvantitativt set er det den vigtigste reaktion, der udføres af bakterielle dehydrataser i tyktarmen, som fjerner hydroxylgruppen i position 7 for at danne 7-deoxy-galdesyrer. Især dannes deoxycholsyre fra cholsyre og lithocholsyre, en giftig sekundær galdesyre, fra chenodeoxycholsyre.
Det skal bemærkes, at 7α-dehydroxylering, i modsætning til oxidation og epimerisering (se nedenfor), kun kan forekomme på ukonjugerede galdesyrer, og derfor er deconjugering en væsentlig forudsætning. - Oxidation og epimerisering
Det er reaktioner, der involverer hydroxylgrupperne i positionerne 3, 7 og 12, og som katalyseres af bakterielle hydroxysteroiddehydrogenaser. For eksempel stammer ursodeoxycholsyre fra epimerisering af chenodeoxycholsyre.
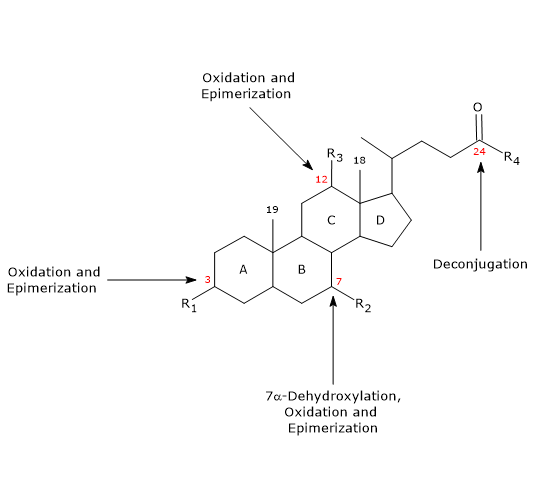
En del af de sekundære galdesyrer reabsorberes derefter fra tyktarmen og vender tilbage til leveren. I hepatocytterne bliver de om nødvendigt rekonjugeret og genudskilles. De, der ikke reabsorberes, udskilles med afføringen.
Mens oxidationer og dekonjugeringer udføres af et bredt spektrum af anaerobe bakterier, udføres 7α-dehydroxyleringer af et begrænset antal anaerobe bakterier i colonen.
7α-dehydroxyleringer og dekonjugeringer øger galdesyrernes pKa og dermed deres hydrofobicitet, hvilket muliggør en vis grad af passiv absorption gennem colonvæggen.
Den øgede hydrofobicitet er også forbundet med en øget toksicitet af disse molekyler. Og en høj koncentration af sekundære galdesyrer i galde, blod og afføring er blevet sat i forbindelse med patogenese af tyktarmskræft.
Opløselige fibre og reabsorption af galdesalte
Reabsorptionen af galdesalte kan reduceres ved chelaterende virkning af opløselige fibre, såsom dem, der findes i friske frugter, bælgfrugter, havre og havreklid, som binder dem og mindsker deres optagelse. Dette øger til gengæld galdesyre de novo-syntesen ved at opregulere ekspressionen af 7α-hydroxylase og sterol 12α-hydroxylase (se nedenfor) og reducerer derved hepatocytkolesterolkoncentrationen.
Den udtømning af hepatisk kolesterol øger ekspressionen af LDL-receptoren og reducerer derved plasmakoncentrationen af LDL-kolesterol. På den anden side stimulerer det også syntesen af HMG-CoA-reduktase, nøgleenzym i kolesterolbiosyntesen.
Bemærkning: Nogle anti-kolesterolmidler virker ved at binde galdesyrer i tarmen og forhindrer derved deres reabsorption.
Syntese af primære galdesyrer
Kvantitativt set er galdesyrerne det vigtigste produkt af kolesterolmetabolismen.
Som tidligere nævnt opretholder den enterohepatiske cirkulation og deres de novo-syntese en konstant galdesyrepuljestørrelse. Navnlig gør de novo-syntesen det muligt at erstatte de galdesalte, der udskilles i ansigterne, ca. 5-10 % af kroppens pool, nemlig ~ 0,5 g/dag.
Nedenfor beskrives syntesen af cholsyre og chenodeoxycholsyre og deres konjugering med aminosyrerne taurin og glycin.
Der er to hovedveje for galdesyresyntese: den klassiske vej og den alternative vej. Desuden vil nogle andre mindre vigtige veje også blive beskrevet.
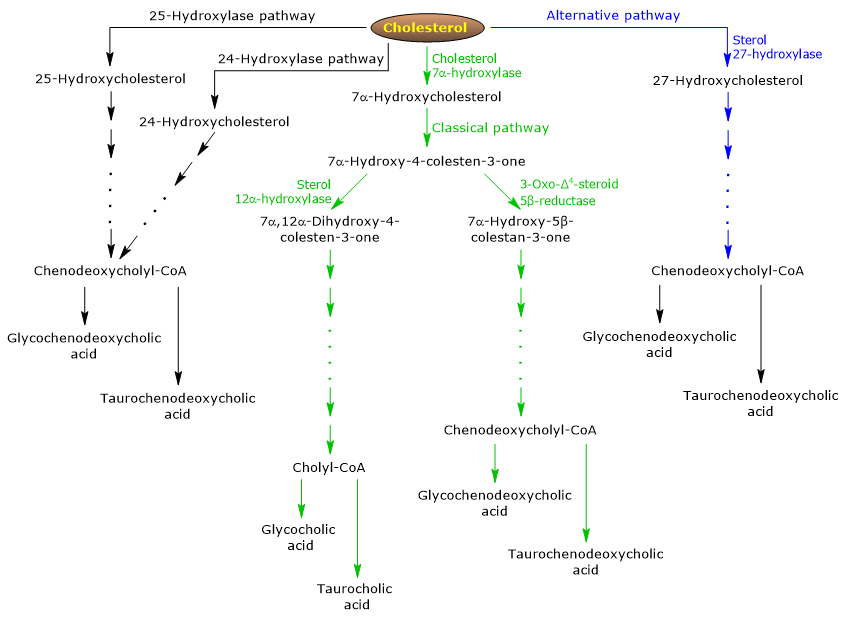
Den klassiske eller neutrale vej
I mennesker produceres op til 90 % af galdesalte via den klassiske vej (se fig. 5), også kaldet den “neutrale” vej, da mellemprodukterne er neutrale molekyler.
Det er en metabolisk vej, der kun findes i leveren, og som består af reaktioner, der katalyseres af enzymer lokaliseret i cytosol, endoplasmatisk retikulum, peroxisomer og mitokondrier, og hvis slutprodukter er konjugater af cholinsyre og chenodeoxycholsyre.
- Den første reaktion er hydroxylering i position 7 af kolesterol, så der dannes 7α-hydroxycholesterol. Reaktionen katalyseres af kolesterol 7α-hydroxylase eller CYP7A1 (E.C. 1.14.14.23). Det er et enzym, der er lokaliseret i det endoplasmatiske retikulum, og det katalyserer det hastighedsbegrænsende trin i vejen.
Colesterol + NADPH + H+ + O2 → 7α-Hydroxycholesterol + NADP+ + H2O
- 7α-Hydroxycholesterol gennemgår oxidation af 3β-hydroxylgruppen og forskydning af dobbeltbindingen fra 5,6 positionen til 4,5 positionen, for at danne 7α-hydroxy-4-cholesten-3-on. Reaktionen katalyseres af 3β-hydroxy-Δ5-C27-steroid oxidoreduktase eller HSD3B7 (E.C. 1.1.1.1.181), et enzym lokaliseret i det endoplasmatiske reticulum.
- 7α-hydroxy-4-cholesten-3-on kan følge to ruter:
at komme ind i den vej, der fører til syntese af cholsyre, gennem den reaktion, der katalyseres af 7α-hydroxy-4-cholesten-3-on 12α-monooxygenase eller sterol 12α-hydroxylase eller CYP8B1 (E.C. 1.14.18.8), et enzym lokaliseret i det endoplasmatiske retikulum;
at gå ind i den vej, der fører til syntese af chenodeoxycholsyre, gennem den reaktion, der katalyseres af 3-oxo-Δ4-steroid 5β-reduktase eller AKR1D1 (E.C. 1.3.3.1.3), et cytosolisk enzym.
Det skal understreges, at aktiviteten af sterol 12α-hydroxylase bestemmer forholdet mellem cholsyre og chenodeoxycholsyre og i sidste ende galdesyrepuljens detergentkapacitet. Og faktisk er reguleringen af sterol 12α-hydroxylase-gen-transkriptionen et af de vigtigste regulerende trin i den klassiske vej.
Såfremt 7α-hydroxy-4-cholesten-3-on fortsætter via den reaktion, der katalyseres af sterol 12α-hydroxylase, vil følgende reaktioner derfor finde sted.
- 7α-hydroxy-4-cholesten-3-on hydroxyleres i position 12 af sterol 12α-hydroxylase, hvorved der dannes 7α,12α-dihydroxy-4-cholesten-3-on.
- 7α,12α-dihydroxy-4-cholesten-3-on undergår reduktion af dobbeltbindingen i position 4,5, i reaktionen katalyseret af 3-oxo-Δ4-steroid 5β-reduktase, til dannelse af 5β-cholestan-7α,12α-diol-3-on.
- 5β-Cholestan-7α,12α-diol-3-on undergår reduktion af hydroxylgruppen i position 4, i den reaktion, der katalyseres af 3α-hydroxysteroiddehydrogenase eller AKR1C4 (EC 1.1.1.1.213), et cytosolisk enzym, for at danne 5β-cholestan-3α,7α,12α,12α-triol.
- 5β-Cholestan-3α,7α,12α-triol undergår oxidation af sidekæden via tre reaktioner, der katalyseres af sterol 27-hydroxylase eller CYP27A1 (EC 1.14.15.15). Det er et mitokondrieenzym, der også findes i ekstrahepatiske væv og makrofager, og som indfører en hydroxylgruppe i position 27. Hydroxylgruppen oxideres til aldehyd og derefter til carboxylsyre for at danne 3α,7α,12α-trihydroxy-5β-cholestansyre.
- 3α,7α,12α,12α-Trihydroxy-5β-cholestansyre aktiveres til sin coenzym A-ester, 3α,7α,12α,12α-trihydroxy-5β-cholestanoyl-CoA, i den reaktion, der katalyseres af enten meget langkædede acyl-CoA-syntetase eller VLCS (EC 6.2.1.-) eller bile acid CoA synthetase eller BACS (EC 6.2.1.7), begge lokaliseret i det endoplasmatiske retikulum.
- 3α,7α,12α-Trihydroxy-5β-cholestanoyl-CoA transporteres til peroxisomer, hvor det gennemgår fem på hinanden følgende reaktioner, der hver især katalyseres af et andet enzym. I de to sidste reaktioner forkortes sidekæden til fire kulstofatomer, og til sidst dannes cholylCoA.
- I det sidste trin sker konjugationen, via amidbinding, af sidekædens carboxylsyregruppe med aminosyren glycin eller taurin. Reaktionen katalyseres af galdesyre-CoA:aminosyre-N-acyltransferase eller BAAT (EC 2.3.1.65), som overvejende er lokaliseret i peroxisomer.
Reaktionsprodukterne er således de konjugerede galdesyrer: glykocholsyre og taurocholsyre.
Hvis 7α-hydroxy-4-cholesten-3-on ikke fortsætter via den reaktion, der katalyseres af sterol 12α-hydroxylase, går det ind i den vej, der fører til syntesen af chenodeoxycholsyrekonjugater, via de reaktioner, der er beskrevet nedenfor.
- 7α-hydroxy-4-cholesten-3-on omdannes til 7α-hydroxy-5β-cholestan-3-on i den reaktion, der katalyseres af 3-oxo-Δ4-steroid 5β-reduktase.
- 7α-hydroxy-5β-cholestan-3-on omdannes til 5β-cholestan-3α,7α-diol i den reaktion, der katalyseres af 3α-hydroxysteroid-dehydrogenase.
Dernæst dannes de konjugerede galdesyrer glycochenodeoxycholsyre og taurochenodeoxycholsyre ved modifikationer svarende til dem, der ses for konjugering af cholsyre, og som for det meste katalyseres af de samme enzymer.
Bemærk: Ukonjugerede galdesyrer dannet i tarmen skal nå leveren for at blive rekonjugeret.
Den alternative eller sure vej
Den er fremherskende hos foster og nyfødte, mens den hos voksne fører til syntese af mindre end 10 % af galdesaltene.
Denne vej (se fig. 5) adskiller sig fra den klassiske vej ved, at:
- mellemprodukterne er sure molekyler, hvorfra det alternative navn “acidic pathway” stammer;
- oxidationen af sidekæden efterfølges af modifikationer af steroidkernen og ikke omvendt;
- slutprodukterne er konjugater af chenodeoxycholsyre.
Det første trin omfatter omdannelse af kolesterol til 27-hydroxykolesterol i den reaktion, der katalyseres af sterol 27-hydroxylase.
27-hydroxykolesterol kan følge to veje.
Rute A
- 27-hydroxycholesterol omdannes til 3β-hydroxy-5-cholestenoic acid i en reaktion, der katalyseres af sterol 27-hydroxylase.
- 3β-hydroxy-5-kolestenoesyre hydroxyleres i position 7 i den reaktion, der katalyseres af oxysterol 7α-hydroxylase eller CYP7B1 (EC 1.14.13.100), et enzym lokaliseret i det endoplasmatiske reticulum, for at danne 3β-7α-dihydroxy-5-kolestenoesyre.
- 3β-7α-dihydroxy-5-kolestenosyre omdannes til 3-oxo-7α-hydroxy-4-kolestenosyre, i reaktionen katalyseret af 3β-hydroxy-Δ5-C27-steroid oxidoreduktase.
- 3-Oxo-7α-hydroxy-4-kolestenosyre danner som følge af sidekædemodifikationer chenodeoxycholsyre og derefter dets konjugater.
Rute B
- 27-Hydroxycholesterol omdannes til 7α,27-dihydroxycholesterol i den reaktion, der katalyseres af oxysterol 7α-hydroxylase og kolesterol 7α-hydroxylase.
- 7α,27-dihydroxycholesterol omdannes til 7α,26-dihydroxy-4-cholesten-3-on i den reaktion, der katalyseres af 3β-hydroxy-Δ5-C27-steroid-oxidoreduktase;
7α,26-dihydroxy-4-cholesten-3-on kan omdannes direkte til konjugater af chenodeoxycholsyre eller kan omdannes til 3-oxo-7α-hydroxy-4-colestensyre og derefter undergå sidekædemodifikationer og andre reaktioner, der fører til syntese af konjugater af chenodeoxycholsyre.
Mindre veje
Der findes også mindre veje (se fig. 5), der bidrager til galdesaltsyntesen, om end i mindre omfang end de klassiske og alternative veje.
For eksempel:
- En kolesterol 25-hydroxylase (EC 1.14.99.38) udtrykkes i leveren.
- En kolesterol 24-hydroxylase eller CYP46A1 (EC 1.14.14.14.25) udtrykkes i hjernen, og derfor eksporterer organet, selv om det ikke kan eksportere kolesterol, oxysteroler.
- En uspecifik 7α-hydroxylase er også blevet opdaget. Det udtrykkes i alle væv og synes at være involveret i dannelsen af oxysteroler, som kan transporteres til hepatocytter for at blive omdannet til chenodeoxycholsyre.
Dertil kommer, at sterol 27-hydroxylase udtrykkes i forskellige væv, og derfor skal dets reaktionsprodukter transporteres til leveren for at blive omdannet til galdesalte.
Galdesalte: regulering af syntesen
Reguleringen af galdesyresyntesen sker via en negativ feedback-mekanisme, især på ekspressionen af kolesterol 7α-hydroxylase og sterol 12α-hydroxylase.
Når der opstår et overskud af galdesyrer, både frie og konjugerede, binder disse molekyler sig til den nukleare receptor farnesoid X-receptor eller FRX og aktiverer den: Den mest effektive galdesyre er chenodeoxycholsyre, mens andre, såsom ursodeoxycholsyre, ikke aktiverer den.
FRX inducerer ekspressionen af den transkriptionelle repressor small heterodimer partner eller SHP, som igen interagerer med andre transkriptionsfaktorer, såsom liver receptor homolog-1 eller LRH-1 og hepatocyte nuclear factor-4α eller HNF-4α. Disse transkriptionsfaktorer binder sig til en sekvens i promotorregionen for 7α-hydroxylase- og 12α-hydroxylase-generne, region kaldet bile acid response elements eller BAREs, og hæmmer deres transkription.
En af grundene til, at galdesaltsyntesen er stramt reguleret, er, at mange af deres metabolitter er toksiske.
Chiang J.Y.L. Bile acids: regulation of synthesis. J Lipid Res 2009;50(10):1955-66. doi:10.1194/jlr.R900010-JLR200
Gropper S.S., Smith J.L. Advanced nutrition and human metabolism. 6h Edition. Cengage Learning, 2012
Moghimipour E., Ameri A., and Handali S. Absorptionsforbedrende virkninger af galdesalte. Molecules 2015;20(8); 14451-73. doi:10.3390/molecules200814451
Monte M.J., Marin J.J.G., Antelo A., Vazquez-Tato J. Bile acids: Chemistry, physiology, and pathophysiology. World J Gastroenterol 2009;15(7):804-16. doi:10.3748/wjg.15.804
Rawn J.D. Biochimica. Mc Graw-Hill, Neil Patterson Publishers, 1990
Rosenthal M.D., Glew R.H. Medical biochemistry – Human metabolism in health and disease. John Wiley J. & Sons, Inc., Publication, 2009
Sundaram S.S., Bove K.E., Lovell M.A. og Sokol R.J. Mechanisms of Disease: inborn errors of bile acid synthesis. Nat Clin Pract Gastroenterol Hepatol 2008;5(8):456-68. doi:10.1038/ncpgasthep1179