Michael D. Ober, MD
Christina M. Klais, MD
Emmett T. Cunningham Jr., MD, PhD, MPH
New York City
Das Makulaödem ist eine pathologische Ansammlung von extrazellulärer Flüssigkeit in der Netzhaut, vor allem in den äußeren plexiformen und inneren Kernschichten, als unspezifische Reaktion auf einen Zusammenbruch der Blut-Retina-Schranke. ME ist eine häufige Ursache für den Verlust des Sehvermögens bei Patienten mit Diabetes mellitus, retinalen Venenverschlüssen, Uveitis und nach intraokularen Operationen. Seltener tritt sie bei vitreoretinaler Traktion, choroidaler Neovaskularisation und einer Reihe anderer Erkrankungen auf. Es gibt zahlreiche Strategien zur Behandlung von ME mit unterschiedlichem Erfolg. Dieser Artikel gibt einen Überblick über die verfügbaren Behandlungsmöglichkeiten für diese häufige Erkrankung.
 |
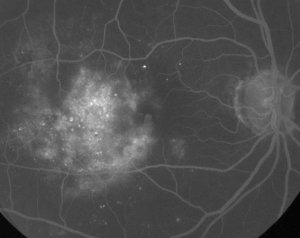 |
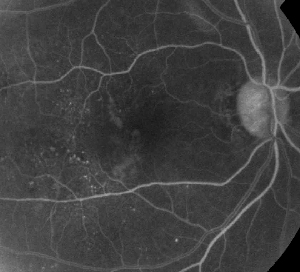
| Abbildung 1. A. Frühphasen-Fluoreszeinangiographie eines Patienten mit nicht-proliferativer diabetischer Retinopathie. Mikroaneurysmen sind am deutlichsten temporal der Fovea zu sehen, zusätzlich zu Fluoreszeinleckagen in der fovealen avaskulären Zone. | B. Spätphasen-FA desselben Patienten mit diffuser Leckage temporal und innerhalb der fovealen avaskulären Zone, die einem diabetischen Makulaödem entspricht. |
Diagnose
Die klinische Diagnose von ME wird am besten mit einer Kontaktlinse und einer stereoskopischen Spaltlampen-Fundusbiomikroskopie gestellt. ME manifestiert sich typischerweise als unregelmäßige Erhebung innerhalb der Netzhaut, oft in der Nähe von intraretinalem Lipid, Mikroaneurysmen und/oder Blutungen in Fällen, die auf Diabetes mellitus, Gefäßverschluss oder Ischämie zurückzuführen sind. Intraretinale Flüssigkeit kann sich auch in zystischen Räumen ansammeln, die in der parafovealen Netzhaut lokalisiert sind, mit oder ohne angrenzende Gefäßanomalien. Dieses zystoide Makulaödem (CME) entsteht am häufigsten durch eine Entzündung, eine lokale Traktion oder nach einer Operation.
Die Fluoreszenzangiographie ist ein wichtiges Instrument zur Diagnose des ME. Im normalen Auge wird Fluoreszein durch die Blut-Retina-Schranke am Eindringen in die Netzhaut gehindert. Bei ME jedoch verlassen Fluoresceinmoleküle den intravaskulären Raum und gelangen in die Netzhaut. Die betroffenen Stellen zeigen in frühen bis mittleren Bildern eine Hyperfluoreszenz, die in späteren Bildern an Fläche und Intensität zunimmt (siehe Abbildung 1). FA hebt nicht nur das Ödem zur einfachen Visualisierung und Lokalisierung der Behandlung hervor, sondern erstellt auch eine dauerhafte Aufzeichnung für zukünftige Vergleiche. Für ME wurde eine vierstufige quantitative Skala entwickelt, wobei Grad 0 keine perifoveale Hyperfluoreszenz bedeutet, Grad 1 eine unvollständige perifoveale Hyperfluoreszenz, Grad 2 eine leichte 360-Grad-Hyperfluoreszenz, Grad 3 eine mäßige 360-Grad-Hyperfluoreszenz mit einer hyperfluoreszierenden Fläche von etwa einem Scheibendurchmesser und Grad 4 eine schwere 360-Grad-Hyperfluoreszenz mit einer hyperfluoreszierenden Fläche von etwa 1,5 Scheibendurchmessern.1,2 Die FA ist zwar ein empfindliches Mittel, um das Vorhandensein von ME festzustellen, sie liefert jedoch relativ wenig Informationen über die anatomische Verteilung der Flüssigkeit, d. h. diffus vs. zystisch vs. subretinal, und den Schweregrad des Lecks im Laufe der Zeit. Die FA liefert keine quantitativen Informationen über die Netzhautverdickung. Es überrascht daher nicht, dass dieses zweidimensionale FA-basierte Einstufungssystem insgesamt schlecht mit der Sehkraft korreliert.3,4
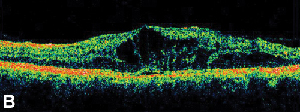
Die optische Kohärenztomographie (OCT III, Carl Zeiss) ist ein berührungsloses, nicht-invasives Bildgebungsverfahren, das eine nützliche Ergänzung zur Diagnose von ME darstellt. Dabei wird ein Strahl aus Nahinfrarotlicht (830 nm) senkrecht auf die Oberfläche der Netzhaut gerichtet und die Eigenschaften der Reflexionen analysiert. In 1,5 Sekunden wird ein einziges lineares, hochauflösendes Querschnittsbild erstellt. Diese Bilder können die verdickte, zystische Netzhaut in ödematösen Bereichen darstellen und sogar messen. Es ist auch nützlich, um die Eigenschaften der vitreoretinalen Grenzfläche zu visualisieren und effektiv zu demonstrieren, wenn die Traktion des Glaskörpers eine Rolle bei der Bildung von ME spielt (siehe Abbildung 2).
In einer Studie wurden 84 Augen mit ME als Folge einer Uveitis mittels OCT untersucht, was den zusätzlichen Vorteil hatte, dass in 41 bzw. 20 Prozent der Fälle das Vorhandensein von epiretinalen Membranen und seröser Netzhautablösung festgestellt bzw. bestätigt werden konnte.5 In der Studie wurde eine mäßige Korrelation zwischen der Netzhautdicke und der abnehmenden Sehschärfe festgestellt, obwohl das Ausmaß der Korrelation in den verschiedenen Studien variiert hat. Andere Forscher berichteten über schwache,6 mäßige,7 und starke8,9,10 Korrelationen unter Verwendung unterschiedlicher statistischer Methoden bei verschiedenen Patientengruppen, einschließlich Patienten mit diabetischer Retinopathie, Uveitis und CME.
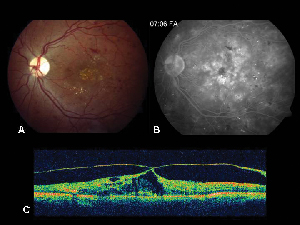
Abbildung 2. A. Farbfundusaufnahme des linken Auges eines Patienten mit nicht-proliferativer diabetischer Retinopathie und Lipidexsudation in und um die Fovea. B. Die Spätphasen-FA zeigt ein Makulaödem in der zentralen Makula. C. Die optische Kohärenztomographie zeigt die abnorme vitreoretinale Grenzfläche sowie das Makulaödem.
Eine andere Gruppe berichtete, dass das OCT bei der Erkennung von ME ebenso effektiv ist wie die FA und der FA bei der Beschreibung der axialen Verteilung der Flüssigkeit überlegen ist.6 OCT ist auch in der Lage, einige Patienten mit ME zu identifizieren, die mit FA nicht sichtbar sind, wie z. B. in bestimmten Fällen von chronischem CME, bei denen die Art von aktivem Leck, die mit FA am besten sichtbar gemacht werden kann, minimal oder sogar nicht vorhanden ist, oder wenn die Fundusuntersuchung durch das Vorhandensein von Medientrübungen beeinträchtigt ist, wie z. B. bei Patienten mit asteroider Hyalose.11
Der Retinal Thickness Analyzer (RTA, Talia Technology, Israel) ist ein ähnliches berührungsloses Bildgebungsverfahren, das die Quantifizierung der Netzhautdicke ermöglicht. Er erstellt 16 parallele Querschnittsscans über einen 3×3 mm großen Bereich der Netzhaut, indem er die Reflexionen eines schräg gerichteten grünen Lichtimpulses (540 nm) analysiert, der über 0,3 Sekunden abgegeben wird. Sowohl OCT als auch RTA haben eine ausgezeichnete Präzision bei der Messung der Netzhautdicke gezeigt, und ein direkter Vergleich der Technologien hat eine statistisch signifikante Korrelation zwischen ihren Messungen ergeben. Während die RTA den Vorteil der schnellen Erfassung mit möglicherweise weniger Artefakten hat, scheint sie bei Vorhandensein von Medientrübungen weniger effektiv bei der Messung der Netzhautdicke zu sein als die OCT.12
In einer anderen Studie wurde die foveale Dicke mit RTA und OCT bei 30 gesunden Augen verglichen. Die mittlere Foveadicke in den normalen Augen wurde mit 181 µm für RTA und 153 µm für OCT gemessen. Die Autoren kamen zu dem Schluss, dass die RTA gelegentlich falsch hohe Werte erzeugt und daher im Vergleich zur OCT eine geringere Zuverlässigkeit aufweist.13 Im Gegensatz dazu ergab eine Analyse von Patienten mit leichter nicht-proliferativer diabetischer Retinopathie, dass die RTA bei der Erkennung von Bereichen mit Netzhautverdickung in den Anfangsstadien der diabetischen ME empfindlicher war als die OCT.14
 |
 |
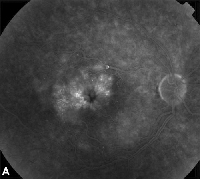
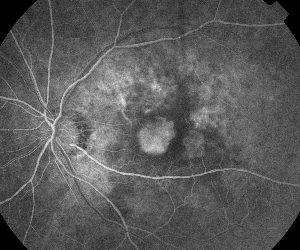
| Abbildung 3. A. Spätphasen-Fluoreszeinangiogramm eines Patienten mit zystoidem Makulaödem. | B. Optische Kohärenztomographie, die die großen zystischen Räume an der Fovea zeigt. |
Behandlungen -Medizinisch
Topische nicht-steroidale entzündungshemmende Medikamente sind die häufigste Behandlung für ME nach einer Kataraktoperation (siehe Abbildung 3). Diese Mittel zielen darauf ab, den intraokularen Prostaglandinspiegel zu senken, der in der Pathogenese von ME eine Rolle spielt. Doppelt maskierte, randomisierte, aktive und placebokontrollierte Studien mit Patienten, die sich einer Kataraktoperation unterzogen, berichteten über entzündungshemmende Wirkungen von topisch applizierten 1%igen Indometacin-, 0,03%igen Flurbiprofen-, 0,5%igen Ketorolac- und 0,1%igen Diclofenac-Augenarzneimittellösungen.15,16 Diclofenac 0,1% und Ketorolac 0,5%ige Augenarzneimittellösungen sind jedoch die einzigen topisch applizierten NSAIDs, die von der Food and Drug Administration speziell für diese Indikation zugelassen sind. Eine Kombinationstherapie aus einem topischen Kortikosteroid und NSAID-Tropfen hat sich bei der Behandlung von ME als wirksamer erwiesen als eines der beiden Medikamente allein.16 Obwohl sie nicht von der FDA zugelassen sind, werden topische NSAIDs häufig vor Kataraktoperationen eingesetzt, um eine postoperative ME zu verhindern.
Orales Acetazolamid wird gelegentlich zur Behandlung von ME bei entzündlichen Erkrankungen und Retinitis pigmentosa eingesetzt, insbesondere wenn topische NSAIDs und Kortikosteroide versagen. Mehrere prospektive, maskierte Crossover-Studien verglichen Acetazolamid und Placebo bei Patienten mit ME aufgrund verschiedener Ursachen. In einer Crossover-Studie mit fünf Zyklen an 41 Patienten wurde bei mehr als der Hälfte der Patienten mit erblichen oder entzündlichen Netzhauterkrankungen ein reproduzierbares Ansprechen festgestellt, das als teilweises oder vollständiges Verschwinden von ME charakterisiert wurde, aber kein Ansprechen bei Patienten mit primären Netzhaut-Gefäßerkrankungen.17 500 mg/Tag oder orales Acetazolamid erwiesen sich als wirksamer als 250 mg/Tag bei der Behandlung von ME bei Patienten mit ME als Folge von RP.18 In dieser Studie wurde bei 10 von 12 behandelten Patienten eine Besserung beobachtet.
Eine andere Gruppe kam zu dem Schluss, dass Patienten unter 55 Jahren mit ME, das auf eine chronische Iridozyklitis zurückzuführen ist, eher auf 500 mg Acetazolamid b.i.d. ansprechen als ältere Patienten.19 Eine neuere Studie legt nahe, dass Acetazolamid auch bei der Behandlung von durch Diabetes induziertem ME wirksam sein könnte.20
Kortikosteroide sind starke entzündungshemmende Mittel, die häufig bei der Behandlung von ME eingesetzt werden. Sie haben mehrere Wirkmechanismen, einschließlich der Stabilisierung der Blut-Retina-Schranke und der Hemmung von pro-inflammatorischen Mediatoren. Die Verabreichungsformen umfassen die topische, periokulare und intravitreale Injektion sowie die orale und intravenöse Verabreichung. Orale und intravenöse Kortikosteroide erreichen zwar durchaus therapeutische Spiegel im Glaskörper, setzen die Patienten jedoch dem zusätzlichen Risiko systemischer Komplikationen aus und sind daher in der Regel Patienten mit einer die Sehkraft bedrohenden Uveitis im Rahmen einer systemischen Erkrankung vorbehalten. Topische Kortikosteroidtropfen befinden sich am anderen Ende des Sicherheitsspektrums, können aber das hintere Segment nur begrenzt erreichen.
Sub-Tenon-Injektionen bieten eine Alternative, um relativ hohe Dosen von Kortikosteroiden in das Auge zu bringen, wobei das Risiko systemischer Komplikationen geringer ist.21 Obwohl es keine randomisierten, kontrollierten Studien gibt, wird die Sub-Tenon-Injektion von Kortikosteroiden seit vielen Jahren wirksam zur Behandlung von Makulaödemen eingesetzt. Bei der gebräuchlichsten Technik wird eine kurze 25-GA-Nadel durch die superotemporale bulbäre Bindehaut in den Sub-Tenon-Raum eingeführt, während der Patient nach inferonasal blickt. Die Nadel wird mit einer streichenden Bewegung von einer Seite zur anderen entlang des Augapfels vorgeschoben, um ein versehentliches Eindringen in den Augapfel zu verhindern, bis die Nadel die Eintrittsstelle in die Bindehaut erreicht, wo das Medikament verabreicht wird. In einem Bericht wurden 20 konsekutive Patienten mit intermediärer Uveitis, die mit einem Sehverlust einherging, mit einer Sub-Tenon-Injektion von 40 mg Triamcinolonacetonid behandelt.22 Obwohl nicht alle Patienten eine ME bei der FA zeigten, verbesserten sich 67 Prozent nach einer Behandlung um zwei Sehlinien. Zu den Risiken dieses Verfahrens gehören u. a. ein anhaltend erhöhter Augeninnendruck, Katarakt, Ptosis und intraokulare Penetration.
In jüngster Zeit wurde die intravitreale Injektion von Triamcinolonacetonid (Kenalog, 4,0 mg) verstärkt eingesetzt, da es in der Lage ist, refraktäre ME infolge von Diabetes mellitus (siehe Abbildung 4), retinalen Venenverschlüssen, Entzündungen und anderen idiopathischen Ursachen zu verbessern.23-26 Vorläufige Studien zeigen eine dramatische Verringerung der Netzhautverdickung, einen verminderten Fluoreszeinaustritt und eine Sehverbesserung, die bei einigen Patienten deutlich ausfallen kann. Obwohl die Wirkung vorübergehend ist und in der Regel drei bis sechs Monate oder weniger anhält, spricht das ME in der Regel auf eine erneute Injektion an. Die Anwendung von intravitrealen Kortikosteroiden ist jedoch mit einem 30- bis 40-prozentigen Risiko eines anhaltend erhöhten Augeninnendrucks und einem etwa 10-prozentigen Risiko eines operativ zu behandelnden Katarakts verbunden. Das National Eye Institute nimmt derzeit Patienten für die SCORE-Studie (Standard Care vs. Corticosteroid for Retinal Vein Occlusion) auf, in der intravitreale Injektionen von Triamcinolon (1- und 4-mg-Dosen) mit der Standardbehandlung (Beobachtung und/oder Gitterlaserbehandlung) bei Patienten mit ME aufgrund eines Venenverschlusses verglichen werden. In der Studie werden insgesamt 1 260 Patienten beobachtet und die Behandlung 36 Monate lang fortgesetzt.
ME tritt auch bei altersbedingter Makuladegeneration auf (siehe Abbildung 5). Die intravitreale Injektion von Triamcinolonacetonid wird derzeit für den kombinierten Einsatz mit der photodynamischen Therapie zur Behandlung der neovaskulären AMD untersucht (Visudyne mit intravitrealem Triamcinolonacetonid, VisTA). Eine Studie unterstreicht die Bedeutung von intravitrealem Triamcinolon vor der Anwendung der PDT bei Patienten mit Makulaödem und CNV.27 Die Autoren stellen die Theorie auf, dass Verteporfin in zystische intraretinale Räume austreten kann, was zu einer Schädigung der Photorezeptoren der benachbarten, normalen Netzhaut führt, sobald das Medikament photoaktiviert ist, während eine vorherige Auflösung des Netzhautödems diese Komplikation verhindern kann. Die vorherige Verabreichung eines Kortikosteroids kann auch dazu dienen, einen PDT-induzierten Anstieg der intraokularen VEGF-Konzentration abzuschwächen.
Intravitreale Injektionen selbst sind mit einem geringen, aber eindeutigen Risiko schwerer, potenziell erblindender Nebenwirkungen verbunden, einschließlich infektiöser Endophthalmitis, Netzhautablösung, Blutungen, okulärer Hypertension, Katarakt und Hypotonie.28 In kürzlich veröffentlichten Leitlinien für intravitreale Injektionen wird versucht, einen Best-Practice-Ansatz für diese zunehmend verwendete Technik festzulegen. Die Empfehlungen des Konsensusgremiums befassen sich mit Überlegungen zur Injektionsvorbereitung, einschließlich Antibiotika, Glaukomuntersuchung, Verwendung von Handschuhen und Behandlung bereits bestehender Augenlidanomalien, sowie mit der Bedeutung der Vermeidung übermäßiger Lidmanipulationen vor und während des Eingriffs. Die empfohlene Peri-Injektionsbehandlung umfasste die Verwendung eines topischen und/oder subkonjunktivalen Anästhetikums, topischen Povidon-Jods und eines Lidspekulums. Die Autoren betonten, wie wichtig die Überwachung des Augeninnendrucks und die direkte Fundusvisualisierung nach der Injektion sind, um die Perfusion des Sehnervs, die intravitreale Lokalisierung von Triamcinolon und das Fehlen einer mit der Injektion verbundenen Blutung oder Netzhautablösung zu überprüfen. Sie betonten auch die Bedeutung der Patientenaufklärung im Hinblick auf Frühsymptome möglicher Komplikationen und eine gründliche Nachsorge.29
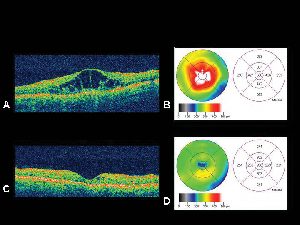
Abbildung 4. A. Optische Kohärenztomographie (OCT) eines Auges mit diabetischem Makulaödem mit entsprechender NetzhautdickenkarteB. erstellt durch das OCT. C. OCT desselben Patienten einen Monat nach intravitrealer Triamcinolonacetonid-Injektion mit entsprechender Netzhautdickenkarte. D. Auflösung des Makulaödems. Die Sehschärfe verbesserte sich nach der Behandlung von 20/200 auf 20/80.
In mehreren Studien werden alternative langfristige Kortikosteroidverabreichungssysteme für die Anwendung im Auge untersucht. In einer Studie wird ein Fluocinolonacetonid-Pellet, das auf einer Kunststoffstrebe eingebettet ist, chirurgisch platziert und die Steroide über einen Zeitraum von drei Jahren kontrolliert abgegeben. Das so genannte intravitreale Envision-Implantat von Bausch & Lomb und Control Delivery Systems wird durch die Pars plana eingebracht und mit der Sklera vernäht. In einer randomisierten, maskierten Phase-II/III-Studie wurde das Envision TD-Implantat bei 80 Patienten mit 0,5 vs. 2,0 mg Fluocinolonacetonid im Vergleich zu einer Standardbehandlung bestehend aus Laserphotokoagulation oder Beobachtung verglichen. Nach sechs Monaten wurde mit dem 0,5-mg-Implantat im Vergleich zur Standardbehandlung eine statistisch signifikante Verringerung von ME und Schwere der diabetischen Retinopathie festgestellt. Darüber hinaus gab es keine Unterschiede in der Häufigkeit schwerwiegender unerwünschter Wirkungen. Der 2,0-mg-Arm der Studie wurde aufgrund der Ergebnisse einer zweiten Studie, in der kein Vorteil gegenüber 0,5 mg festgestellt wurde, vorzeitig abgebrochen. An einer zweiten Studie nahmen 278 Patienten mit nicht-infektiöser hinterer Uveitis teil, die nach dem Zufallsprinzip entweder ein 0,59-mg- oder ein 2,1-mg-Retisert-Implantat in das betroffene Auge oder, in bilateralen Fällen, in das stärker betroffene Auge erhielten. Nach zwei Dosen und 34 Wochen war die Rezidivrate in den Augen mit dem Implantat signifikant niedriger (10 vs. 55,7 Prozent, p<0,0001) und der Einsatz von systemischen Kortikosteroiden/immunsuppressiven Therapien (59,0 Prozent bei Studienbeginn vs. 13,7 Prozent nach 34 Wochen) sowie der Einsatz von Sub-Tenon und topischen Steroiden ging zurück. Es kam zu einer signifikanten Verbesserung der Sehschärfe (p<0,05). Zu den häufigsten unerwünschten Ereignissen gehörten das Fortschreiten des Grauen Stars und ein erhöhter Augeninnendruck, der bei 8,6 % der Patienten ein Filterverfahren erforderlich machte. (Jaffe G. Invest Ophthalmol Vis Sci. 2004; 44 ARVO E-Abstract #3369.)
Eine weitere Studie befasst sich mit Posurdex von Allergan, einem bioerodierbaren Dexamethason-Pellet, das in den Glaskörperraum injiziert wird und das Medikament über 50 bis 160 Tage abgibt. Die Ergebnisse einer Phase-II-Studie zeigten, dass sowohl ein 350-µg- als auch ein 700-µg-Pellet den Prozentsatz der Patienten mit einer Verbesserung des Sehvermögens um zwei Linien oder mehr (27,2 Prozent und 35,7 Prozent bei 350 µg bzw. 700 µg) sowie eine Verbesserung des Sehvermögens um drei Linien oder mehr (13 Prozent und 19,4 Prozent bei 350 µg bzw. 700 µg) nach 180 Tagen im Vergleich zu Placebo signifikant verbesserte. Bisher wurde kein erhöhtes Auftreten von Katarakten gemeldet, obwohl bei etwa 15 Prozent der Patienten ein Anstieg des Augeninnendrucks beobachtet wurde.
Behandlungen -Laser
In jüngster Zeit wurde Macugen von Eyetech und Pfizer in einer randomisierten, doppel-maskierten, multizentrischen, dosisabhängigen, kontrollierten Phase-II-Studie an 172 Patienten mit diabetischem ME untersucht. Die Studie untersuchte drei Dosen (0,3 mg, 1,0 mg, 3,0 mg) im Vergleich zu Scheininjektionen, die alle sechs Wochen für drei Injektionen verabreicht wurden. Vor der fokalen/Gitterlaser-Behandlung wurden die Prüfärzte gebeten, nur Patienten einzuschreiben, bei denen sie die fokale/Gitterlaser-Behandlung für mindestens 12 Wochen aufschieben konnten. Zusätzliche Injektionen und/oder eine fokale/rasterförmige Photokoagulation wurden nach Ermessen des Prüfarztes von Woche 18 bis 30 verabreicht. Die abschließenden Untersuchungen wurden in Woche 36 durchgeführt, sechs Wochen nach der letzten geplanten Injektion. Insgesamt hatten die Probanden, die Macugen erhielten, bessere Sehergebnisse, wiesen eher eine Verringerung der zentralen Netzhautdicke auf und benötigten seltener eine zusätzliche Lasertherapie als Scheinpatienten.31 Eine bestätigende Phase-III-Studie ist derzeit geplant.
Die fokale/Gitterlaser-Photokoagulation ist nach wie vor der Standard für die Behandlung von diabetischem ME. Die Early Treatment Diabetic Retinopathy Study (EDTRS) hat gezeigt, dass bei Patienten, die mit einem Gitterlaser behandelt wurden, eine 50-prozentige Verringerung des moderaten Sehverlusts (definiert als Verdoppelung des Sehwinkels oder Abnahme des Sehvermögens um drei Linien) im Vergleich zur Beobachtung zu verzeichnen war.30 Obwohl der genaue Mechanismus, durch den der Laser die ME verringert, nicht bekannt ist, wird angenommen, dass er die Bildung dichter Verbindungen zwischen den RPE-Zellen fördert sowie den Sauerstoffbedarf der Photorezeptoren verringert und die Sauerstoffperfusion der Aderhaut erhöht.31 Im Rahmen der EDTRS wurden Patienten mit klinisch signifikanter ME als für eine fokale Laserphotokoagulation geeignet eingestuft. Dies wurde definiert als Erfüllung eines der folgenden drei Kriterien: 1) Netzhautverdickung innerhalb von 500 µm von der Fovea entfernt; 2) harte Exsudate weniger als 500 µm von der Fovea entfernt in Verbindung mit einer benachbarten Netzhautverdickung; oder 3) ein Ödembereich von einem Scheibendurchmesser oder mehr, dessen Teil weniger als einen Scheibendurchmesser von der Fovea entfernt ist. Das EDTRS unterscheidet jedoch nicht zwischen fokalem ME, das einer lokalen Verdickung der Netzhaut in der Nähe von Mikroaneurysmen entspricht, und diffusem ME, das sich auf eine generalisierte Verdickung des hinteren Pols bezieht. Anekdotische Belege zeigen, dass fokale diabetische ME gut auf fokale/Gitterlaser anspricht, während die diffuse Variante häufiger nicht mit dem Laser behandelt werden kann und eine andere Behandlung erfordert.
 |
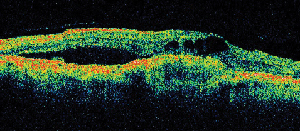 |
| Abbildung 5. A. Frühes Fluoreszeinangiogramm mit klassischer subfovealer Neovaskularisation. | B. Die korrespondierende optische Kohärenztomographie zeigt Bereiche mit subretinaler und intraretinaler Flüssigkeitsansammlung sowie die Neovaskularisation (Pfeil). |
Behandlungen – Chirurgie
Die erste Gruppe, die über die Vorteile einer Vitrektomie und einer Abtrennung der hinteren Hyaloide bei Patienten mit diabetischem ME berichtete, deutete darauf hin, dass es eine Untergruppe von Patienten gibt, bei denen eine Glaskörpertraktion und flache Makulaabhebungen zur Netzhautverdickung beitragen.32 Dies wurde später mit OCT bestätigt und führte zu einer Verfeinerung der Indikationen für diese Technik.33,34 Die drei größten Serien35,36,37 von Patienten, die sich einer Vitrektomie bei diabetischer ME unterzogen, die auf weniger invasive Behandlungen nicht ansprachen, analysierten 59, 58 bzw. 65 Patienten. Sie berichteten, dass sich bei 47 %, 53 % bzw. 45 % ihrer Patienten die Sehkraft um zwei oder mehr Zeilen verbesserte. Bei der letzten Gruppe traten bei einer Minderheit der Patienten schwerwiegende postoperative Komplikationen auf, darunter Netzhautablösung (1,5 Prozent), Rubeosis iridis (4,6 Prozent), epiretinale Membranen (13,8 Prozent), rezidivierende Glaskörperblutungen (1,5 Prozent) und foveale harte Exsudatablagerungen (4,6 Prozent), während die Komplikationen der zweiten Gruppe epiretinale Membranen bei 10,2 Prozent und Katarakte bei 63,2 Prozent der phaken Augen umfassten. Mehrere andere Fallserien haben ähnliche Ergebnisse gezeigt, allerdings waren alle nicht randomisiert, ohne Placebokontrolle und mit unterschiedlichen Ein- und Ausschlusskriterien. Auch die chirurgischen Techniken unterschieden sich, so dass die genauen Indikationen für die Vitrektomie bei Patienten mit CME nicht eindeutig geklärt sind.
Das CME bleibt trotz der Vielzahl der verfügbaren Behandlungen eine der Hauptursachen für den Sehverlust. Die Laserphotokoagulation ist nach wie vor ein wesentlicher Bestandteil der Behandlung von ME aufgrund von Diabetes, Ischämie und Gefäßverschlüssen. Topische NSAIDs und Kortikosteroide sind derzeit die primäre Methode zur Kontrolle des postoperativen ME, während Acetazolamid ein wirksames Mittel zur Behandlung ausgewählter Patienten mit ME infolge von Uveitis und Retinitis pigmentosa bleibt. Die Rolle der intravitrealen Kortikosteroide in der ME-Therapie nimmt zu, bleibt aber durch Nebenwirkungen und die Dauer der Wirkung begrenzt. Die Verfeinerung der chirurgischen Techniken wird der Behandlung von ME, die auf eine weniger invasive Behandlung nicht anspricht, eine neue Dimension verleihen, während Fortschritte in der Pharmakotherapie und der Verabreichung von Medikamenten am Auge eine Rolle bei der Prävention und Behandlung aller Ursachen und Arten von ME spielen werden.
Dr. Ober ist Stipendiat für vitreoretinale Chirurgie am Edward S. Harkness Eye Institute am Columbia University College of Physicians and Surgeons und am LuEsther T. Mertz Retinal Research Center am Manhattan Eye, Ear, and Throat Hospital. Kontaktieren Sie ihn unter 210 East 64th St., 8th Fl, New York, NY 10021; E-Mail: [email protected]; oder (212) 605 3777 oder Fax (212) 605 3795.
Dr. Klais ist Retina-Fellow am LuEsther T. Mertz Retinal Research Center. Kontaktieren Sie sie unter der gleichen Adresse, Telefon- oder Faxnummer oder per E-Mail unter [email protected].
Dr. Cunningham ist klinischer Professor für Augenheilkunde und Direktor des Uveitis Service an der New York University, School of Medicine. Er ist auch Angestellter von Eyetech Pharmaceuticals Inc. und kann unter Vitreous-Retina-Macula Consultants of New York, 460 Park Ave. 10022, New York, N.Y. 10022, per E-Mail [email protected] oder per Telefon/Fax unter (212) 861 9797 erreicht werden.
1. Spaide RF, Yannuzzi LA, Sisco LJ. Chronisches zystoides Makulaödem und Prädiktoren für die Sehschärfe. Ophthalmic Surg 1993;24:262-267.
2. Yannuzzi LA. Ein Ausblick auf die Behandlung des aphaken zystoiden Makulaödems. Surv Ophthalmol 1984;28:540-553
3. Chang A, Spaide RF, Yannuzzi LA. Postoperatives zystoides Makulaödem. In: Guyer DR, Yannuzzi LA, Chang S, et al. Retina, Vitreous, Macula. Saunders. Philadelphia. 1999;1:239-255.
4. Nussenblatt RB, Kaufman SC, Palestine AG, et al. Makulaverdickung und Sehschärfe. Messung bei Patienten mit zystoiden Makulaödemen. Ophthalmology 1987;94:1134-9.
5. Markomichelakis NN, Halkiadakis I, Pantelia E, et al. Patterns of macular edema in patients with uveitis: qualitative and quantitative assessment using optical coherence tomography. Ophthalmology 2004;111:946-53.
6. Antcliff RJ, Stanford MR, Chauhan DS, et al. Comparison between optical coherence tomography and fundus fluorescein angiography for the detection of cystoid macular edema in patients with uveitis. Ophthalmology 2000; 107:593-9.
7. Otani T, Kishi S, Maruyama Y. Patterns of diabetic macular edema with optical coherence tomography. Am J Ophthalmol 1999;127:688-93.
8. Hee MR, Puliafito CA, Wong C, et al. Quantitative Bewertung des Makulaödems mit optischer Kohärenztomographie. Arch Ophthalmol 1995;113:1019-29.
9. Nussenblatt RB, Kaufman SC, Palestine AG, et al. Macular thickening and visual acuity. Messung bei Patienten mit zystoiden Makulaödemen. Ophthalmology 1987;94:1134-9.
10. Ozdek SC, Erdinc MA, Gurelik G, et al. Optical coherence tomographic assessment of diabetic macular edema: comparison with fluorescein angiographic and clinical findings. Ophthalmologica 2005;219:86-92.
11. Browning DJ, Fraser CM. Optische Kohärenztomographie zur Erkennung eines Makulaödems bei Vorliegen einer asteroiden Hyalose. Am J Ophthalmol 2004;137:959-961.
12. Polito A, Shah SM, Haller JA et al. Vergleich zwischen Netzhautdickenanalysator und optischer Kohärenztomographie zur Beurteilung der Foveadicke bei Augen mit Makulaerkrankungen. Am J Ophthalmol 2002;134:240-51.
13. Neubauer AS, Priglinger S, Ullrich S, et al. Vergleich der fovealen Dicke gemessen mit dem Retinal Thickness Analyzer und der optischen Kohärenztomographie. Retina 2001;21:596-601.
14. Pires I, Bernardes RC, Lobo CL, Soares MA, Cunha-Vaz JG. Netzhautdicke in Augen mit leichter nichtproliferativer Retinopathie bei Patienten mit Typ-2-Diabetes mellitus: Vergleich von Messungen durch Netzhautdickenanalyse und optische Kohärenztomographie. Arch Ophthalmol 2002 Oct;120(10):1301-6.
15. Flach AJ. Cyclo-Oxygenase-Inhibitoren in der Ophthalmologie. Surv Ophthalmol 1992;36:259-284.
16. Heier JS, Topping TM, Baumann W, Dirks MS, Chern S. Ketorolac versus Prednisolon versus Kombinationstherapie bei der Behandlung des akuten pseudophakischen zystoiden Makulaödems. Ophthalmology 2000;107:2034-8.
17. Cox SN, Hay E, Bird AC. Behandlung des chronischen Makulaödems mit Acetazolamid. Arch Ophthalmol 1988;106:1190-5.
18. Fishman GA, Gilbert LD, Fiscella RG, Kimura AE, Jampol LM. Acetazolamid zur Behandlung des chronischen Makulaödems bei Retinitis pigmentosa. Arch Ophthalmol 1989;107:1445-52.
19. Farber MD, Lam S, Tessler HH, Jennings TJ, Cross A, Rusin MM. Verringerung des Makulaödems durch Acetazolamid bei Patienten mit chronischer Iridozyklitis: eine randomisierte prospektive Crossover-Studie. Br J Ophthalmol 1994;78:4-7.
20. Giusti C, Forte R, Vingolo EM, Gargiulo P. Is acetazolamide effective in the treatment of diabetic macular edema? Eine Pilotstudie. Int Ophthalmol 2001;24:79-88.
21. Jennings T, Rusin MM, Tessler HH, Cunha-Vaz JG. Posteriore Sub-Tenon-Injektionen von Kortikosteroiden bei Uveitis-Patienten mit zystoiden Makulaödemen. Jpn J Ophthalmol 1988;32:385-91.
22. Helm CJ, Holland GN. Die Auswirkungen der hinteren Subtenon-Injektion von Triamcinolonacetonid bei Patienten mit intermediärer Uveitis. Am J Ophthalmol 1995;120:55-64.
23. Benhamou N, Massin P, Haouchine B, Audren F, et al. Intravitreales Triamcinolon bei refraktärem pseudophakem Makulaödem. Am J Ophthalmol 2003;135:246-9.
24. Jonas JB, Kreissig I, Degenring RF. Intravitreales Triamcinolonacetonid zur Behandlung des Makulaödems bei Zentralvenenverschluß. Graefes Arch Clin Exp Ophthalmol. 2002;240:782-3.
25. 25. Martidis A, Duker JS, Greenberg PB, Rogers AH, et al. Intravitreales Triamcinolon bei refraktärem diabetischem Makulaödem. Ophthalmology 2002; 109: 920-7.
26. 26. Scott IU, Flynn HW Jr., Rosenfeld PJ. Intravitreales Triamcinolonacetonid bei idiopathischem zystoiden Makulaödem. Am J Ophthalmol 2003;136:737-9.
27. 27. Freund KB, Klais CM, Eandi CM, et al. Sequenced Combined Intravitreal Triamcinolone and Indocyanine Green Angiography Guided Photodynamic Therapy for Retinal Angiomatous Proliferation. Arch Ophthalmol, In Press.
28. 28. Jager RD, Aiello LP, Patel SC, Cunningham ET Jr. Risiken der intravitrealen Injektion: ein umfassender Überblick. Retina. 2004 Oct;24(5):676-98.
29. 29. Aiello LP, Brucker AJ, Chang S, et al. Evolving guidelines for intravitreal injections. Retina 2004 Oct;24(5 Suppl):S3-19.
30. G. Jaffe, Fluocinolon Acetonid Uveitis Study Group. Intravitreales Fluocinolonacetonid-Implantat bei Uveitis, die den hinteren Augenabschnitt betrifft. ARVO 2004, Poster #3369.
31. Die Macugen Diabetic Retinopathy Study Group. Eine randomisierte, doppelt-maskierte Phase-II-Studie mit Pegaptanib, einem Aptamer gegen den vaskulären endothelialen Wachstumsfaktor, bei diabetischem Makulaödem. Ophthalmology, In press.
32. 30. Photokoagulation bei diabetischem Makulaödem. Early Treatment Diabetic Retinopathy Study report number 1. Arch Ophthalmol 1985;103:1796-806.
33. Christoforidis JB, D’Amico DJ. Chirurgische und andere Behandlungen des diabetischen Makulaödems: ein Update. Int Ophthalmol Clin 2004;44:139-60.
34. Lewis H, Abrams GW, Blumenkranz MS, Campo RV. Vitrektomie bei diabetischer Makulatraktion und Ödem in Verbindung mit hinterer hyaloider Traktion. Ophthalmologie 1992;99:753-9.
35. Kaiser PK, Riemann CD, Sears JE, Lewis H. Macular traction detachment and diabetic macular edema associated with posterior hyaloidal traction. Am J Ophthalmol 2001;131:44-9.
36. Lewis H. The role of vitrectomy in the treatment of diabetic macular edema. Am J Ophthalmol 2001;131:123-5.
37. Pendergast SD. Vitrektomie bei diabetischem Makulaödem in Verbindung mit einem gespannten prämakulären hinteren Hyaloid. Curr Opin Ophthalmol 1998;9:71-5.
38. Tachi N, Ogino N. Vitrektomie bei diffusem Makulaödem in Fällen von diabetischer Retinopathie. Am J Ophthalmol 1996;122:258-60.
39. Yamamoto T, Hitani K, Tsukahara I, Yamamoto S, et al. Frühe postoperative Netzhautdickenveränderungen und Komplikationen nach Vitrektomie bei diabetischem Makulaödem. Am J Ophthalmol 2003;135:14-9.