Generischer Name: Eisen-Dextran
Dosierungsform: Injektion
Medically reviewed by Drugs.com. Last updated on Dec 1, 2019.
- Übersicht
- Nebenwirkungen
- Dosierung
- Beratung
- Interaktionen
- Mehr
Nach der parenteralen Verabreichung von Eisendextran-Injektionen sind Reaktionen vom anaphylaktischen Typ, einschließlich Todesfälle, aufgetreten.
- Halten Sie während der Verabreichung von Infed® eine Reanimationsausrüstung und in der Erkennung und Behandlung von Reaktionen vom anaphylaktischen Typ geschultes Personal bereit.
- Verabreichen Sie vor der ersten therapeutischen Dosis eine Testdosis Infed®. Wenn nach der Testdosis keine Anzeichen oder Symptome von Reaktionen vom anaphylaktischen Typ auftreten, verabreichen Sie die volle therapeutische Infed®-Dosis.
- Beobachten Sie bei allen Infed®-Verabreichungen auf Anzeichen oder Symptome von Reaktionen vom anaphylaktischen Typ. Tödliche Reaktionen sind nach der Testdosis der Eisendextran-Injektion aufgetreten. Tödliche Reaktionen sind auch in Situationen aufgetreten, in denen die Testdosis vertragen wurde.
- Infed® darf nur bei Patienten angewendet werden, bei denen klinische und Laboruntersuchungen einen Eisenmangel ergeben haben, der durch eine orale Eisentherapie nicht behoben werden kann.
- Patienten mit einer Medikamentenallergie in der Anamnese oder multiplen Medikamentenallergien können ein erhöhtes Risiko für anaphylaktische Reaktionen auf Infed® aufweisen.
- BESCHREIBUNG:
- KLINISCHE PHARMAKOLOGIE:
- INDIKATIONEN UND ANWENDUNG:
- KONTRAINDIKATIONEN:
- WARNHINWEISE:
- HINWEISE:
- UNERWÜNSCHTE REAKTIONEN:
- ÜBERDOSIERUNG:
- DOSIERUNG UND ANWENDUNG:
- VERSORGUNGSWEISE:
- MUSTERKENNZEICHNUNG
- Mehr über Infed (Eisendextran)
- Ressourcen für Verbraucher
- Ressourcen für Fachleute
- Verwandte Behandlungsleitfäden
BESCHREIBUNG:
Infed (Iron Dextran Injection USP) ist ein dunkelbrauner, leicht viskoser, steriler flüssiger Komplex aus Eisenhydroxid und Dextran zur intravenösen oder intramuskulären Anwendung.
Jeder ml enthält das Äquivalent von 50 mg elementarem Eisen (als Eisen-Dextran-Komplex), etwa 0,9% Natriumchlorid, in Wasser für Injektionszwecke. Zur Einstellung des pH-Werts kann Natriumhydroxid und/oder Salzsäure verwendet worden sein. Der pH-Wert der Lösung liegt zwischen 4,5 und 7,0.
Therapeutische Klasse: Hämatinikum
KLINISCHE PHARMAKOLOGIE:
Allgemein: Nach intramuskulärer Injektion wird Eisendextran von der Injektionsstelle in die Kapillaren und das Lymphsystem absorbiert. Das zirkulierende Eisendextran wird durch Zellen des retikuloendothelialen Systems aus dem Plasma entfernt, die den Komplex in seine Bestandteile Eisen und Dextran aufspalten. Das Eisen wird sofort an die verfügbaren Proteinkomponenten gebunden und bildet Hämosiderin oder Ferritin, die physiologischen Formen des Eisens, oder in geringerem Maße Transferrin. Dieses Eisen, das einer physiologischen Kontrolle unterliegt, füllt das Hämoglobin und die erschöpften Eisenspeicher auf.
Dextran, eine Polyglukose, wird entweder verstoffwechselt oder ausgeschieden. Nach der Verabreichung von Eisendextran gehen nur vernachlässigbare Mengen Eisen über den Urin oder den Verdauungstrakt verloren.
Der größte Teil der intramuskulären Injektionen von Eisendextran wird innerhalb von 72 Stunden absorbiert; der größte Teil des verbleibenden Eisens wird in den darauffolgenden 3 bis 4 Wochen absorbiert.
Verschiedene Studien mit intravenös verabreichtem 59Fe-Eisendextran an Personen mit Eisenmangel, von denen einige gleichzeitig erkrankt waren, ergaben Halbwertszeiten von 5 Stunden bis zu mehr als 20 Stunden. Der 5-Stunden-Wert wurde für 59Fe-Eisendextran in einer Studie ermittelt, bei der Labormethoden zur Trennung des zirkulierenden 59Fe-Eisendextrans vom transferringebundenen 59Fe verwendet wurden. Der 20-Stunden-Wert spiegelt eine Halbwertszeit wider, die durch Messung des gesamten 59Fe, sowohl des zirkulierenden als auch des gebundenen, ermittelt wurde. Es ist zu beachten, dass diese Halbwertszeiten nicht die Ausscheidung von Eisen aus dem Körper widerspiegeln. Eisen wird nicht leicht aus dem Körper ausgeschieden, und eine Anhäufung von Eisen kann toxisch sein.
In-vitro-Studien haben gezeigt, dass die Entfernung von Eisendextran durch Dialyse vernachlässigbar ist.1,2 Sechs verschiedene Dialysatormembranen wurden untersucht (Polysulfon, Cuprophan, Celluloseacetat, Cellulosetriacetat, Polymethylmethacrylat und Polyacrylnitril), darunter auch solche, die als hocheffizient und mit hohem Durchfluss gelten.
INDIKATIONEN UND ANWENDUNG:
Intravenöse oder intramuskuläre Injektionen von Infed sind indiziert für die Behandlung von Patienten mit nachgewiesenem Eisenmangel, bei denen eine orale Verabreichung nicht zufriedenstellend oder unmöglich ist.
KONTRAINDIKATIONEN:
Überempfindlichkeit gegen das Produkt. Alle Anämien, die nicht mit Eisenmangel verbunden sind.
WARNHINWEISE:
Risiko für Reaktionen vom anaphylaktischen Typ: Nach der parenteralen Verabreichung von Eisendextran sind Reaktionen vom anaphylaktischen Typ, einschließlich Todesfälle, aufgetreten. Während der Verabreichung von Infed sollten immer Wiederbelebungsgeräte und in der Erkennung und Behandlung von Reaktionen vom anaphylaktischen Typ geschultes Personal zur Verfügung stehen. Vor der ersten therapeutischen Dosis ist eine Testdosis von 0,5 ml Infed zu verabreichen. (Siehe ANWENDUNG UND VERABREICHUNG.) Obwohl Reaktionen in der Regel innerhalb weniger Minuten auftreten, sollten die Patienten mindestens eine Stunde lang beobachtet werden, bevor die therapeutische Dosis verabreicht wird. Während aller Verabreichungen von Infed sind die Patienten auf Anzeichen oder Symptome anaphylaktischer Reaktionen zu beobachten. Tödliche Reaktionen sind nach der Testdosis von Eisendextran aufgetreten und auch in Situationen, in denen die Testdosis vertragen wurde. Verwenden Sie Infed nur bei Patienten, bei denen klinische und Laboruntersuchungen einen Eisenmangel ergeben haben, der nicht auf eine orale Eisentherapie anspricht.
Die Faktoren, die das Risiko für anaphylaktische Reaktionen auf Eisendextranprodukte beeinflussen, sind nicht vollständig bekannt, aber begrenzte klinische Daten deuten darauf hin, dass das Risiko bei Patienten mit einer Arzneimittelallergie in der Vorgeschichte oder mehreren Arzneimittelallergien erhöht sein könnte. Außerdem kann die gleichzeitige Einnahme von Arzneimitteln, die Angiotensin-konvertierende Enzyme hemmen, das Risiko für Reaktionen auf ein Eisendextranprodukt erhöhen. Das Ausmaß des Risikos für Reaktionen vom anaphylaktischen Typ nach Exposition gegenüber einem bestimmten Eisendextranprodukt ist nicht bekannt und kann von Produkt zu Produkt variieren.
Eisendextranprodukte unterscheiden sich in ihren chemischen Eigenschaften und können unterschiedliche klinische Wirkungen haben. Eisendextranprodukte sind klinisch nicht austauschbar.
Verzögerte Reaktionen: Große intravenöse Dosen, wie sie bei Gesamtinfusionen (TDI) verwendet werden, wurden mit einer erhöhten Inzidenz von unerwünschten Wirkungen in Verbindung gebracht. Bei den unerwünschten Wirkungen handelt es sich häufig um verzögerte (1-2 Tage) Reaktionen, die durch eines oder mehrere der folgenden Symptome gekennzeichnet sind: Arthralgie, Rückenschmerzen, Schüttelfrost, Schwindelgefühl, mäßiges bis hohes Fieber, Kopfschmerzen, Unwohlsein, Myalgie, Übelkeit und Erbrechen. Der Beginn liegt in der Regel 24-48 Stunden nach der Verabreichung, und die Symptome klingen im Allgemeinen innerhalb von 3-4 Tagen ab. Die Ätiologie dieser Reaktionen ist nicht bekannt. Das Potenzial für eine verzögerte Reaktion muss bei der Abschätzung des Risikos/Nutzens der Behandlung berücksichtigt werden.
Die maximale Tagesdosis sollte 2 ml unverdünntes Eisendextran nicht überschreiten.
Risiko bei Patienten mit Grunderkrankungen: Infed sollte bei Patienten mit schwerer Beeinträchtigung der Leberfunktion nur mit äußerster Vorsicht angewendet werden. Es sollte nicht während der akuten Phase einer infektiösen Nierenerkrankung angewendet werden.
Nebenwirkungen, die nach der Verabreichung von Infed auftreten, können kardiovaskuläre Komplikationen bei Patienten mit vorbestehenden kardiovaskulären Erkrankungen verschlimmern.
Kanzerogenese: Die intramuskuläre Injektion von Eisen-Kohlenhydrat-Komplexen kann ein Risiko der Karzinogenese mit sich bringen. Es wurde festgestellt, dass solche Komplexe unter experimentellen Bedingungen Sarkome hervorrufen, wenn Ratten, Mäusen und Kaninchen große Dosen oder kleine Dosen wiederholt an der gleichen Stelle injiziert wurden, und möglicherweise auch bei Hamstern.
Die lange Latenzzeit zwischen der Injektion eines potenziellen Karzinogens und dem Auftreten eines Tumors macht es unmöglich, das Risiko beim Menschen genau zu messen. Es gibt jedoch mehrere Berichte in der Literatur, in denen Tumore an der Injektionsstelle bei Menschen beschrieben werden, die zuvor intramuskuläre Injektionen von Eisen-Kohlenhydrat-Komplexen erhalten hatten.
HINWEISE:
Allgemein: Eine unangemessene Therapie mit parenteralem Eisen führt zu einer übermäßigen Speicherung von Eisen mit der daraus resultierenden Möglichkeit einer exogenen Hämosiderose. Eine solche Eisenüberladung kann insbesondere bei Patienten mit Hämoglobinopathien und anderen refraktären Anämien auftreten, die fälschlicherweise als Eisenmangelanämie diagnostiziert werden könnten.
Infed sollte bei Personen mit erheblichen Allergien und/oder Asthma in der Vorgeschichte mit Vorsicht angewendet werden. Anaphylaxie und andere Überempfindlichkeitsreaktionen wurden sowohl nach ereignislosen Testdosen als auch nach therapeutischen Dosen der Eisendextran-Injektion berichtet. Daher sollte vor der ersten therapeutischen Dosis von Infed eine Testdosis verabreicht werden. (Siehe WARNHINWEIS und DOSIERUNG UND ANWENDUNG: ANWENDUNG.)
Epinephrin sollte im Falle von akuten Überempfindlichkeitsreaktionen sofort verfügbar sein. (Übliche Dosis für Erwachsene: 0,5 ml einer 1:1000-Lösung, durch subkutane oder intramuskuläre Injektion). Hinweis: Patienten, die Betablocker verwenden, sprechen möglicherweise nicht ausreichend auf Epinephrin an. Bei diesen Patienten kann Isoproterenol oder ein ähnlicher Beta-Agonist erforderlich sein.
Bei Patienten mit rheumatoider Arthritis kann es nach der Verabreichung von Infed zu einer akuten Verschlimmerung von Gelenkschmerzen und -schwellungen kommen.
Berichte in der Literatur aus Ländern außerhalb der Vereinigten Staaten (insbesondere Neuseeland) deuten darauf hin, dass die Anwendung von intramuskulärem Eisendextran bei Neugeborenen mit einer erhöhten Inzidenz von gramnegativer Sepsis, hauptsächlich durch E. Coli, in Verbindung gebracht wurde.
Informationen für Patienten: Die Patienten sollten auf die möglichen Nebenwirkungen im Zusammenhang mit der Anwendung von Infed hingewiesen werden.
Wechselwirkungen zwischen Arzneimitteln und Labortests: Es wurde berichtet, dass große Dosen von Eisendextran (5 ml oder mehr) das Serum einer Blutprobe, die 4 Stunden nach der Verabreichung entnommen wurde, braun färben können.
Das Arzneimittel kann falsch erhöhte Serumbilirubinwerte und falsch erniedrigte Serumcalciumwerte verursachen. Serum-Eisen-Bestimmungen (insbesondere durch kolorimetrische Assays) sind möglicherweise 3 Wochen nach der Verabreichung von Eisendextran nicht aussagekräftig.
Das Serum-Ferritin erreicht etwa 7 bis 9 Tage nach einer intravenösen Dosis Infed einen Spitzenwert und kehrt nach etwa 3 Wochen langsam auf den Ausgangswert zurück.
Untersuchungen des Knochenmarks auf Eisenspeicher sind möglicherweise über längere Zeiträume nach einer Eisendextran-Therapie nicht aussagekräftig, da Rest-Eisendextran in den retikuloendothelialen Zellen verbleiben kann.
Knochenscans mit 99m Tc-Diphosphonat zeigen 1 bis 6 Tage nach intramuskulären Injektionen von Eisendextran einen dichten, sichelförmigen Aktivitätsbereich im Gesäß, der der Kontur des Beckenkamms folgt.
Knochenscans mit 99m Tc-markierten Knochensuchmitteln bei hohen Serumferritinwerten oder nach Eisendextran-Infusionen zeigen Berichten zufolge eine verminderte Knochenaufnahme, eine ausgeprägte Nierenaktivität und eine übermäßige Anhäufung von Blutpools und Weichteilen.
Karzinogenese, Mutagenese, Beeinträchtigung der Fruchtbarkeit: Siehe WARNHINWEISE.
Schwangerschaft: Eisendextran hat sich bei Mäusen, Ratten, Kaninchen, Hunden und Affen als teratogen und embryozidal erwiesen, wenn es in Dosen verabreicht wurde, die etwa dem Dreifachen der maximalen menschlichen Dosis entsprechen.
Bei Mäusen, Ratten, Kaninchen, Hunden und Affen wurden bei Dosen von 50 mg Eisen/kg oder weniger keine konsistenten schädlichen fötalen Wirkungen beobachtet. Fötale und maternale Toxizität wurde bei Affen bei einer intravenösen Gesamtdosis von 90 mg Eisen/kg über einen Zeitraum von 14 Tagen festgestellt. Ähnliche Wirkungen wurden bei Mäusen und Ratten nach Verabreichung einer Einzeldosis von 125 mg Eisen/kg beobachtet. Fötale Anomalien wurden bei Ratten und Hunden bei Dosen von 250 mg Eisen/kg und höher beobachtet. Die für diese Tests verwendeten Tiere hatten keinen Eisenmangel. Es gibt keine angemessenen und gut kontrollierten Studien an schwangeren Frauen. Infed sollte während der Schwangerschaft nur angewendet werden, wenn der mögliche Nutzen das mögliche Risiko für den Fötus rechtfertigt.
Plazentarer Transfer: Verschiedene tierexperimentelle Studien und Studien an schwangeren Menschen haben nicht schlüssige Ergebnisse in Bezug auf den Plazentatransfer von Eisendextran als Eisendextran gezeigt. Es scheint, dass etwas Eisen den Fötus erreicht, aber die Form, in der es die Plazenta durchquert, ist nicht klar.
Stillende Mütter: Bei der Verabreichung von Infed an eine stillende Frau ist Vorsicht geboten. Spuren von nicht verstoffwechseltem Eisendextran werden in die Muttermilch ausgeschieden.
Anwendung bei Kindern: Nicht empfohlen für die Anwendung bei Säuglingen unter 4 Monaten. (Siehe DOSIERUNG UND ANWENDUNG.)
UNERWÜNSCHTE REAKTIONEN:
Schwerwiegend/tödlich: Anaphylaktische Reaktionen wurden im Zusammenhang mit der Anwendung von Eisendextran-Injektionen berichtet; in einigen Fällen waren diese Reaktionen tödlich. Solche Reaktionen, die meist innerhalb der ersten Minuten nach der Verabreichung auftreten, sind im Allgemeinen durch plötzliches Auftreten von Atemnot und/oder Herz-Kreislauf-Kollaps gekennzeichnet. Da nach der Verabreichung von Eisendextran-Injektionen über tödliche anaphylaktische Reaktionen berichtet wurde, sollte das Arzneimittel nur verabreicht werden, wenn Wiederbelebungsmaßnahmen und die Behandlung eines anaphylaktischen und anaphylaktoiden Schocks ohne weiteres möglich sind. (Siehe WARNHINWEIS und VORSICHTSMASSNAHMEN: ALLGEMEINES, betreffend die sofortige Verfügbarkeit von Epinephrin.)
Kardiovaskulär: Brustschmerzen, Engegefühl in der Brust, Schock, Herzstillstand, Hypotonie, Hypertonie, Tachykardie, Bradykardie, Flushing, Arrhythmien. (Flushing und Hypotonie können bei zu schneller intravenöser Injektion auftreten.)
Dermatologisch: Urtikaria, Pruritus, Purpura, Hautausschlag, Zyanose.
Gastrointestinal: Bauchschmerzen, Übelkeit, Erbrechen, Durchfall.
Hämatologisch/lymphatisch: Leukozytose, Lymphadenopathie.
Muskuloskelettale/Weichgewebe: Arthralgie, Arthritis (kann eine Reaktivierung bei Patienten mit ruhender rheumatoider Arthritis darstellen – siehe VORSICHTSHINWEISE: ALLGEMEINES), Myalgie, Rückenschmerzen, steriler Abszess, Atrophie/Fibrose (intramuskuläre Injektionsstelle), braune Verfärbung der Haut und/oder des darunter liegenden Gewebes, Schmerzen an oder in der Nähe der intramuskulären Injektionsstelle, Zellulitis, Schwellung, Entzündung, lokale Venenentzündung an oder in der Nähe der intravenösen Injektionsstelle.
Neurologische Erkrankungen: Konvulsionen, Krampfanfälle, Synkopen, Kopfschmerzen, Schwäche, Unempfindlichkeit, Parästhesien, Fieberschübe, Schüttelfrost, Schwindel, Desorientierung, Taubheit, Bewusstlosigkeit.
Atemstörungen: Atemstillstand, Dyspnoe, Bronchospasmus, Keuchen.
Urologisch: Hämaturie.
Verzögerte Reaktionen: Arthralgie, Rückenschmerzen, Schüttelfrost, Schwindel, Fieber, Kopfschmerzen, Unwohlsein, Myalgie, Übelkeit, Erbrechen. (Siehe WARNHINWEISE).
Sonstiges: Fieberschübe, Schwitzen, Frösteln, Schüttelfrost, Unwohlsein, veränderter Geschmack.
ÜBERDOSIERUNG:
Es ist unwahrscheinlich, dass eine Überdosierung mit Eisen-Dextran mit akuten Manifestationen verbunden ist. Eine Überdosierung von Eisendextran über den Bedarf zur Wiederherstellung des Hämoglobins und zur Auffüllung der Eisenspeicher hinaus kann zu einer Hämosiderose führen. Die regelmäßige Überwachung des Ferritinspiegels im Serum kann hilfreich sein, um eine schädliche fortschreitende Anhäufung von Eisen zu erkennen, die aus einer gestörten Aufnahme von Eisen aus dem retikuloendothelialen System bei gleichzeitigen Erkrankungen wie chronischem Nierenversagen, Morbus Hodgkin und rheumatoider Arthritis resultiert. Die LD50 von Eisendextran beträgt nicht weniger als 500 mg/kg bei der Maus.
DOSIERUNG UND ANWENDUNG:
Orales Eisen sollte vor der Verabreichung von Infed abgesetzt werden.
Dosierung:
I. Eisenmangelanämie: Die regelmäßige hämatologische Bestimmung (Hämoglobin und Hämatokrit) ist ein einfaches und genaues Verfahren zur Überwachung der hämatologischen Reaktion und sollte als Leitfaden für die Therapie verwendet werden. Es sollte berücksichtigt werden, dass die Eisenspeicherung hinter dem Auftreten einer normalen Blutmorphologie zurückbleiben kann. Serumeisen, die Gesamteisenbindungskapazität (TIBC) und die prozentuale Sättigung von Transferrin sind weitere wichtige Tests zum Nachweis und zur Überwachung des Eisenmangelzustands.
Nach der Verabreichung von Eisendextran-Komplex lässt sich innerhalb weniger Tage eine therapeutische Reaktion in Form eines Anstiegs der Retikulozytenzahl feststellen.
Obwohl das Serumferritin in der Regel ein guter Anhaltspunkt für die körpereigenen Eisenspeicher ist, ist die Korrelation zwischen den körpereigenen Eisenspeichern und dem Serumferritin bei Patienten mit chronischer Nierendialyse, die auch Eisendextran-Komplex erhalten, möglicherweise nicht gültig.
Obwohl es bei Männern und Frauen erhebliche Unterschiede im Körperbau und in der Gewichtsverteilung gibt, stellen die beigefügte Tabelle und die Formel ein geeignetes Mittel zur Schätzung des Gesamteisenbedarfs dar. Dieser Gesamteisenbedarf spiegelt die Eisenmenge wider, die erforderlich ist, um die Hämoglobinkonzentration wieder auf ein normales oder nahezu normales Niveau zu bringen, zuzüglich einer zusätzlichen Menge, um die Eisenspeicher bei den meisten Personen mit mäßig oder stark reduzierten Hämoglobinwerten angemessen aufzufüllen. Es ist zu bedenken, dass eine Eisenmangelanämie erst dann auftritt, wenn im Wesentlichen alle Eisenspeicher geleert sind. Die Therapie sollte daher nicht nur auf die Auffüllung des Hämoglobin-Eisens, sondern auch auf die Auffüllung der Eisenspeicher abzielen.
Die Faktoren, die zur Formel beitragen, sind nachstehend aufgeführt.
 Auf der Grundlage der oben genannten Faktoren haben Personen mit normalen Hämoglobinwerten etwa 33 mg Eisen im Blut pro Kilogramm Körpergewicht (15 mg/lb).
Auf der Grundlage der oben genannten Faktoren haben Personen mit normalen Hämoglobinwerten etwa 33 mg Eisen im Blut pro Kilogramm Körpergewicht (15 mg/lb).
Hinweis: Die Tabelle und die dazugehörige Formel gelten nur für die Dosierungsbestimmung bei Patienten mit Eisenmangelanämie; sie dürfen nicht für die Dosierungsbestimmung bei Patienten verwendet werden, die eine Eisensubstitution bei Blutverlust benötigen.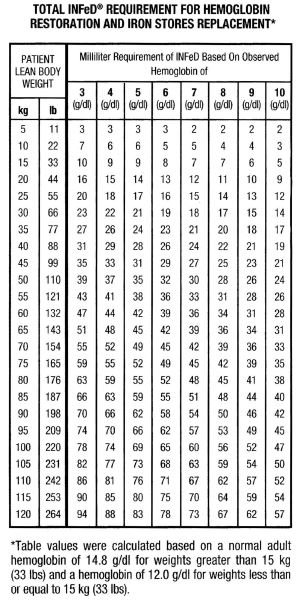
Die Gesamtmenge an Infed in ml, die zur Behandlung der Anämie und zur Auffüllung der Eisenspeicher erforderlich ist, kann wie folgt geschätzt werden:
II. Eisenersatz bei Blutverlust: Einige Personen erleiden intermittierende oder wiederholte Blutverluste. Solche Blutverluste können periodisch bei Patienten mit hämorrhagischen Diathesen (familiäre Teleangiektasie, Hämophilie, gastrointestinale Blutungen) und wiederholt bei Verfahren wie der renalen Hämodialyse auftreten.
Die Eisentherapie sollte bei diesen Patienten auf den Ersatz der entsprechenden Eisenmenge gerichtet sein, die im Blutverlust enthalten ist. Die unter I. Eisenmangelanämie beschriebene Tabelle und Formel sind für einfache Eisenersatzwerte nicht anwendbar.
Quantitative Schätzungen des periodischen Blutverlustes und des Hämatokrits der Person während der Blutungsepisode bieten eine bequeme Methode zur Berechnung der erforderlichen Eisendosis.
Die nachstehende Formel basiert auf der Näherung, dass 1 ml normozytärer, normochromer Erythrozyten 1 mg elementares Eisen enthält:
Ersatz-Eisen (in mg) = Blutverlust (in ml) x Hämatokrit
Beispiel: Blutverlust von 500 mL bei 20% Hämatokrit
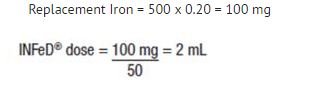
Verabreichung:
Die Gesamtmenge von Infed, die für die Behandlung von Eisenmangelanämie oder Eisenersatz bei Blutverlust erforderlich ist, wird anhand der Tabelle oder der entsprechenden Formel bestimmt. (Siehe DOSIERUNG).
1. Intravenöse Injektion – VOR DER ERSTEN INTRAVENÖSEN THERAPEUTISCHEN DOSIERUNG EINE INTRAVENÖSE TESTDOSE VON 0,5 ML VERABREICHEN. VERABREICHEN SIE DIE TESTDOSIS SCHRITTWEISE ÜBER MINDESTENS 30 SEKUNDEN. Obwohl anaphylaktische Reaktionen, von denen bekannt ist, dass sie nach der Verabreichung von Infed auftreten, in der Regel innerhalb weniger Minuten oder früher auftreten, wird empfohlen, einen Zeitraum von einer Stunde oder länger verstreichen zu lassen, bevor der Rest der therapeutischen Anfangsdosis verabreicht wird.
Einzeldosen von 2 ml oder weniger können täglich verabreicht werden, bis die berechnete erforderliche Gesamtmenge erreicht ist. Infed wird unverdünnt mit einer langsamen, allmählichen Geschwindigkeit verabreicht, die 50 mg (1 ml) pro Minute nicht überschreiten darf.
2. Intramuskuläre Injektion – VOR DER ERSTEN INTRAMUSKULÄREN THERAPEUTISCHEN DOSIERUNG VON INFED EINE INTRAMUSKULÄRE TESTDOSE VON 0,5 ML VERABREICHEN. (Siehe WARNHINWEISE und VORSICHTSMASSNAHMEN.) Die Testdosis sollte in die Gesäßbacke verabreicht werden, wobei die gleiche Technik wie im letzten Absatz dieses Abschnitts beschrieben anzuwenden ist. Obwohl anaphylaktische Reaktionen, von denen bekannt ist, dass sie nach der Verabreichung von Infed auftreten, in der Regel innerhalb weniger Minuten oder früher auftreten, wird empfohlen, mindestens eine Stunde oder länger zu warten, bevor der Rest der therapeutischen Anfangsdosis verabreicht wird.
Wenn keine unerwünschten Reaktionen beobachtet werden, kann Infed nach dem folgenden Schema verabreicht werden, bis die berechnete Gesamtmenge erreicht ist. Die Tagesdosis sollte normalerweise 0,5 ml (25 mg Eisen) für Säuglinge unter 5 kg, 1,0 ml (50 mg Eisen) für Kinder unter 10 kg und 2,0 ml (100 mg Eisen) für andere Patienten nicht überschreiten.
Infed sollte nur in die Muskelmasse des oberen äußeren Quadranten des Gesäßes injiziert werden – niemals in den Arm oder andere freiliegende Bereiche – und sollte mit einer 19- oder 20-Gauge-Nadel mit einem Durchmesser von 2 oder 3 Zoll tief injiziert werden. Wenn der Patient steht, sollte er sein Gewicht auf das der Injektionsstelle gegenüberliegende Bein verlagern, oder wenn er im Bett liegt, sollte er sich in Seitenlage befinden, wobei die Injektionsstelle nach oben zeigen sollte. Um eine Injektion oder ein Auslaufen in das subkutane Gewebe zu vermeiden, wird eine Z-Spur-Technik (Verschiebung der Haut seitlich vor der Injektion) empfohlen.
HINWEIS: Infed darf nicht mit anderen Medikamenten gemischt oder parenteralen Ernährungslösungen zur intravenösen Infusion zugesetzt werden.
Parenteral verabreichte Arzneimittel sollten vor der Verabreichung visuell auf Partikel und Verfärbungen untersucht werden, sofern die Lösung und der Behälter dies zulassen.
VERSORGUNGSWEISE:
Infed (Iron Dextran Injection USP), das 50 mg elementares Eisen pro ml enthält, ist in 2-mL-Einzel-Dosis-Bernsteinflaschen (zur intramuskulären oder intravenösen Anwendung) in Kartons zu 10 Stück erhältlich (NDC 0023-6082-10).
Lagerung bei 20 -25°C (68 -77°F).
Nur Rx

Für alle medizinischen Anfragen wenden Sie sich an:
Allergan
Medical Communications
1-800-678-1605
Vertrieben durch:
Allergan USA, Inc.
Madison, NJ 07940
Hergestellt von:
Patheon Italia S.p.A.
Ferentino, Italien 03013
© 2019 Allergan. Alle Rechte vorbehalten.
Infed® ist eine eingetragene Marke von Allergan Sales, LLC.
Allergan® und sein Design sind Marken von Allergan, Inc.
Inhalt aktualisiert: November 2018
v.1.1USPI6082
MUSTERKENNZEICHNUNG


| Infed Eisendextran-Injektion |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Etikettierer -. Allgemeine Injektionsmittel & Vaccines, Inc. (108250663)
Mehr über Infed (Eisendextran)
- Nebenwirkungen
- Während der Schwangerschaft oder Stillzeit
- Dosierungshinweise
- Medikamentöse Wechselwirkungen
- Preisangaben &Gutscheine
- En Español
- Drogenklasse: Eisenpräparate
Ressourcen für Verbraucher
- Patienteninformationen
- Infed (Advanced Reading)
Ressourcen für Fachleute
- Rezeptinformationen
- Eisen Hydriertes Dextran (FDA)
Andere Marken Dexferrum
Verwandte Behandlungsleitfäden
- Anämie in Verbindung mit chronischem Nierenversagen
- Eisenmangelanämie
Medizinischer Haftungsausschluss