Kehittämisperiaate
Voidaksemme määrittää minkä tahansa tietyn atomin elektronikonfiguraation voimme ”rakentaa” rakenteet järjestyksessä järjestyksessä järjestyksessä atomien lukumäärän mukaan. Aloittaen vedystä ja jatkaen jaksollisen järjestelmän jaksojen läpi, lisäämme ytimeen yhden protonin kerrallaan ja yhden elektronin sopivaan alikuoreen, kunnes olemme kuvanneet kaikkien alkuaineiden elektronikonfiguraatiot. Tätä menettelyä kutsutaan Aufbau-periaatteeksi, joka tulee saksankielisestä sanasta Aufbau (”rakentaa”). Kukin lisätty elektroni asettuu pienimmän käytettävissä olevan energian alakuoreen (kuvassa \(\PageIndex{3}\) esitetyssä järjestyksessä) Paulin poissulkemisperiaatteen mukaisten sallittujen kvanttilukujen asettamien rajoitusten mukaisesti. Elektronit siirtyvät korkeamman energian alikuoriin vasta sen jälkeen, kun alemman energian alikuoret on täytetty täyteen. Kuva \(\PageIndex{3}\) havainnollistaa perinteistä tapaa muistaa atomiorbitaalien täyttöjärjestys.
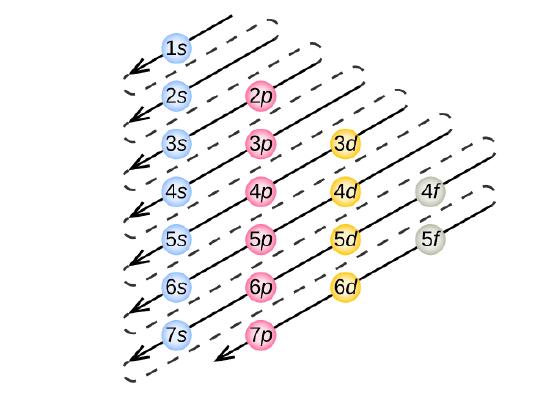
Koska jaksollisen järjestelmän järjestely perustuu elektronikonfiguraatioihin, kuva \(\PageIndex{4}\) tarjoaa vaihtoehtoisen menetelmän elektronikonfiguraation määrittämiseksi. Täyttöjärjestys alkaa yksinkertaisesti vedystä ja sisältää jokaisen alikuoren, kun edetään Z-järjestyksen kasvaessa. Esimerkiksi 3p-lohkon täyttämisen jälkeen Ar:iin asti nähdään, että orbitaaliksi tulee 4s (K, Ca), jonka jälkeen tulevat 3d-orbitaalit.
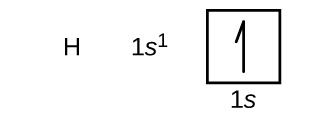
Konstruoimme nyt perustilan elektronikonfiguraation ja orbitaalidiagrammin valituille atomeille jaksollisen järjestelmän ensimmäisestä ja toisesta jaksosta. Orbitaalidiagrammit ovat elektronikonfiguraation kuvallisia esityksiä, joissa näkyvät yksittäiset orbitaalit ja elektronien pariutumisjärjestys. Aloitetaan yhdestä vetyatomista (järjestysluku 1), joka koostuu yhdestä protonista ja yhdestä elektronista. Viitaten joko kuvaan \(\PageIndex{3}\) tai \(\PageIndex{4}\) odotamme löytävämme elektronin 1s-orbitaalista. Konvention mukaan \(m_s=+\dfrac{1}{2}\) arvo täytetään yleensä ensin. Elektronikonfiguraatio ja orbitaalikaavio ovat:
Vedyn jälkeen seuraa jalokaasu helium, jonka järjestysluku on 2. Heliumatomi sisältää kaksi protonia ja kaksi elektronia. Ensimmäisellä elektronilla on samat neljä kvanttilukua kuin vetyatomin elektronilla (n = 1, l = 0, ml = 0, \(m_s=+\dfrac{1}{2}\)). Toinen elektroni menee myös 1s:n orbitaaliin ja täyttää tämän orbitaalin. Toisella elektronilla on samat n-, l- ja ml-kvanttiluvut, mutta sillä on oltava vastakkainen spin-kvanttiluku, \(m_s=-\dfrac{1}{2}\). Tämä on sopusoinnussa Paulin poissulkemisperiaatteen kanssa: saman atomin kahdella elektronilla ei voi olla samaa neljän kvanttiluvun joukkoa. Orbitaalidiagrammeissa tämä tarkoittaa, että kumpaankin laatikkoon menee kaksi nuolta (jotka edustavat kahta elektronia kussakin orbitaalissa), ja nuolien on osoitettava vastakkaisiin suuntiin (jotka edustavat parittaisia spinejä). Heliumin elektronikonfiguraatio ja orbitaalidiagrammi ovat:
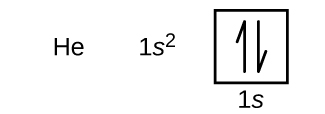
Heliumatomissa n = 1 -kuori on täysin täynnä.
Seuraava atomi on alkalimetalli litium, jonka järjestysluku on 3. Litiumin kaksi ensimmäistä elektronia täyttävät 1s-orbitaalin, ja niillä on samat neljän kvanttiluvun joukot kuin heliumin kahdella elektronilla. Jäljelle jäävän elektronin on täytettävä seuraavaksi pienimmän energian orbitaali, 2s-orbitaali (kuva \(\PageIndex{3}\) tai \(\PageIndex{4}\)). Litiumin elektronikonfiguraatio ja orbitaalidiagrammi ovat siis:
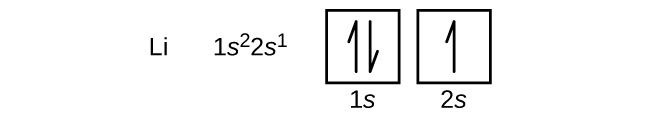
Emäksisen maametallin berylliumin atomi, jonka järjestysluku on 4, sisältää neljä protonia ytimessä ja neljä elektronia ytimen ympärillä. Neljäs elektroni täyttää jäljellä olevan tilan 2s-orbitaalissa.
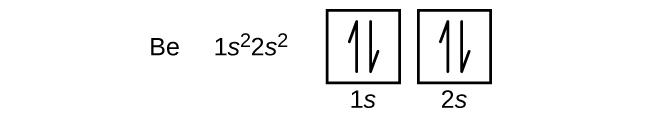
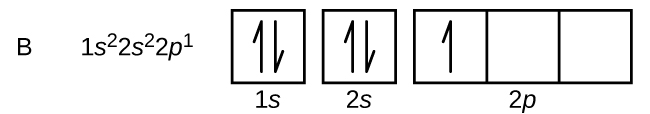
Boorin (järjestysluku 5) atomi sisältää viisi elektronia. N = 1 -kuori täyttyy kahdella elektronilla ja kolme elektronia miehittää n = 2 -kuoren. Koska mikä tahansa s-alakuori voi sisältää vain kaksi elektronia, viidennen elektronin on vallattava seuraava energiataso, joka on 2p-orbitaali. Degeneroituneita 2p-orbitaaleja on kolme (ml = -1, 0, +1), ja elektroni voi miehittää minkä tahansa näistä p-orbitaaleista. Orbitaalikaavioita piirtäessämme otamme mukaan tyhjiä laatikoita kuvaamaan mahdollisia tyhjiä orbitaaleja samassa alikuoressa, jota olemme täyttämässä.
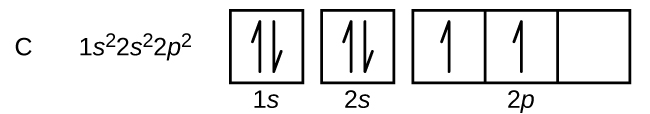
Hiilellä (atomiluku 6) on kuusi elektronia. Niistä neljä täyttää 1s ja 2s -orbitaalit. Loput kaksi elektronia miehittävät 2p-alakuoren. Nyt voimme valita, täytämmekö yhden 2p-orbitaaleista ja paritamme elektronit vai jätämmekö elektronit parittomiksi kahteen eri, mutta degeneroituneeseen p-orbitaaliin. Orbitaalit täytetään Hundin säännön mukaisesti: atomilla, jonka elektronit ovat degeneroituneiden orbitaalien joukossa, on alhaisimman energian konfiguraatio, jossa on suurin määrä parittomia elektroneja. Näin ollen hiilen 2p-orbitaalien kahdella elektronilla on identtiset n-, l- ja ms-kvanttiluvut ja ne eroavat toisistaan ml-kvanttiluvun osalta (Paulin poissulkemisperiaatteen mukaisesti). Hiilen elektronikonfiguraatio ja orbitaalidiagrammi ovat:
Typpi (järjestysluku 7) täyttää 1s ja 2s-alakuoret ja sillä on yksi elektroni jokaisessa kolmessa 2p-orbitaalissa Hundin säännön mukaisesti. Näillä kolmella elektronilla on parittomat spinit. Hapella (järjestysluku 8) on elektronipari missä tahansa 2p-orbitaalissa (elektroneilla on vastakkaiset spinit) ja yksi elektroni kummassakin muussa 2p-orbitaalissa. Fluorilla (järjestysluku 9) on vain yksi 2p-orbitaali, joka sisältää parittoman elektronin. Jalokaasun neonin (järjestysluku 10) kaikki elektronit ovat parittaisia, ja kaikki n=1- ja n=2-kuorien orbitaalit ovat täynnä. Näiden neljän alkuaineen elektronikonfiguraatiot ja orbitaalikaaviot ovat:
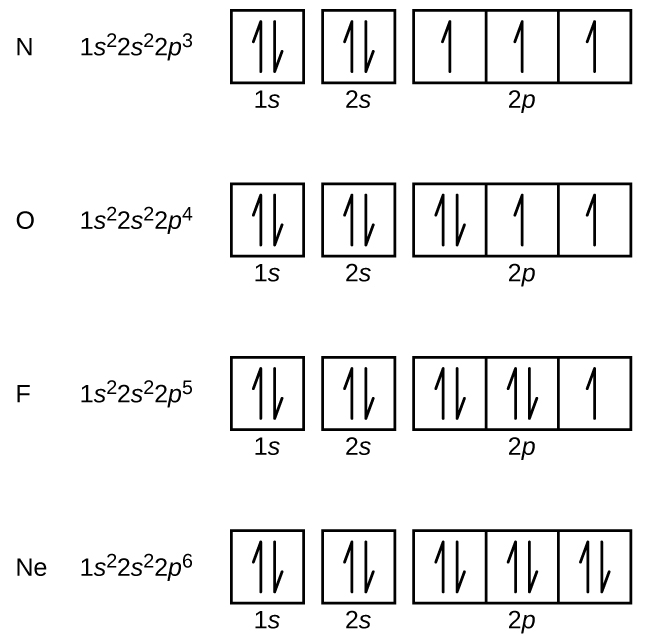
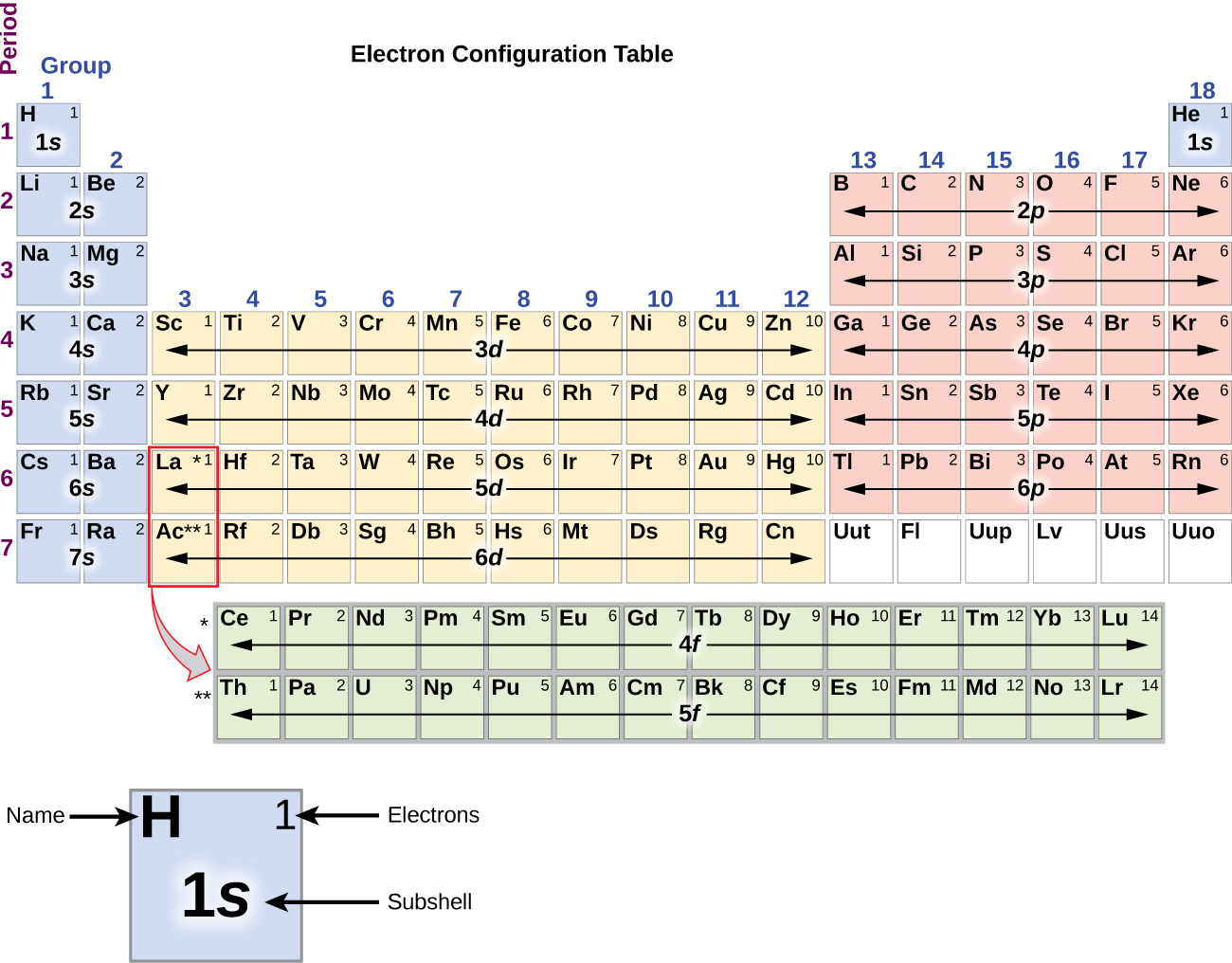
Alkalimetalli natriumilla (järjestysluku 11) on yksi elektroni enemmän kuin neonatomilla. Tämän elektronin on siirryttävä matalimman energian omaavaan alikuoreen, 3s:n orbitaaliin, jolloin saadaan konfiguraatio 1s22s22p63s1. Ulkoisimman kuoren orbitaalin tai orbitaalien (n:n korkein arvo) miehittämiä elektroneja kutsutaan valenssielektroneiksi ja sisempiä kuoren orbitaaleja miehittäviä elektroneja ydinelektroneiksi ( Kuva \PageIndex5\PageIndex5). Koska ydinelektronien kuoret vastaavat jalokaasujen elektronikonfiguraatioita, voimme lyhentää elektronikonfiguraatioita kirjoittamalla ydinelektronikonfiguraatiota vastaavan jalokaasun sekä valenssielektronit lyhennetyssä muodossa. Natrium-esimerkissämme symboli edustaa ydinelektroneita, (1s22s22p6) ja lyhennetty tai tiivistetty konfiguraatiomme on 3s1.

Vastaavasti litiumin lyhennetty konfiguraatio voidaan esittää muodossa 2s1, jossa edustaa heliumatomin konfiguraatiota, joka on identtinen litiumin täytetyn sisäkuoren kanssa. Konfiguraatioiden kirjoittaminen tällä tavalla korostaa litiumin ja natriumin konfiguraatioiden samankaltaisuutta. Molemmilla alkalimetallien perheeseen kuuluvilla atomeilla on vain yksi elektroni valenssin s-alakuoressa täytetyn sisäkuorten joukon ulkopuolella.
\}\}\,2s^1\\\ \ce{Na:}\,3s^1\]
Alkaalinen maametalli magnesium (järjestysluku 12), jolla on 12 elektronia konfiguraatiossaan 3s2, on analoginen perheeseensä kuuluvan berylliumin 2s2-rakenteen kanssa. Molemmilla atomeilla on täytetty s-alakuori täytettyjen sisäkuoriensa ulkopuolella. Alumiini (järjestysluku 13), jolla on 13 elektronia ja elektronikonfiguraatio 3s23p1, on analoginen perheenjäsenensä boorin, 2s22p1, kanssa.
Piin (14 elektronia), fosforin (15 elektronia), rikin (16 elektronia), kloorin (17 elektronia) ja argonin (18 elektronia) elektronikonfiguraatiot ovat ulkokuorensa elektronikonfiguraatioiltaan analogisia vastaavien perheenjäsentensä hiilen, typen, hapen, fluorin ja neonin kanssa sillä erotuksella, että raskaampien alkuaineitten ulkokuoren pääkvanttiluku on kasvanut yhdellä ja on nykyään n = 3. Kuvassa \(\PageIndex{6}\) on esitetty näiden alkuaineiden matalimman energian eli perustilan elektronikonfiguraatio sekä kunkin tunnetun alkuaineen atomin elektronikonfiguraatio.
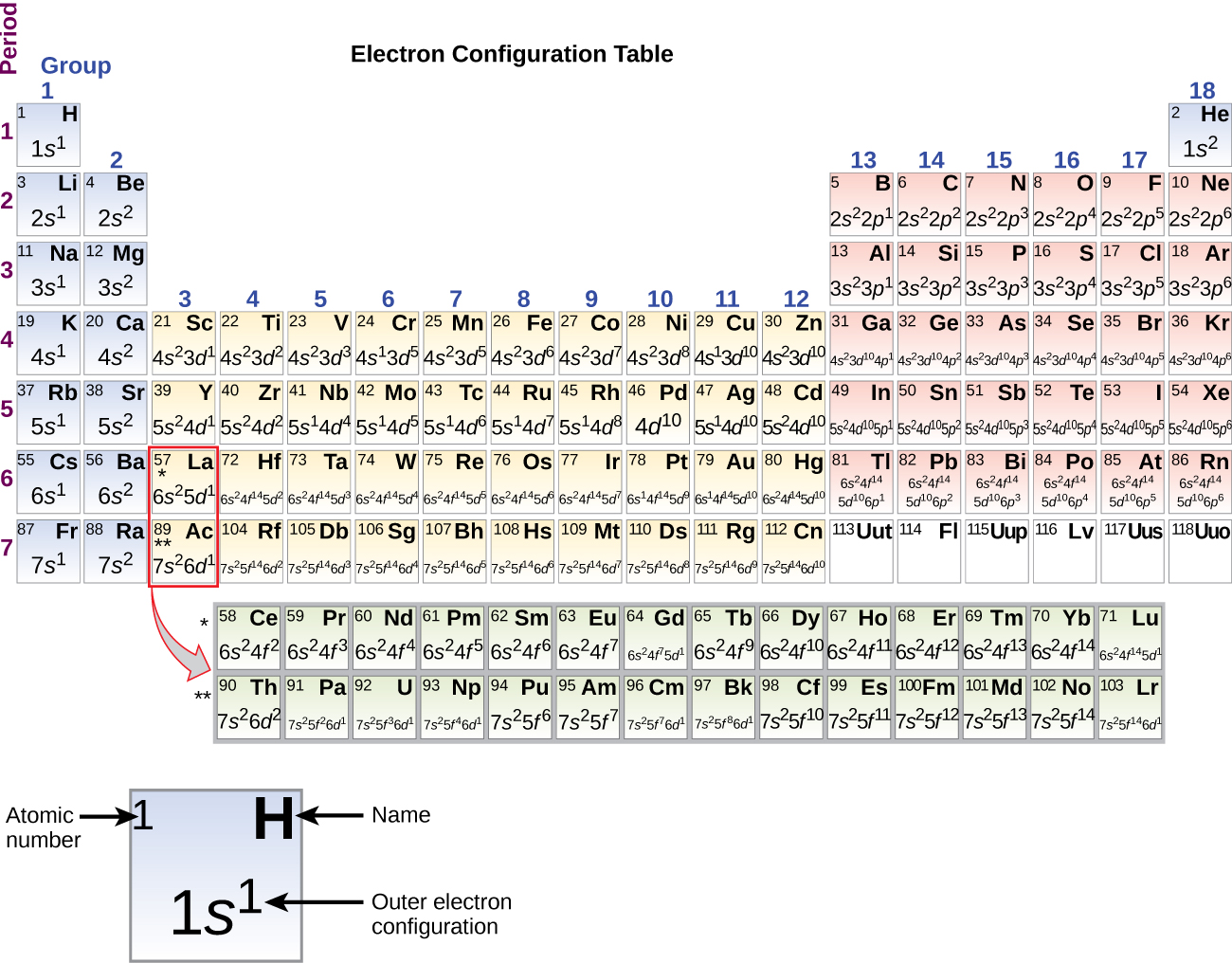
Kun tulemme jaksollisen järjestelmän seuraavaan alkuaineeseen, alkalimetalli kaliumiin (järjestysluku 19), voisimme olettaa, että alkaisimme lisätä elektroneja 3d-alakuoreen. Kaikki käytettävissä olevat kemialliset ja fysikaaliset todisteet viittaavat kuitenkin siihen, että kalium on litiumin ja natriumin kaltainen ja että seuraavaa elektronia ei lisätä 3d-tasolle, vaan se lisätään 4s-tasolle (kuva \(\(\PageIndex{3}\) tai \(\(\PageIndex{4}\)). Kuten aiemmin käsiteltiin, 3d-orbitaali, jolla ei ole säteittäisiä solmuja, on energialtaan korkeampi, koska se on vähemmän läpäisevä ja enemmän suojattu ytimestä kuin 4s-taso, jolla on kolme säteittäistä solmua. Kaliumin elektronikonfiguraatio on siis 4s1. Näin ollen kalium vastaa valenssikuoren konfiguraatioltaan Li:tä ja Na:ta. Seuraava elektroni lisätään 4s-alakuoren täydentämiseksi, ja kalsiumin elektronikonfiguraatio on 4s2. Näin kalsiumilla on ulkokuoren elektronikonfiguraatio, joka vastaa berylliumin ja magnesiumin elektronikonfiguraatiota.
Alkaen siirtymämetalli skandiumista (järjestysluku 21) lisätään peräkkäin lisää elektroneja 3d-alakuoreen. Tämä alakuori täyttyy kapasiteettiinsa asti 10 elektronilla (muistetaan, että kun l = 2 , ml:n arvoja on 2l + 1 = 5, mikä tarkoittaa, että d-orbitaaleja, joiden yhteenlaskettu kapasiteetti on 10 elektronia, on viisi). Seuraavaksi täyttyy 4p-alakuori. Huomaa, että kolmessa alkuaineiden sarjassa, skandiumista (Sc) kuparin (Cu) kautta, yttriumista (Y) hopean (Ag) kautta ja lutetiumista (Lu) kullan (Au) kautta, yhteensä 10 d-elektronia lisätään peräkkäin n-kuoren vieressä olevaan (n – 1)-kuoreen, jotta (n – 1)-kuori nousee 8:sta 18:aan elektroniin. Kahdessa sarjassa, lantaanista (La) lutetiumin (Lu) kautta ja aktiniumista (Ac) lakrensiumin (Lr) kautta, lisätään peräkkäin 14 f-elektronia (l = 3, 2l + 1 = 7 ml-arvoa; siis seitsemän orbitaalia, joiden yhteenlaskettu kapasiteetti on 14 elektronia) peräkkäin (n – 2)-kuoreen, jotta tuo kuori nousee 18:sta 32:een elektroniin.”
Esimerkki \\(\Sivunindeksi{1}\): Kvanttiluvut ja elektronikonfiguraatiot
Mikä on fosforiatomin elektronikonfiguraatio ja orbitaalidiagrammi? Mitkä ovat viimeiseksi lisätyn elektronin neljä kvanttilukua?
Ratkaisu
Fosforin atomiluku on 15. Fosforiatomi sisältää siis 15 elektronia. Energiatasojen täyttymisjärjestys on 1s, 2s, 2p, 3s, 3p, 4s, … . Fosforiatomin 15 elektronia täyttyvät 3p-orbitaaliin asti, jossa on kolme elektronia:
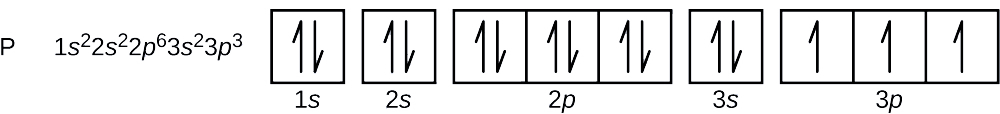
Viimeisenä lisätty elektroni on 3p-elektroni. Näin ollen n = 3 ja p-tyypin orbitaalille l = 1. ml:n arvo voi olla -1, 0 tai +1. Kolme p-orbitaalia ovat degeneroituneita, joten mikä tahansa näistä ml-arvoista on oikea. Parittomien elektronien spin-kvanttiluvun arvoksi on sovittu \(+\dfrac{1}{2}\), joten \(m_s=+\dfrac{1}{2}\).
Harjoitus \(\PageIndex{1}\)
Tunnista atomit annetuista elektronikonfiguraatioista:
- 4s23d5
- 5s24d105p6
Vastaus a
Mn
Vastaus b
Xe
Jaksollinen jaksollinen järjestelmä voi olla tehokas apuväline alkuaineen elektronikonfiguraation ennustamisessa. Orbitaalien täyttöjärjestyksestä löytyy kuitenkin poikkeuksia, jotka on esitetty kuvassa \(\PageIndex{3}\) tai \(\PageIndex{4}\). Esimerkiksi muun muassa siirtymämetallien kromin (Cr; järjestysluku 24) ja kuparin (Cu; järjestysluku 29) elektronikonfiguraatiot eivät ole sellaisia, joita voisimme odottaa. Yleensä tällaisissa poikkeustapauksissa on kyse alakuorista, joiden energia on hyvin samankaltainen, ja pienet vaikutukset voivat johtaa muutoksiin täyttöjärjestyksessä.
Crin ja Cun tapauksessa havaitsemme, että puoliksi täytetyt ja kokonaan täytetyt alakuoret edustavat ilmeisesti edullisen vakauden olosuhteita. Tämä stabiilisuus on sellainen, että elektroni siirtyy 4s:n orbitaalista 3d-orbitaaliin saadakseen puoliksi täytetyn 3d-alakuoren (Cr:ssä) tai täytetyn 3d-alakuoren (Cu:ssa) ylimääräisen stabiilisuuden. Myös muita poikkeuksia esiintyy. Esimerkiksi niobiumilla (Nb, järjestysluku 41) ennustetaan olevan elektronikonfiguraatio 5s24d3. Kokeellisesti havaitaan, että sen perustilan elektronikonfiguraatio on itse asiassa 5s14d4. Voimme selittää tämän havainnon järkevästi sanomalla, että elektroni-elektroni-törmäys, joka aiheutuu elektronien parittumisesta 5s-rataalilla, on suurempi kuin 5s- ja 4d-orbitaalien välinen energiaero. Ei ole olemassa yksinkertaista menetelmää, jolla voitaisiin ennustaa poikkeuksia atomeille, joissa elektronien välisten vastusten suuruus on suurempi kuin pienet energiaerot alikuorten välillä.