Generaattinen nimi: rautadekstraani
annosmuoto: injektio
Lääketieteellisesti tarkistanut Drugs.com. Viimeksi päivitetty 1. joulukuuta 2019.
- Yleiskatsaus
- Haittavaikutukset
- Adostus
- Erikoislääkäri
- Vuorovaikutukset
- Lisätiedot
Rautadekstraani-injektion parenteraalista antoa on seurannut anafylaktisen reaktion tyyppisiä reaktioita, mukaan lukien kuolemantapauksia.
- Huolehdi siitä, että Infed®-valmisteen antamisen aikana on helposti saatavilla elvytysvälineitä ja henkilökuntaa, joka on koulutettu anafylaktisen tyyppisten reaktioiden havaitsemiseen ja hoitoon.
- Anna koe Infed®-annos ennen ensimmäistä terapeuttista annosta. Jos testiannoksen jälkeen ei ilmene anafylaktisen reaktion merkkejä tai oireita, anna täysi terapeuttinen Infed®-annos.
- Kaikkien Infed®-annosten aikana on tarkkailtava anafylaktisen reaktion merkkejä tai oireita. Kuolemaan johtaneita reaktioita on seurannut rautadekstraani-injektion testiannosta. Kuolemaan johtaneita reaktioita on esiintynyt myös tilanteissa, joissa testiannos oli siedetty.
- Käytä Infed® -valmistetta vain potilailla, joilla kliinisissä ja laboratoriotutkimuksissa on todettu raudanpuutostila, jota ei voida hoitaa suun kautta otettavalla rautahoidolla.
- Potilailla, joilla on aiemmin esiintynyt lääkeallergiaa tai useita eri lääkeaineille altistavia allergiaoireita, voi olla kohonnut anafylaksia-tyyppisten reaktioiden vaara Infed® -valmisteelle. Natriumhydroksidia ja/tai suolahappoa on saatettu käyttää pH:n säätämiseen. Liuoksen pH on välillä 4,5-7,0.
Terapeuttinen luokka: Hematiini
KLIININEN FARMAKOLOGIA:
Yleistä: Lihaksensisäisen injektion jälkeen rautadekstraani imeytyy injektiokohdasta kapillaareihin ja imusuonistoon. Verenkierrossa oleva rautadekstraani poistuu plasmasta retikuloendoteelisysteemin solujen toimesta, jotka pilkkovat kompleksin rauta- ja dekstraanikomponenteiksi. Rauta sitoutuu välittömästi käytettävissä oleviin proteiiniyksiköihin muodostaen hemosideriiniä tai ferritiiniä, jotka ovat raudan fysiologisia muotoja, tai vähäisemmässä määrin transferriiniä. Tämä fysiologisen kontrollin alainen rauta täydentää hemoglobiinia ja tyhjentyneitä rautavarastoja.
Dekstraani, joka on polyglukoosi, joko metaboloituu tai erittyy. Vähäisiä määriä rautaa menetetään virtsan tai ruuansulatuskanavan kautta rautadekstraanin antamisen jälkeen.
Suurin osa lihaksensisäisesti annetusta rautadekstraanista imeytyy 72 tunnin kuluessa; suurin osa jäljelle jäävästä raudasta imeytyy seuraavien 3-4 viikon aikana.
Erilaisissa tutkimuksissa, joissa 59Fe-rautadekstraania annettiin suonensisäisesti raudanpuutteisille henkilöille, joista joillakin oli samanaikaisia sairauksia, on saatu puoliintumisaika-arvoja, jotka vaihtelevat 5 tunnista yli 20 tuntiin. Viiden tunnin arvo määritettiin 59Fe-rautadekstraanille tutkimuksessa, jossa käytettiin laboratoriomenetelmiä kiertävän 59Fe-rautadekstraanin erottamiseksi transferriiniin sitoutuneesta 59Fe:stä. 20 tunnin arvo kuvastaa puoliintumisaikaa, joka määritettiin mittaamalla sekä kiertävän että sitoutuneen 59Fe:n kokonaismäärä. On ymmärrettävä, että nämä puoliintumisajat eivät kuvaa raudan poistumista elimistöstä. Rauta ei poistu elimistöstä helposti, ja raudan kertyminen voi olla myrkyllistä.
In vitro -tutkimukset ovat osoittaneet, että rautadekstraanin poistuminen dialyysin avulla on vähäistä.1,2. Tutkittiin kuutta erilaista dialysaattorikalvoa (polysulfoni, kuprofaani, selluloosa-asetaatti, selluloosatriasetaatti, polymetyylimetakrylaatti ja polyakryylinitriili), mukaan luettuina ne, joita pidettiin suuritehoisena ja -virtauksisina.
VALMISTEYHTEENVETO JA KÄYTTÖAIHEET:
Intravenoosi- tai intramuskulaariset Infed-injektiot ovat tarkoitettu sellaisten potilaiden hoitoon, joilla on todettu raudanpuute ja joilla suun kautta annostelu ei ole tyydyttävää tai se on mahdotonta.
VALMISTEYHTEENVETO:
Yliherkkyys tuotteelle. Kaikki anemiat, jotka eivät liity raudanpuutteeseen.
VAROITUKSET:
Anafylaktisen tyyppisten reaktioiden riski: Anafylaktisen tyyppisiä reaktioita, mukaan lukien kuolemantapauksia, on seurannut rautadekstraanin parenteraalista antoa. Infedin antamisen aikana on aina oltava helposti saatavilla elvytysvälineitä ja anafylaktisen reaktion tunnistamiseen ja hoitoon koulutettua henkilökuntaa. Ennen ensimmäistä terapeuttista annosta on annettava 0,5 ml:n koeannos Infediä. (Katso kohta ANNOSTUS JA ANNOSTUS.) Vaikka reaktiot ilmenevät yleensä muutamassa minuutissa, tarkkaile potilaita vähintään tunnin ajan ennen terapeuttisen annoksen antamista. Kaikkien Infed-annosten aikana potilaita on tarkkailtava anafylaktisen tyyppisten reaktioiden merkkien tai oireiden varalta. Kuolemaan johtaneita reaktioita on seurannut rautadekstraanin koeannosta, ja niitä on esiintynyt myös tilanteissa, joissa koeannos oli siedetty. Käytä Infed-valmistetta vain potilaille, joilla kliinisissä ja laboratoriotutkimuksissa on todettu raudanpuutostila, jota ei voida hoitaa suun kautta annettavalla rautahoidolla.
Tekijöitä, jotka vaikuttavat anafylaktisen tyyppisten reaktioiden riskiin rautadekstraanivalmisteiden suhteen, ei täysin tunneta, mutta rajalliset kliiniset tiedot viittaavat siihen, että riski voi olla suurentunut potilailla, joilla on aiemmin esiintynyt lääkeallergiaa tai joilla on ollut useita eri lääkeaineita koskevia allergioita. Lisäksi angiotensiinikonvertaasientsyymin estäjiä sisältävien lääkkeiden samanaikainen käyttö voi lisätä rautadekstraanivalmisteen aiheuttamien reaktioiden riskiä. Anafylaksia-tyyppisten reaktioiden riskin suuruus altistumisen jälkeen jollekin tietylle rautadekstraanivalmisteelle ei ole tiedossa, ja se voi vaihdella valmistekohtaisesti.
Rautadekstraanivalmisteet eroavat toisistaan kemiallisilta ominaisuuksiltaan ja voivat erota toisistaan kliinisten vaikutusten suhteen. Rautadekstraanivalmisteet eivät ole kliinisesti keskenään vaihdettavissa.
Viivästyneet reaktiot: Suuret laskimonsisäiset annokset, kuten kokonaisannosinfuusioissa (TDI) käytetyt, on yhdistetty haittavaikutusten lisääntyneeseen esiintyvyyteen. Haittavaikutukset ovat usein viivästyneitä (1-2 päivää) reaktioita, joille on tyypillistä yksi tai useampi seuraavista oireista: nivelkipu, selkäkipu, vilunväristykset, huimaus, kohtalainen tai korkea kuume, päänsärky, huonovointisuus, lihassärky, pahoinvointi ja oksentelu. Oireet alkavat yleensä 24-48 tunnin kuluttua annostelusta, ja ne häviävät yleensä 3-4 päivän kuluessa. Näiden reaktioiden etiologiaa ei tunneta. Viivästyneen reaktion mahdollisuus on otettava huomioon arvioitaessa hoidon riskiä/hyötyä.
Vuorokautinen enimmäisannos ei saa ylittää 2 ml laimentamatonta rautadekstraania.
Riski potilailla, joilla on perussairauksia: Infediä tulee käyttää äärimmäisen varovaisesti potilailla, joilla on vakava maksan toiminnan heikkeneminen. Sitä ei saa käyttää tarttuvan munuaissairauden akuutin vaiheen aikana.
Infedin antamisen jälkeen koetut haittavaikutukset voivat pahentaa sydän- ja verisuonikomplikaatioita potilailla, joilla on ennestään sydän- ja verisuonitauti.
Karsinogeneesi: Rauta-hiilihydraattikompleksien lihaksensisäiseen injektioon saattaa liittyä karsinogeneesin riski. Tällaisten kompleksien on kokeellisissa olosuhteissa todettu aiheuttavan sarkoomaa, kun rotille, hiirille ja kaneille ja mahdollisesti hamstereille on annettu suuria annoksia tai pieniä annoksia, jotka on pistetty toistuvasti samaan kohtaan.
Potentiaalisen syöpää aiheuttavan aineen injektion ja kasvaimen ilmaantumisen välinen pitkä latentti aika tekee mahdottomaksi riskin tarkan mittaamisen ihmisellä. Kirjallisuudessa on kuitenkin useita raportteja, joissa kuvataan kasvaimia injektiokohdassa ihmisillä, jotka olivat aiemmin saaneet lihaksensisäisiä injektioita rauta-hiilihydraattikomplekseja.
VAROITUKSET:
Yleistä: Perusteeton hoito parenteraalisella raudalla aiheuttaa raudan liiallista varastoitumista, mistä seuraa eksogeenisen hemosideroosin mahdollisuus. Tällaista raudan ylikuormitusta esiintyy erityisesti potilailla, joilla on hemoglobinopatioita ja muita refraktorisia anemioita, jotka saatetaan virheellisesti diagnosoida raudanpuuteanemioiksi.
Infediä on käytettävä varoen henkilöille, joilla on aiemmin ollut merkittäviä allergioita ja/tai astmaa. Anafylaksiaa ja muita yliherkkyysreaktioita on raportoitu sekä rauhattomien koeannosten että terapeuttisten rautadekstraani-injektioannosten jälkeen. Sen vuoksi anna testiannos ennen ensimmäistä terapeuttista Infed-annosta. (Katso BOXED WARNING ja DOSAGE AND ADMINISTRATION: ADMINISTRATION.)
Epinefriiniä on oltava välittömästi saatavilla akuuttien yliherkkyysreaktioiden varalta. (Tavallinen aikuisten annos: 0,5 ml 1:1000 liuosta ihonalaisena tai lihaksensisäisenä injektiona). Huomautus: Beetasalpaajia käyttävät potilaat eivät välttämättä reagoi riittävästi adrenaliiniin. Näillä potilailla saatetaan tarvita isoproterenolia tai vastaavia beeta-agonisteja.
Nivelreumaa sairastavilla potilailla nivelkipu ja -turvotus saattavat pahentua akuutisti Infedin antamisen jälkeen.
Yhdysvaltojen ulkopuolisista maista (erityisesti Uudesta-Seelannista) saadut kirjallisuusraportit ovat viitanneet siihen, että lihaksensisäisen rautadekstraanin käyttöön vastasyntyneillä on liittynyt lisääntynyt gramnegatiivisen sepsiksen ilmaantuvuus, joka johtuu ensisijaisesti E. Coli -bakteerin aiheuttamasta verenmyrkytyksestä.
Tietoa potilaille:
Lääkkeiden ja laboratoriokokeiden yhteisvaikutukset: Potilaille on kerrottava Infedin käyttöön liittyvistä mahdollisista haittavaikutuksista: Suurten rautadekstraaniannosten (5 ml tai enemmän) on raportoitu antavan seerumille ruskean värin 4 tunnin kuluttua annostelusta otetusta verinäytteestä.
Lääke voi aiheuttaa virheellisesti kohonneita seerumin bilirubiiniarvoja ja virheellisesti alentuneita seerumin kalsiumarvoja. Seerumin rautamääritykset (erityisesti kolorimetriset määritykset) eivät välttämättä ole mielekkäitä 3 viikkoon rautadekstraanin antamisen jälkeen.
Serumin ferritiini saavuttaa huippunsa noin 7-9 päivää Infedin laskimonsisäisen annoksen jälkeen ja palautuu hitaasti lähtötasolle noin 3 viikon kuluttua.
Luuytimen tutkiminen rautavarastojen varalta ei välttämättä ole mielekästä pitkiin aikoihin rautadekstraanihoidon jälkeen, koska jäännösrautadekstraania saattaa jäädä retikuloendoteliaalisoluihin.
99m Tc-difosfonaattia sisältävien luustokuvausten on raportoitu osoittavan tiheän, puolikuun muotoisen aktiivisen alueen pakaroissa, joka seuraa suoliluun harjan ääriviivoja, 1-6 päivän kuluttua lihaksensisäisistä rautadekstraanin injektioista.
Luunkuvauksissa, joissa on käytetty 99m Tc-leimattuja luun etsintäaineita, seerumin korkeiden ferritiinipitoisuuksien esiintyessä tai rautadekstraani-infuusioiden jälkeen, on raportoitu osoittavan luun hyväksikäytön vähenemistä, merkittävää munuaisaktiivisuutta ja liiallista veripooli- ja pehmytkudoskertymää.
Karsinogeneesi, mutageenisuus, hedelmällisyyden heikkeneminen: Katso VAROITUKSET.
Raskaus: Rautadekstraanin on osoitettu olevan teratogeeninen ja alkiontuhooja hiirillä, rotilla, kaneilla, koirilla ja apinoilla, kun sitä on annettu annoksina, jotka ovat noin 3 kertaa suuremmat kuin ihmisen enimmäisannos.
Hiirillä, rotilla, kaneilla, koirilla ja apinoilla ei havaittu johdonmukaisia haitallisia vaikutuksia sikiöön annoksilla, jotka olivat 50 mg rautaa/kg tai vähemmän. Apinoilla on raportoitu sikiö- ja äititoksisuutta, kun laskimonsisäinen kokonaisannos oli 90 mg rautaa/kg 14 päivän aikana. Hiirillä ja rotilla havaittiin samanlaisia vaikutuksia annettaessa kerta-annos 125 mg rautaa/kg. Rotilla ja koirilla havaittiin sikiön poikkeavuuksia annoksilla 250 mg rautaa/kg ja suuremmilla annoksilla. Näissä testeissä käytetyt eläimet eivät olleet raudanpuutteisia. Riittäviä ja hyvin kontrolloituja tutkimuksia raskaana olevilla naisilla ei ole. Infediä tulee käyttää raskauden aikana vain, jos mahdollinen hyöty oikeuttaa sikiölle mahdollisesti aiheutuvan riskin.
Placental Transfer: Erilaiset eläinkokeet ja raskaana olevilla ihmisillä tehdyt tutkimukset ovat osoittaneet epäselviä tuloksia rautadekstraanin istukansiirrosta rautadekstraanina. Näyttää siltä, että jonkin verran rautaa pääsee sikiöön, mutta ei ole selvää, missä muodossa se kulkee istukan läpi.
Imettävät äidit: Varovaisuutta on noudatettava, kun Infediä annetaan imettävälle naiselle. Ihmisen maitoon erittyy pieniä määriä metaboloitumatonta rautadekstraania.
Lasten käyttö: Ei suositella käytettäväksi alle 4 kuukauden ikäisille imeväisille. (Ks. kohta ANNOSTUS JA ANNOSTUS.)
HAITTAVAIKUTUKSET:
Vaikeat/kuolemaan johtaneet reaktiot: Rautadekstraani-injektion käytön yhteydessä on raportoitu anafylaktisia reaktioita; toisinaan nämä reaktiot ovat johtaneet kuolemaan. Tällaisille reaktioille, jotka ilmenevät useimmiten ensimmäisten muutamien minuuttien kuluessa annostelusta, on yleensä ollut ominaista äkillisesti alkanut hengitysvaikeus ja/tai sydän- ja verenkiertoelimistön romahtaminen. Koska rautadekstrani-injektion antamisen jälkeen on raportoitu kuolemaan johtaneita anafylaktisia reaktioita, lääkettä saa antaa vain, jos elvytystekniikat ja anafylaktisen ja anafylaktoidisen sokin hoito ovat helposti saatavilla. (Katso PAKKAUSVAROITUS ja VAROITUKSET: YLEISTÄ, jotka koskevat adrenaliinin välitöntä saatavuutta.)
Kardiovaskulaarinen: Rintakipu, rintakehän kireys, sokki, sydänpysähdys, hypotensio, hypertensio, takykardia, bradykardia, punoitus, rytmihäiriöt. (Huuhtelua ja hypotensiota voi esiintyä liian nopeasta suonensisäisestä injektiosta.)
Dermatologiset: Urtikaria, pruritus, purppura, ihottuma, syanoosi.
Ruuansulatuskanava: Vatsakipu, pahoinvointi, oksentelu, ripuli.
Hematologinen/lymfaattinen:
Lihas- ja luustokudos / pehmytkudos: Leukosytoosi, lymfadenopatia.
Lihas- ja luustokudos / pehmytkudos: Niveltulehdus, niveltulehdus (voi edustaa reaktivaatiota potilailla, joilla on lepotilassa oleva nivelreuma – ks. varotoimet: YLEISTÄ), myalgia; selkäkipu; steriili paise, atrofia/fibroosi (lihaksensisäinen injektiokohta); ihon ja/tai alla olevan kudoksen ruskea värjäytyminen (värjäytyminen), arkuus tai kipu lihaksensisäisissä injektiokohdissa tai niiden läheisyydessä; selluliitti; turvotus; tulehdus; paikallinen laskimotulehdus laskimonsisäisessä injektiokohdassa tai sen läheisyydessä.
Neurologiset: Kouristukset, kouristukset, pyörtyminen, päänsärky, heikkous, reagoimattomuus, parestesia, kuumeiset kohtaukset, vilunväristykset, huimaus, sekavuus, puutuminen, tunnottomuus, tajuttomuus.
Hengitystie: Hengitystiepysähdys, hengenahdistus, bronkospasmi, hengityksen vinkuminen.
Urologiset: Hematuria.
Viivästyneet reaktiot: Nivelkipu, selkäkipu, vilunväristykset, huimaus, kuume, päänsärky, huonovointisuus, myalgia, pahoinvointi, oksentelu. (Katso VAROITUKSET).
Muut: Kuumejaksot, hikoilu, vapina, vilunväristykset, huonovointisuus, muuttunut maku.
YLIANNOSTUS:
Yliannostukseen rautadekstraanilla ei todennäköisesti liity akuutteja ilmenemismuotoja. Rautadekstranin annokset, jotka ylittävät hemoglobiinin palautumisen ja rautavarastojen täydentämisen tarpeet, voivat johtaa hemosideroosiin. Seerumin ferritiinipitoisuuksien säännöllisestä seurannasta voi olla apua tunnistettaessa haitallinen etenevä raudan kertyminen, joka johtuu raudan heikentyneestä imeytymisestä verkkokalvo-endoteelisysteemistä samanaikaisissa sairauksissa, kuten kroonisessa munuaisten vajaatoiminnassa, Hodgkinin taudissa ja nivelreumassa. Rautadekstraanin LD50 on vähintään 500 mg/kg hiirellä.
ANNOSTELU JA ANNOSTUS:
Oraalinen raudan anto on lopetettava ennen Infedin antoa.
ANNOSTELU:
I. Raudanpuuteanemia: Määräaikainen hematologinen määritys (hemoglobiini ja hematokriitti) on yksinkertainen ja tarkka tekniikka hematologisen vasteen seuraamiseksi, ja sitä tulisi käyttää hoidon ohjeena. On otettava huomioon, että raudan varastoituminen voi viivästyä veren normaalin morfologian ilmenemisestä. Seerumin rauta, raudan kokonaissitomiskapasiteetti (TIBC) ja transferriinin prosentuaalinen kyllästys ovat muita tärkeitä testejä raudanpuutostilan havaitsemiseksi ja seuraamiseksi.
Rautadekstraanikompleksin antamisen jälkeen näyttöä terapeuttisesta vasteesta voidaan havaita muutamassa päivässä retikulosyyttien määrän lisääntymisenä.
Vaikka seerumin ferritiini on yleensä hyvä osoitus elimistön rautavarastoista, elimistön rautavarastojen ja seerumin ferritiinin välinen korrelaatio ei välttämättä päde kroonista munuaisdialyysiä saavilla potilailla, jotka saavat myös rautadekstraanikompleksia.
Vaikka ruumiinrakenteessa ja painon jakautumisessa on huomattavia eroja miesten ja naisten välillä, oheinen taulukko ja kaava ovat kätevä apuväline raudan kokonaistarpeen arvioimiseksi. Tämä raudan kokonaistarve kuvastaa sitä rautamäärää, joka tarvitaan hemoglobiinipitoisuuden palauttamiseksi normaalille tai lähes normaalille tasolle, lisättynä lisäraudalla, joka riittää täydentämään rautavarastoja useimmilla henkilöillä, joiden hemoglobiinipitoisuus on kohtalaisesti tai vakavasti alentunut. On muistettava, että raudanpuuteanemia ilmenee vasta, kun kaikki rautavarastot ovat käytännössä tyhjentyneet. Hoidon tulisi siis pyrkiä hemoglobiinin raudan lisäksi myös rautavarastojen täydentämiseen.
Tekijät, jotka vaikuttavat kaavaan, on esitetty alla.
 Yllämainittujen tekijöiden perusteella henkilöillä, joiden hemoglobiinipitoisuus on normaali, on noin 33 mg rautaa veressä ruumiinpainokiloa kohti (15 mg/lb).
Yllämainittujen tekijöiden perusteella henkilöillä, joiden hemoglobiinipitoisuus on normaali, on noin 33 mg rautaa veressä ruumiinpainokiloa kohti (15 mg/lb).Huomautus: Taulukkoa ja siihen liittyvää kaavaa voidaan soveltaa annostuksen määrittämiseen ainoastaan raudanpuuteanemiaa sairastaville potilaille; niitä ei tule käyttää annostuksen määrittämiseen potilaille, jotka tarvitsevat raudan korvaamista verenhukan vuoksi.
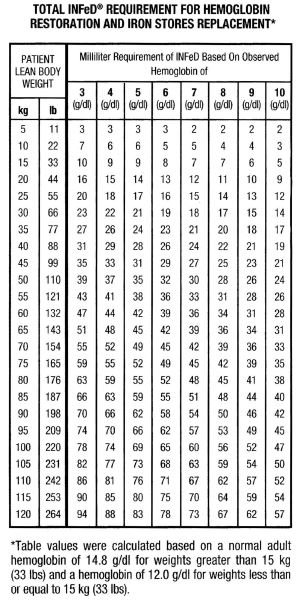
Anemian hoitoon ja rautavarastojen täydentämiseen tarvittava Infedin kokonaismäärä millilitroina voidaan arvioida likimääräisesti seuraavasti:

II. Rautakorvaus verenhukan vuoksi: Joillakin henkilöillä on ajoittaisia tai toistuvia verenmenetyksiä. Tällaista verenhukkaa voi esiintyä ajoittain potilailla, joilla on verenvuototauti (familiaalinen telangiektasia; hemofilia; ruoansulatuskanavan verenvuoto), ja toistuvasti verenhukan kaltaisten toimenpiteiden, kuten munuaisten hemodialyysin, yhteydessä.
Rautahoito näillä potilailla olisi suunnattava verenhukkaa vastaavan rautamäärän korvaamiseen. Kohdassa I. Raudanpuuteanemia kuvattua taulukkoa ja kaavaa ei voida soveltaa yksinkertaisiin raudan korvausarvoihin.
Kohtaan I. Raudanpuuteanemia kuvattua taulukkoa ja kaavaa ei voida soveltaa yksinkertaisiin raudan korvausarvoihin.
Kohtaan I. Raudanpuuteanemia kuvattua taulukkoa ja kaavaa ei voida soveltaa yksinkertaisiin raudan korvausarvoihin.
Kohtaan II kuvattua taulukkoa ja kaavaa ei voida soveltaa.
Alhaalla esitetty kaava perustuu approksimaatioon, jonka mukaan 1 ml normosyyttisiä, normokromisia punasoluja sisältää 1 mg alkuainerautaa:
Rautakorvausrauta (mg:ina) = verenhukka (ml:ina) x hematokriitti
Esimerkki: Verenhukka 500 ml, kun hematokriitti on 20 %
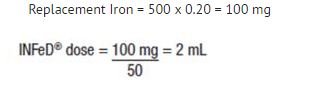
Hoito:
Raudanpuuteanemian hoitoon tai raudan korvaamiseen verenhukan vuoksi tarvittavan Infedin kokonaismäärä määritetään taulukosta tai sopivasta kaavasta. (Ks. kohta ANNOSTUS).
1. Laskimonsisäinen injektio – ENNEN ENSIMMÄISTÄ INTRAVENOONAISTA Infed-TERAPIA-ANNOSTA ANNETAAN INTRAVENOONAINEN 0,5 ML:n TESTIANNOS. ANNA TESTIANNOS ASTEITTAIN VÄHINTÄÄN 30 SEKUNNIN AJAN. Vaikka Infedin antamisen jälkeen tiedossa olevat anafylaktiset reaktiot ilmenevät yleensä muutamassa minuutissa tai aikaisemmin, on suositeltavaa, että kuluu vähintään tunti ennen kuin loput ensimmäisestä terapeuttisesta annoksesta annetaan.
Yksittäisiä 2 ml:n tai pienempiä annoksia voidaan antaa päivittäin, kunnes laskennallinen kokonaistarve on saavutettu. Infed annetaan laimentamattomana hitaasti asteittain enintään 50 mg (1 ml) minuutissa.
2. Lihakseen annettava injektio – ENNEN ENSIMMÄISTÄ INTRAMUSKULAARISTA INFED-TERAPIA-ANNOSTA ANNETAAN 0,5 ML:n suuruinen INTRAMUSKULAARINEN TESTIANNOS. (Ks. PAKKAUSVAROITUS ja VAROTOIMENPITEET.) Testiannos on annettava pakaraan käyttäen samaa tekniikkaa, joka on kuvattu tämän kohdan viimeisessä kappaleessa. Vaikka Infedin antamisen jälkeen tiedossa olevat anafylaktiset reaktiot ilmenevät yleensä muutamassa minuutissa tai aikaisemmin, on suositeltavaa, että vähintään tunti tai pidempi aika kuluu ennen kuin loput ensimmäisestä terapeuttisesta annoksesta annetaan.
Jos haittavaikutuksia ei ole havaittu, Infediä voidaan antaa seuraavan aikataulun mukaisesti, kunnes laskennallisesti tarvittava kokonaismäärä on saavutettu. Kunkin päivän annos ei tavallisesti saa ylittää 0,5 ml:aa (25 mg rautaa) alle 5 kg:n painoisille imeväisille, 1,0 ml:aa (50 mg rautaa) alle 10 kg:n painoisille lapsille ja 2,0 ml:aa (100 mg rautaa) muille potilaille.
Infed on pistettävä vain pakaran ylemmän ulomman kvadrantin lihasmassaan – ei koskaan käsivarteen tai muihin alttiisiin alueisiin – ja se on pistettävä syvälle 2 tai 3 tuuman 19 tai 20 mm:n neulalla. Jos potilas seisoo, hänen painonsa on kohdistettava injektiokohdan vastakkaiselle jalalle, tai jos potilas on vuoteessa, hänen on oltava kylkiasennossa niin, että injektiokohta on ylhäällä. Injektion tai vuodon välttämiseksi ihonalaiseen kudokseen suositellaan Z-track-tekniikkaa (ihon siirtäminen sivusuunnassa ennen injektiota).
Huomautus: Infed-valmistetta ei saa sekoittaa muihin lääkkeisiin eikä sitä saa lisätä laskimonsisäistä infuusiota varten tarkoitettuihin parenteraalisiin ravitsemusliuoksiin.
Parenteraaliset lääkevalmisteet on tarkastettava silmämääräisesti hiukkasmaisen aineksen ja värimuutosten varalta ennen antoa aina, kun liuos ja säiliö sen sallivat.
KÄYTTÖTARVIKKEET:
Infed (Iron Dextran Injection USP), joka sisältää 50 mg alkuainerautaa millilitrassa, on saatavana 2 ml:n kerta-annosampullien meripihkanvärisinä injektiopulloina (intramuskulaariseen tai laskimonsisäiseen käyttöön) 10:n kappaleen kartonkipakkauksissa (NDC 0023-6082-10).
Varastoidaan 20 -25°C:ssa (68 -77°F) .
Vain reseptilääkkeet

Kaikkia lääketieteellisiä kysymyksiä varten ota yhteyttä:
Allergan
Medical Communications
1-800-678-1605Lähettäjä:
Myyjä:
Allergan USA, Inc.
Madison, NJ 07940Valmistanut:
Patheon Italia S.p.A.
Ferentino, Italia 03013© 2019 Allergan. Kaikki oikeudet pidätetään.
Infed® on Allergan Sales, LLC:n rekisteröity tavaramerkki.
Allergan® ja sen muotoilu ovat Allergan, Inc:n tavaramerkkejä.Sisältö päivitetty: Marraskuu 2018
v.1.1USPI6082
MALLIETIKETTI


Infed
rautadekstraani-injektioTuotetiedot Tuotetyyppi IHMISEN LÄÄKEVALMISTEEN LÄÄKEMERKKI Erätekoodi (lähde) NDC:52584-086(NDC:0023-6082) Valmistustapa INTRAMUSKULAARINEN, INTRAVENOUS DEA Schedule Toimiva aine/aktiivinen osa Toimiva ainesosa Ainesosa. Nimi Vahvuuden perusta Vahvuus IRON DEXTRAN (FERRIC CATION) FERRIC CATION 50 mg:aa 1 ml:ssa .
VAIKUTTAVAT AINESOSAT Ainesosan nimi Vahvuus NATRIUMHYDROKSIDI .
Pakkaus # Erätekoodi Pakkauksen kuvaus 1 NDC:52584-086-01 1 VIHJE, YKSITTÄINEN ANNOS 1 PUSSISSA 1 2 ml 1 VIHJE, SINGLE-ANNOS Myyntitiedot Myyntikategoria Hakemusnumero tai monografian viittaus .
Markkinoinnin alkamispäivä Markkinoinnin päättymispäivä NDA NDA017441 01/21/2019 Merkintä – Yleiset injektionesteet & Rokotteet, Inc. (108250663)
General Injectables & Vaccines, Inc.Lisätietoa Infedistä (rautadekstraani)
- Haittavaikutukset
- Raskauden tai imetyksen aikana
- Ainetiedot annostelusta
- Lääkeinteraktiot
- Hinnoittelu & Kuponkeja
- En Español
- Lääkeaineluokka: Rautavalmisteet
Kuluttajan resurssit
- Potilastiedot
- Infot (Tarkennettu lukeminen)
Professionaaliset resurssit
- Reseptitiedot
- Rautavalmisteet. Hydrogenoitu dekstraani (FDA)
Muut tuotemerkit Dexferrum
Seuraavat hoito-oppaat
- Krooniseen munuaisten vajaatoimintaan liittyvä anemia
- Raudanpuuteanemia
Lääketieteellinen vastuuvapauslauseke