Michael D. Ober, MD
Christina M. Klais, MD
Emmett T. Cunningham Jr., MD, PhD, MPH
New York City
Makulaarinen ödeema edustaa solunulkoisen nesteen patologista kerääntymistä verkkokalvon sisälle, pääasiassa ulompaan plexiformiseen ja sisempään ydinkerrokseen, epäspesifisenä vasteena veren ja verkkokalvon välisen esteen rikkoutumiseen. ME on yleinen syy näön menetykseen potilailla, joilla on diabetes mellitus, verkkokalvon laskimotukos, uveiitti ja silmänsisäisen leikkauksen jälkeen. Sitä esiintyy harvemmin lasiaisverkkokalvon vedon, suonikalvon neovaskularisaation ja useiden muiden sairauksien yhteydessä. ME:n hoitoon on käytetty monia strategioita vaihtelevalla menestyksellä. Tässä artikkelissa tarkastellaan tämän yleisen sairauden käytettävissä olevia hoitovaihtoehtoja.
 |
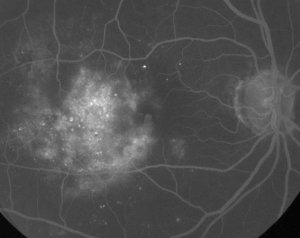 |
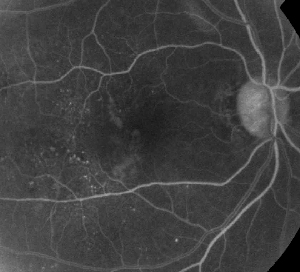
| Kuva 1. A. Varhaisvaiheen fluoresceiini-angiografia potilaalta, jolla on ei-proliferatiivinen diabeettinen retinopatia. Mikroaneurysmat näkyvät selvimmin temporaalisesti foveaan nähden fovean avaskulaarisen vyöhykkeen fluoresiinivuodon lisäksi. | B. Saman potilaan myöhäisvaiheen FA, jossa näkyy diffuusi vuoto temporaalisesti ja foveaalisen avaskulaarisen vyöhykkeen sisällä, mikä vastaa diabeettista makulaödeemaa. |
Diagnostiikka
Kliininen ME-diagnoosi tehdään parhaiten piilolinssin ja stereoskooppisen rakolampun silmänpohjan biomikroskoopian avulla. ME ilmenee tyypillisesti epäsäännöllisenä kohoumana verkkokalvolla, usein verkkokalvon sisäisen lipidin, mikroaneurysmien ja/tai verenvuotojen vieressä tapauksissa, jotka ovat toissijaisia diabetes mellituksen, verisuonten tukkeutumisen tai iskemian seurauksena. Verkkokalvon sisäistä nestettä voi myös kerääntyä kystisiin tiloihin, jotka sijaitsevat parafoveaalisella verkkokalvolla ja joissa on tai ei ole viereisiä verisuonipoikkeavuuksia. Tämä kystoidinen makulaödeema (CME) johtuu tavallisimmin tulehduksesta, paikallisesta vetovoimasta tai leikkauksen jälkeen.
Fluoresceiiniangiografia on olennainen väline ME:n diagnosoinnissa. Normaalissa silmässä veren ja verkkokalvon väliset esteet estävät fluoreseiinia kulkeutumasta verkkokalvolle. ME:ssä fluoresceiinimolekyylit kuitenkin poistuvat verisuonensisäisestä tilasta ja pääsevät verkkokalvolle. Vaurioituneissa kohdissa näkyy hyperfluoresenssia varhaisissa ja keskimmäisissä kuvissa, jonka pinta-ala ja voimakkuus kasvaa myöhemmissä kuvissa (ks. kuva 1). FA ei ainoastaan korosta turvotusta helppoa visualisointia ja hoidon paikallistamista varten, vaan luo myös pysyvän tallenteen tulevaa vertailua varten. ME:tä varten kehitettiin neliportainen kvantitatiivinen asteikko, jossa aste 0 ei merkitse lainkaan perifoveaalista hyperfluoresenssia, aste 1 epätäydellistä perifoveaalista hyperfluoresenssia, aste 2 lievää 360 asteen hyperfluoresenssia, aste 3 keskivaikeaa 360 asteen hyperfluoresenssia, jolloin hyperfluoresoivan alueen läpimitta on suunnilleen yksi kiekon läpimitta, ja aste 4 voimakasta 360 asteen hyperfluoresenssia, jolloin hyperfluoresoivan alueen läpimitta on kohdallaan suunnilleen 1,5 kiekon läpimitan verran. ”1, 2 Vaikka FA on herkkä keino tunnistaa ME:n esiintyminen, se antaa suhteellisen vähän tietoa nesteen anatomisesta jakautumisesta, eli diffuusista vs. kystisesta vs. subretinaalisesta, ja vuodon vakavuudesta ajan mittaan. FA ei anna kvantitatiivista tietoa verkkokalvon paksuuntumisesta. Siksi ei ole yllättävää, että yleisesti ottaen tämä kaksiulotteinen FA:han perustuva luokittelujärjestelmä korreloi huonosti näön kanssa.3,4
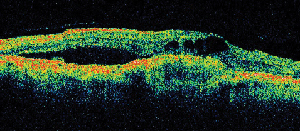
Optinen koherenssitomografia (OCT III, Carl Zeiss) on kosketukseton, ei-invasiivinen kuvantamistekniikka, joka on hyödyllinen lisä ME:n diagnosoinnissa. Se suuntaa lähi-infrapunaista valonsädettä (830 nm) kohtisuoraan verkkokalvon pintaan ja analysoi heijastusten ominaisuuksia. Se tuottaa 1,5 sekunnissa yhden lineaarisen korkean resoluution poikkileikkauskuvan. Näissä kuvissa voidaan näyttää ja jopa mitata paksuuntunut, kystinen verkkokalvo, jota esiintyy ödeemaattisilla alueilla. Se on hyödyllinen myös lasiaisverkkokalvon rajapinnan ominaisuuksien visualisoinnissa ja osoittaa tehokkaasti, milloin lasiaisen vetovoimalla on merkitystä ME:n muodostumisessa (ks. kuva 2).
Eräässä tutkimuksessa käytettiin OCT:tä 84 silmän tutkimiseen, joilla oli uveiitin aiheuttama sekundaarinen ME, ja sen lisähyötynä voitiin paljastaa tai vahvistaa epiretinaalisten kalvojen ja seroosisen verkkokalvon irtauman esiintyminen 41 prosentissa ja 20 prosentissa tapauksista.5 Tutkimuksessa havaittiin kohtalainen korrelaatio verkkokalvon paksuuden ja laskevan näöntarkkuuden välillä, vaikka korrelaation aste on vaihdellut eri tutkimuksissa, ja muut tutkijat ovat raportoineet heikoista,6 kohtalaisista,7 ja vahvoista8,9,10 korrelaatioista käyttäen erilaisia tilastollisia menetelmiä erilaisissa potilaspopulaatioissa, mukaan lukien diabeettista retinopatiaa, uveiittia ja CME:tä sairastavilla potilailla.
 >
>
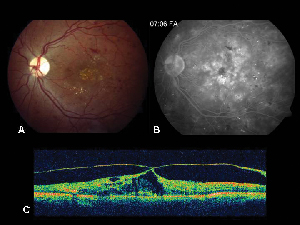
Kuvio 2. Verkkokalvon paksuus. A. Värillinen silmänpohjakuva vasemmasta silmästä potilaalta, jolla on ei-proliferatiivinen diabeettinen retinopatia ja lipidieritys foveassa ja sen ympärillä. B. Myöhäisvaiheen FA paljastaa makulaturvotuksen keskeisessä makulassa. C. Optinen koherenssitomografia osoittaa epänormaalin vitreoretinaalisen rajapinnan sekä makulaturvotuksen.
Toinen ryhmä raportoi, että OCT oli yhtä tehokas kuin FA ME:n havaitsemisessa ja parempi kuin FA nesteen aksiaalisen jakautumisen kuvaamisessa.6 OCT:llä pystytään myös tunnistamaan joitakin potilaita, joilla on ME, jota ei voida visualisoida FA:lla, kuten tietyissä kroonisen CME:n tapauksissa, joissa FA:lla parhaiten visualisoitava aktiivinen vuoto on minimaalista tai jopa puuttuu kokonaan, tai kun silmänpohjatutkimusta haittaavat väliaineen peittävyydet, kuten potilailla, joilla on asteroideaalinen hyaloosi.11
Verkkokalvon paksuusanalysaattorilla (Retinal Thicken Analyzer, RTA, RTA; Talia Technologyn teknologiayritys, Israel, Israelin tasavalta)11
voidaan määrittää verkkokalvon tiheys vastaavalla ei-kosketuskuvantamisella. Se tuottaa 16 samansuuntaista poikkileikkauskuvausta 3×3 neliömillimetrin kokoiselta verkkokalvon alueelta analysoimalla 0,3 sekunnin aikana annetun vinosti suunnatun vihreän valon (540 nm) pulssin heijastuksia. Sekä OCT että RTA ovat osoittaneet erinomaista tarkkuutta verkkokalvon paksuuden yksittäisissä mittauksissaan, ja tekniikoiden suora vertailu on osoittanut tilastollisesti merkittävän korrelaation niiden mittausten välillä. Vaikka RTA:n etuna on nopea hankinta, jossa on ehkä vähemmän artefakteja, se ei näytä olevan yhtä tehokas verkkokalvon paksuuden mittaamisessa kuin OCT, jos silmässä on väliaineen peittävyyksiä.12
Toisessa tutkimuksessa verrattiin foveaalista paksuutta RTA:lla ja OCT:llä 30 terveessä silmässä. Keskimääräinen foveaalinen paksuus normaaleissa silmissä mitattiin RTA:lla 181 µm ja OCT:llä 153 µm. Kirjoittajat päättelivät, että RTA tuottaa toisinaan vääriä korkeita arvoja, ja sen luotettavuus on siten heikompi kuin OCT:n.13 Sen sijaan analyysissä, jossa tutkittiin potilaita, joilla oli lievä ei-proliferatiivinen diabeettinen retinopatia, todettiin, että RTA oli OCT:tä herkempi tunnistamaan verkkokalvon paksuuntumisalueita diabeettisen ME:n alkuvaiheessa.14
 |
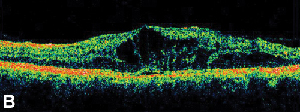 |
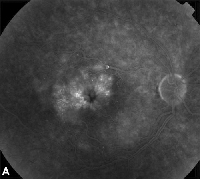
| Kuva 3. Verkkokalvon paksuuntuminen. A. Myöhäisvaiheen fluoresceiini-angiogrammi potilaalta, jolla on kystoidinen makulaturvotus. | B. Optinen koherenssitomografia, jossa näkyvät suuret kystiset tilat foveassa. |
Hoidot -Lääketieteellinen
Topikaaliset ei-steroidiset tulehduskipulääkkeet ovat tavallisin kataraktaalileikkauksen jälkeisen ME:n hoitomuoto (ks. kuva 3). Näillä aineilla pyritään vähentämään silmänsisäisiä prostaglandiinipitoisuuksia, joiden on todettu olevan osallisena ME:n patogeneesissä. Kaksoispeitteisissä, satunnaistetuissa, aktiivisissa ja lumekontrolloiduissa tutkimuksissa, joihin osallistui kaihileikkauspotilaita, on raportoitu tulehdusta ehkäiseviä vaikutuksia paikallisesti annostelluilla 1-prosenttisella indometasiinilla, 0,03-prosenttisella flurbiprofeenilla, 0,5-prosenttisella ketorolaakilla ja 0,1-prosenttisella diklofenaakkivalmisteella15,16. 0,1-prosenttinen diklofenaakki- ja 0,5-prosenttinen ketorolaakki-oftalmaliuos ovat kuitenkin ainoat paikallisesti annosteltavat tulehduskipulääkkeet, jotka FDA on nimenomaisesti hyväksynyt tälle käyttöaiheelle. Paikallisen kortikosteroidin ja NSAID-tippojen yhdistelmähoidon on todettu olevan tehokkaampi ME:n hoidossa kuin kummankaan lääkkeen yksinään.16 Vaikka paikallisia NSAID-lääkkeitä ei ole hyväksytty FDA:n toimesta, niitä käytetään usein ennen kaihileikkausta estämään leikkauksen jälkeistä ME:tä.
Oraalista asetatsolamidia käytetään toisinaan tulehdustilojen ja retinitis pigmentosan aiheuttaman ME:n sekundaarihoidossa erityisesti silloin, kun paikalliset NSAID-lääkkeet ja kortikosteroidit epäonnistuvat. Useissa prospektiivisissa, maskeeratuissa, ristikkäistutkimuksissa verrattiin asetatsolamidia ja lumelääkettä potilailla, joilla oli eri syistä johtuva ME. Viiden jakson crossover-tutkimuksessa, johon osallistui 41 potilasta, todettiin toistettavissa oleva vaste, jota luonnehdittiin joko ME:n osittaiseksi tai täydelliseksi häviämiseksi, yli puolella potilaista, joilla oli perinnöllinen tai tulehduksellinen verkkokalvosairaus, mutta ei vastetta potilailla, joilla oli primaarinen verkkokalvon verisuonisairaus.17 500 mg/vrk tai suun kautta otetun asetatsolamidin todettiin olevan tehokkaampi kuin 250 mg/vrk ME:n hoidossa potilailla, joilla oli RP:n aiheuttama sekundaarisesti syntynyt ME.18 Tässä tutkimuksessa havaittiin paranemista 10:llä 12:sta hoidetusta potilaasta.
Toisessa ryhmässä todettiin, että alle 55-vuotiaat potilaat, joilla oli krooniseen iridosykliittiin liittyvä ME, vastasivat todennäköisemmin 500 mg asetatsolamidia b.i.d. kuin vanhemmat potilaat.19 Tuoreessa tutkimuksessa on ehdotettu, että asetatsolamidi voi olla tehokasta myös diabeteksen aiheuttaman ME:n hoidossa.20
Kortikosteroidit ovat voimakkaita anti-inflammatorisia lääkeaineita, joita käytetään usein ME:n hoitoon. Niillä on useita vaikutusmekanismeja, mukaan lukien veri-verkkokalvoesteen stabilointi ja pro-inflammatoristen välittäjäaineiden esto. Antotapoja ovat paikallinen, periokulaarinen injektio, intravitreaalinen injektio ja sekä suun kautta että suonensisäinen anto. Vaikka suun kautta ja suonensisäisesti annettavat kortikosteroidit saavuttavat varmasti terapeuttisen tason lasiaisessa, ne altistavat potilaat systeemisten komplikaatioiden lisäriskille, ja siksi ne varataan yleensä potilaille, joilla on näköä uhkaava uveiitti systeemisen sairauden yhteydessä. Paikalliset kortikosteroiditipat ovat turvallisuusspektrin toisessa päässä, mutta niiden kyky saavuttaa takasegmentti on rajallinen.
Sub-Tenonin injektiot tarjoavat vaihtoehdon suhteellisen suurten kortikosteroidiannosten antamiseksi silmään pienemmällä systeemisten komplikaatioiden riskillä.21 Vaikka satunnaistettuja, kontrolloituja tutkimuksia ei ole tehty, sub-Tenonin kortikosteroidi-injektiota on käytetty tehokkaasti makulaturvotuksen hoidossa jo useita vuosia. Yleisimmin käytetään lyhyttä 25 g:n neulaa, joka asetetaan superotemporaalisen bulbaarisen sidekalvon läpi sub-Tenonin tilaan potilaan katsoessa inferonasaalisesti. Neulaa viedään posteriorisesti silmänpohjaa pitkin pyyhkäisevin sivuttaisliikkein, jotta estetään silmänpohjan tahaton tunkeutuminen, kunnes neula saavuttaa sidekalvon sisäänmenokohdan, jolloin lääkitys annetaan. Eräässä raportissa oli mukana 20 peräkkäistä potilasta, joilla oli näön heikkenemiseen liittyvä intermediäärinen uveiitti ja joita hoidettiin 40 mg:n triamsinoloniasetonidia sisältävällä sub-Tenon-injektiolla.22 Vaikka kaikilla potilailla ei FA:ssa ilmennyt ME:tä, 67 prosentilla potilaista näön heikkeneminen parani kahdella näköviivalla yhden hoidon jälkeen. Tämän toimenpiteen riskeihin kuuluvat muun muassa pysyvästi kohonnut silmänsisäinen paine, kaihi, ptoosi ja silmänsisäinen penetraatio.
Viime aikoina intravitreaalisen triamsinoloniasetonidi-injektion (Kenalog, 4,0 mg) käyttö on lisääntynyt sen voimakkaan kyvyn vuoksi parantaa refraktorista ME:tä, joka on sekundaarinen diabeteksen mellituksen aiheuttamana (ks. kuvio 4), verkkokalvon laskimotukosten, tulehduksen ja muiden idiopaattisten syiden vuoksi.23-26 Alustavat tutkimukset osoittavat verkkokalvon paksuuntumisen dramaattista vähenemistä, fluoresceiinivuodon vähenemistä ja näön paranemista, joka voi olla merkittävää joillakin potilailla. Vaikka vaikutus on tilapäinen ja kestää tyypillisesti kolmesta kuuteen kuukautta tai vähemmän, silmänpohjan vajaatoiminta reagoi yleensä uusintaruiskutukseen. Intravitreaalisten kortikosteroidien käyttöön liittyy kuitenkin 30-40 prosentin riski silmänsisäisen paineen pysyvään kohoamiseen ja noin 10 prosentin riski leikkausta vaativaan kaihiin. Kansallinen silmäinstituutti rekisteröi parhaillaan potilaita SCORE-tutkimukseen (standard care vs. corticosteroid for retinal vein occlusion study), jossa verrataan intravitreaalisia triamsinoloni-injektioita (1- ja 4 mg:n annoksina) standardihoitoon (tarkkailuun ja/tai ruudukkolaserkäsittelyyn) potilailla, joilla on laskimotukoksesta johtuva ME. Tutkimuksessa seurataan yhteensä 1260 potilasta, ja hoitoa jatketaan 36 kuukauden ajan.
ME:tä esiintyy myös ikään liittyvän makuladegeneraation yhteydessä (ks. kuva 5). Triamsinoloniasetonidin intravitaalista injektiota tutkitaan parhaillaan käytettäväksi yhdessä fotodynaamisen hoidon kanssa neovaskulaarisen AMD:n hoidossa (Visudyne with intravitreal Triamcinolone Acetonide, VisTA). Eräässä tutkimuksessa korostetaan intravitreaalisen triamsinolonin merkitystä ennen PDT:n käyttöä potilailla, joilla on makulaödeema ja CNV.27 Kirjoittajat esittävät teorian, jonka mukaan verteporfiini voi vuotaa kystisiin verkkokalvon sisäisiin tiloihin, mikä johtaa viereisen normaalin verkkokalvon valoreseptorivaurioihin, kun lääke on fotoaktivoitunut, kun taas verkkokalvoturvotuksen aiempi poistuminen voi ehkäistä tämän komplikaation. Kortikosteroidin antaminen etukäteen voi myös lieventää PDT:n aiheuttamaa silmänsisäisten VEGF-tasojen nousua.
Intervitreaalisiin injektioihin itsessään liittyy pieni mutta selvä riski vakavista, mahdollisesti sokeuttavista haittavaikutuksista, kuten infektioperäisestä endoftalmitiitista, verkkokalvon irtaumasta, verenvuodosta, silmän hypertensiosta, harmaakaihista ja hypotoniasta.28 Hiljattain julkaistuissa intravitreaalisia injektioita koskevissa ohjeistuksissa yritetään laatia parhaan käytännön lähestymistapa tähän yhä useammin käytettyyn tekniikkaan. Konsensuspaneelin suosituksissa käsiteltiin injektiota edeltäviä näkökohtia, kuten antibiootteja, glaukooman arviointia, käsineiden käyttöä ja jo olemassa olevien silmäluomien poikkeavuuksien hoitoa, sekä sitä, että on tärkeää välttää liiallista silmäluomien manipulointia ennen toimenpidettä ja sen aikana. Suositeltu injektiota edeltävä hoito sisälsi paikallisen ja/tai sidekalvon alapuolisen puudutusaineen, paikallisen povidonijodin ja silmäluomispekulumin käytön. Kirjoittajat korostivat IOP:n seurannan ja silmänpohjan suoran visualisoinnin tärkeyttä injektion jälkeen, jotta voidaan varmistaa näköhermon perfuusio, triamsinolonin intravitreaalinen sijainti ja se, ettei injektioon liittyvää verenvuotoa tai verkkokalvon irtoamista esiinny. He korostivat myös potilasvalistuksen merkitystä mahdollisten komplikaatioiden varhaisten oireiden suhteen ja perusteellista seurantaa.29
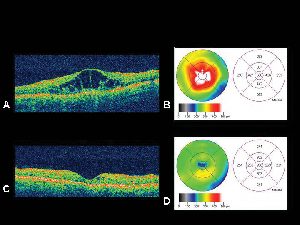
Kuva 4. A. Optinen koherenssitomografiakuva silmästä, jolla on diabeettinen makulaturvotus, ja vastaava verkkokalvon paksuuskarttaB. OCT:n tuottama kuva. C. Saman potilaan OCT-kuva kuukausi intravitreaalisen triamsinoloniasetonidi-injektion jälkeen ja sitä vastaava verkkokalvon paksuuskartta. D. Makulaturvotuksen häviäminen. Näöntarkkuus parani hoidon jälkeen 20/200:sta 20/80:een.
Monissa tutkimuksissa tutkitaan vaihtoehtoisia pitkäaikaisia kortikosteroidin annostelulaitteita, joita käytetään silmän sisällä. Eräässä tutkimuksessa kirurgisesti asetetaan fluosinoloniasetonidipelletti, joka on upotettu muovipalkkiin ja josta steroidit vapautuvat hallitusti kolmen vuoden ajan. Bausch & Lombin ja Control Delivery Systemsin Envision intravitreaali-implantiksi kutsuttu implantti asetetaan pars planan läpi ja ommellaan kiinni kovakalvoon. Vaiheen II/III satunnaistetussa, naamioidussa tutkimuksessa verrattiin Envision TD -implanttia 80 potilaalla, jotka satunnaistettiin saamaan 0,5 vs. 2,0 mg fluosinoloniasetonidia verrattuna standardihoitoon, joka koostui laserfotokoagulaatiosta tai tarkkailusta. Kuuden kuukauden kuluttua diabeettisen retinopatian ME:n ja vaikeusasteen havaittiin vähentyneen tilastollisesti merkitsevästi 0,5 mg:n implantilla verrattuna standardihoitoon. Lisäksi vakavien haittavaikutusten esiintyvyydessä ei ollut eroja. Tutkimuksen 2,0 mg:n haara lopetettiin ennenaikaisesti toisessa tutkimuksessa havaittujen tulosten vuoksi, joissa ei havaittu etua 0,5 mg:aan verrattuna. Toiseen tutkimukseen osallistui 278 potilasta, joilla oli ei-infektiivinen posteriorinen uveiitti ja jotka satunnaistettiin saamaan joko 0,59 mg:n tai 2,1 mg:n Retisert-istutetta sairastuneeseen silmään tai, molemminpuolisissa tapauksissa, vaikeammin sairastuneeseen silmään. Kahden annoksen ja 34 viikon kuluttua implanttia saaneissa silmissä uusiutumisprosentti oli merkittävästi alhaisempi (10 vs. 55,7 prosenttia, p<0,0001), ja systeemisen kortikosteroidi-/immunosuppressiivisen hoidon käyttö väheni (59,0 prosenttia lähtötilanteessa vs. 13,7 prosenttia 34 viikossa), samoin kuin subtenonien ja paikallisten steroidien käyttö. Näöntarkkuus parani merkittävästi (p<0,05). Yleisimpiä haittavaikutuksia olivat harmaakaihin eteneminen ja kohonnut silmänpaine, joka vaati suodatuksen 8,6 prosentilla. (Jaffe G. Invest Ophthalmol Vis Sci. 2004; 44 ARVO E-Abstract #3369.)
Toisessa tutkimuksessa on mukana Allerganin Posurdex, bioerodoituva deksametasonipelletti, joka ruiskutetaan lasiaistilaan ja joka vapauttaa lääkettä 50-160 päivän aikana. Vaiheen II tutkimuksen tulokset osoittivat, että sekä 350 µg:n että 700 µg:n pilleri paransi merkittävästi niiden potilaiden prosenttiosuutta, joiden näkökyky parani vähintään kahden viivan verran (27,2 prosenttia ja 35,7 prosenttia 350 µg:n ja 700 µg:n kohdalla) sekä vähintään kolmen viivan verran (13 prosenttia 350 µg:n ja 19,4 prosenttia 700 µg:n kohdalla) 180 vuorokauden kuluttua lumelääkkeeseen verrattuna. Toistaiseksi ei ole raportoitu harmaakaihin lisääntyneestä esiintyvyydestä, vaikka silmänpaineen nousua havaittiin noin 15 prosentilla potilaista.
Hoidot -Laser
Viimeisimpänä Eyetechin ja Pfizerin Macugenia tutkittiin satunnaistetussa, kaksoispeitteisessä, monikeskuksisessa, annosmuutoksia sisältävässä, kontrolloidussa vaiheen II tutkimuksessa, johon osallistui 172 potilasta, joilla oli diabeettista ME:tä. Tutkimuksessa tutkittiin kolmea annosta (0,3 mg, 1,0 mg, 3,0 mg) verrattuna näennäisinjektioihin, jotka annettiin kuuden viikon välein kolmen injektion ajan. Kun taas aiempia fokusoidun/grid-laserin tutkijoita pyydettiin ottamaan mukaan vain potilaita, joiden kohdalla he kokivat mukavaksi lykätä fokusoidun/grid-laserin käyttöä vähintään 12 viikolla. Lisäinjektioita ja/tai fokaalista/grid-fotokoagulaatiota annettiin tutkijan harkinnan mukaan viikolta 18-30. Lopulliset arvioinnit tehtiin viikolla 36, kuusi viikkoa viimeisen suunnitellun injektion jälkeen. Kaiken kaikkiaan Macugen-valmistetta saaneiden potilaiden näöntulokset olivat paremmat, verkkokalvon keskipaksuus pieneni todennäköisemmin ja lisälaserhoitoa tarvittiin harvemmin kuin näennäispotilailla.31 Vahvistavaa vaiheen III tutkimusta suunnitellaan parhaillaan.
Fokaalinen/grid-laserfotokoagulaatio on edelleen standardihoito diabeettisen ME:n hoidossa. Early Treatment Diabetic Retinopathy Study -tutkimus osoitti, että grid-laserilla hoidetuilla potilailla keskivaikea näön heikkeneminen, joka on määritelty näkökulman kaksinkertaistumisena tai näön heikkenemisenä kolmella viivalla, väheni 50 prosenttia verrattuna tarkkailuun.30 Vaikka tarkkaa mekanismia, jolla laser vähentää ME:tä, ei tunneta, sen uskotaan edistävän tiukkojen liitosten muodostumista RPE:n solujen välille sekä vähentävän fotoreseptoreiden hapentarvetta ja lisäävän hapen perfuusiota suonikalvosta.31 EDTRS-tutkimuksessa määriteltiin potilaat, jotka soveltuvat fokaaliseen laserfatokoagulaatioon silloin, kun potilailla oli kliinisesti merkittävä ME. Tämä määriteltiin täyttävän yhden seuraavista kolmesta kriteeristä: 1) verkkokalvon paksuuntuminen 500 µm:n etäisyydellä foveasta; 2) kovat eritteet alle 500 µm:n etäisyydellä foveasta, jotka liittyvät viereiseen verkkokalvon paksuuntumiseen; tai 3) turvotuksen alue, jonka läpimitta on vähintään yksi kiekon läpimitta ja jonka jokin osa sijaitsee alle yhden kiekon läpimitan päässä foveasta. EDTRS:ssä ei kuitenkaan erotettu toisistaan fokaalista ME:tä, joka vastaa mikroaneurysmien viereisen verkkokalvon paikallista paksuuntumista, ja diffuusia ME:tä, joka viittaa takapuolen yleiseen paksuuntumiseen. Anekdoottinen näyttö osoittaa, että fokaalinen diabeettinen ME reagoi hyvin fokaaliseen/grid-laseriin, kun taas diffuusi laji epäonnistuu useammin laserhoidossa ja vaatii vaihtoehtoista hoitoa.
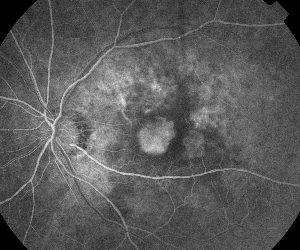 |
 |
| Kuvio 5. Fokaalinen ME. A. Varhainen fluoresceiiniangiogrammi, jossa näkyy klassinen subfoveaalinen neovaskularisaatio. | B. Vastaava optinen koherenssitomografia paljastaa subretinaalisen ja intraretinaalisen nestekertymän alueet sekä osoittaa neovaskularisaation (nuoli). |
Hoidot -Kirurgia
Ensimmäinen ryhmä, joka raportoi lasinpoiston ja posteriorisen hyaloidin irrotuksen hyödyistä diabeettista ME:tä sairastavilla potilailla, viittasi siihen, että on olemassa potilaiden alaryhmä, jonka kohdalla lasiaisen vetovoimatekijät ja matalat makulan irtoamiset myötävaikuttavat verkkokalvon paksuuntumiseen.32 Tämä on sittemmin vahvistettu OCT:n avulla, mikä on johtanut tämän tekniikan indikaatioiden tarkentumiseen.33,34 Kolmessa suurimmassa sarjassa35,36,37 , joissa analysoitiin 59, 58 ja 65 potilasta, joille tehtiin vitrektomia diabeettisen ME:n vuoksi ja jotka eivät vastanneet vähemmän invasiivisiin hoitoihin. Niissä raportoitiin, että 47 prosentilla potilaista näkö parani vähintään kaksi viivaa, 53 prosentilla 53 prosenttia ja 45 prosentilla 45 prosenttia. Viimeksi mainituissa raportoitiin vakavista leikkauksen jälkeisistä komplikaatioista, jotka kehittyivät vähemmistölle potilaista, mukaan lukien verkkokalvon irtauma (1,5 prosenttia), rubeosis iridis (4,6 prosenttia), epiretinaalinen kalvo (13,8 prosenttia), toistuva lasiaisverenvuoto(1,5 prosenttia) ja foveaaliset kovat eksudaattikerrostumat (4,6 prosenttia), kun taas toisessa ryhmässä ilmenneisiin komplikaatioihin sisältyi epiretinaalinen kalvo 10,2 prosentilla ja harmaakaihi 63,2 prosentilla fakisista silmistä. Useat muut tapaussarjat ovat osoittaneet samankaltaisia tuloksia, mutta kaikki eivät olleet satunnaistettuja, niissä ei ollut plasebokontrollia ja niissä käytettiin erilaisia sisäänotto- ja poissulkukriteerejä. Lisäksi kirurgiset tekniikat ovat myös eronneet toisistaan, joten vitrektomian tarkat käyttöaiheet CME-potilailla ovat tulkinnanvaraisia.
ME on edelleen merkittävä syy näön heikkenemiseen saatavilla olevien hoitomuotojen moninaisuudesta huolimatta. Laserfotokoagulaatio on edelleen olennainen osa diabeteksesta, iskemiasta ja verisuonitukoksista johtuvan ME:n hoitoa. Paikalliset tulehduskipulääkkeet ja kortikosteroidit ovat tällä hetkellä ensisijainen menetelmä leikkauksen jälkeisen ME:n hallintaan, kun taas asetatsolamidi on edelleen tehokas hoitokeino valikoiduilla potilailla, joilla on uveiitin ja retiniitti pigmentosan aiheuttama ME. Intravitreaalisten kortikosteroidien merkitys ME:n hoidossa on lisääntymässä, mutta haittavaikutukset ja vaikutuksen kesto rajoittavat sitä edelleen. Kirurgisten tekniikoiden kehittyminen tuo jatkossakin uuden ulottuvuuden ME:hen, joka ei reagoi vähemmän invasiiviseen hoitoon, kun taas farmakoterapian ja silmään annosteltavien lääkkeiden kehittyminen lupaa merkitystä kaikkien ME:n syiden ja tyyppien ennaltaehkäisyssä ja hoidossa.
Tohtori Ober on lasiaisverkkokalvokirurgian apulaisprofessori Edward S. Harknessin silmäinstituutissa Columbian yliopiston College of Physicians and Surgeonsissa ja LuEsther T. Mertzin verkkokalvon tutkimuskeskuksessa Manhattanin silmä-, korva- ja kurkkusairaalassa. Ota yhteyttä osoitteeseen 210 East 64th St., 8th Fl, New York, NY 10021; sähköposti: [email protected]; tai (212) 605 3777 tai faksi (212) 605 3795.
Tohtori Klais on verkkokalvon apulaisprofessori LuEsther T. Mertz Retinal Research Centerissä. Ota häneen yhteyttä samaan osoitteeseen, puhelin- tai faksinumeroon tai sähköpostitse osoitteeseen [email protected].
Tohtori Cunningham on silmälääketieteen kliininen professori ja Uveitis-palvelun johtaja New Yorkin yliopiston lääketieteellisessä tiedekunnassa. Hän on myös Eyetech Pharmaceuticals Inc:n työntekijä.Ota häneen yhteyttä osoitteessa Vitreous-Retina-Macula Consultants of New York, 460 Park Ave., New York, N.Y. 10022, sähköpostitse [email protected] tai puhelimitse/faksilla (212) 861 9797.
1. Spaide RF, Yannuzzi LA, Sisco LJ. Krooninen kystoidinen makulaturvotus ja näöntarkkuuden ennustetekijät. Ophthalmic Surg 1993;24:262-267.
2. Yannuzzi LA. Näkökulma afakisen kystoidisen makulaturvotuksen hoitoon. Surv Ophthalmol 1984;28:540-553
3. Chang A, Spaide RF, Yannuzzi LA. Leikkauksen jälkeinen kystoidinen makulaödeema. In: Guyer DR, Yannuzzi LA, Chang S, et al. Retina, Vitreous, Macula. Saunders. Philadelphia. 1999;1:239-255.
4. Nussenblatt RB, Kaufman SC, Palestine AG, et al. Macular thickening and visual acuity. Mittaaminen potilailla, joilla on kystoidinen makulaturvotus. Ophthalmology 1987;94:1134-9.
5. Markomichelakis NN, Halkiadakis I, Pantelia E, et al. Patterns of macular edema in patients with uveitis: qualitative and quantitative assessment using optical coherence tomography. Ophthalmology 2004;111:946-53.
6. Antcliff RJ, Stanford MR, Chauhan DS, et al. Comparison between optical coherence tomography and fundus fluorescein angiography for the detection of cystoid macular edema in patients with uveitis. Ophthalmology 2000; 107:593-9.
7. Otani T, Kishi S, Maruyama Y. Diabeettisen makulaturvotuksen kuvioita optisella koherenssitomografialla. Am J Ophthalmol 1999;127:688-93.
8. Hee MR, Puliafito CA, Wong C, et al. Makulaturvotuksen kvantitatiivinen arviointi optisella koherenssitomografialla. Arch Ophthalmol 1995;113:1019-29.
9. Nussenblatt RB, Kaufman SC, Palestine AG, et al. Macular thickening and visual acuity. Mittaaminen potilailla, joilla on kystoidinen makulaturvotus. Ophthalmology 1987;94:1134-9.
10. Ozdek SC, Erdinc MA, Gurelik G, et al. Diabeettisen makulaturvotuksen optinen koherenssitomografinen arviointi: vertailu fluoreseiiniangiografisiin ja kliinisiin löydöksiin. Ophthalmologica 2005;219:86-92.
11. Browning DJ, Fraser CM. Optinen koherenssitomografia makulaturvotuksen havaitsemiseksi asteroidihyaloosin yhteydessä. Am J Ophthalmol 2004;137:959-961.
12. Polito A, Shah SM, Haller JA et al. Verkkokalvon paksuusanalysaattorin ja optisen koherenssitomografian vertailu foveaalisen paksuuden arvioinnissa silmissä, joilla on makulasairaus. Am J Ophthalmol 2002;134:240-51.
13. Neubauer AS, Priglinger S, Ullrich S, et al. Verkkokalvon paksuusanalysaattorilla ja optisella koherenssitomografialla mitatun foveaalisen paksuuden vertailu. Retina 2001;21:596-601.
14. Pires I, Bernardes RC, Lobo CL, Soares MA, Cunha-Vaz JG. Verkkokalvon paksuus silmissä, joilla on lievä ei-proliferatiivinen retinopatia tyypin 2 diabetes mellitusta sairastavilla potilailla: verkkokalvon paksuusanalyysillä ja optisella koherenssitomografialla saatujen mittausten vertailu. Arch Ophthalmol 2002 Oct;120(10):1301-6.
15. Flach AJ. Syklo-oksigenaasin estäjät silmälääketieteessä. Surv Ophthalmol 1992;36:259-284.
16. Heier JS, Topping TM, Baumann W, Dirks MS, Chern S. Ketorolakki vs. prednisoloni vs. yhdistelmähoito akuutin pseudofakisen kystoidisen makulaödeeman hoidossa. Ophthalmology 2000;107:2034-8.
17. Cox SN, Hay E, Bird AC. Kroonisen makulaturvotuksen hoito asetatsolamidilla. Arch Ophthalmol 1988;106:1190-5.
18. Fishman GA, Gilbert LD, Fiscella RG, Kimura AE, Jampol LM. Asetatsoliamidi kroonisen makulaturvotuksen hoitoon retinitis pigmentosassa. Arch Ophthalmol 1989;107:1445-52.
19. Farber MD, Lam S, Tessler HH, Jennings TJ, Cross A, Rusin MM. Makulaarisen turvotuksen väheneminen asetatsolamidilla kroonista iridokykiittia sairastavilla potilailla: satunnaistettu prospektiivinen crossover-tutkimus. Br J Ophthalmol 1994;78:4-7.
20. Giusti C, Forte R, Vingolo EM, Gargiulo P. Onko asetatsolamidi tehokas diabeettisen makulaödeeman hoidossa? Pilottitutkimus. Int Ophthalmol 2001;24:79-88.
21. Jennings T, Rusin MM, Tessler HH, Cunha-Vaz JG. Kortikosteroidien posterioriset sub-Tenon-injektiot uveiittipotilailla, joilla on kystoidinen makulaödeema. Jpn J Ophthalmol 1988;32:385-91.
22. Helm CJ, Holland GN. Triamsinoloniasetonidin posteriorisen subtenon-injektion vaikutukset potilailla, joilla on intermediäärinen uveiitti. Am J Ophthalmol 1995;120:55-64.
23. Benhamou N, Massin P, Haouchine B, Audren F, et al. Intravitreaalinen triamsinoloni refraktorisen pseudofakisen makulaödeeman hoitoon. Am J Ophthalmol 2003;135:246-9.
24. Jonas JB, Kreissig I, Degenring RF. Intravitreaalinen triamsinoloniasetonidi verkkokalvon keskuslaskimotukoksen makulaturvotuksen hoitona. Graefes Arch Clin Exp Ophthalmol. 2002;240:782-3.
25. 25. Martidis A, Duker JS, Greenberg PB, Rogers AH, et al. Intravitreaalinen triamsinoloni refraktorisen diabeettisen makulaödeeman hoitoon. Ophthalmology 2002; 109: 920-7.
26. 26. Scott IU, Flynn HW Jr. ja Rosenfeld PJ. Intravitreaalinen triamsinoloniasetonidi idiopaattisen kystoidisen makulaödeeman hoidossa. Am J Ophthalmol 2003;136:737-9.
27. 27. Freund KB, Klais CM, Eandi CM, et al. Sequenced Combined Intravitreal Triamcinolone and Indocyanine Green Angiography Guided Photodynamic Therapy for Retinal Angiomatous Proliferation. Arch Ophthalmol, In Press.
28. 28. Jager RD, Aiello LP, Patel SC, Cunningham ET Jr. Intravitaalisen injektion riskit: kattava katsaus. Retina. 2004 Oct;24(5):676-98.
29. 29. Aiello LP, Brucker AJ, Chang S, et al. Evolving guidelines for intravitreal injections. Retina 2004 Oct;24(5 Suppl):S3-19.
30. .G.Jaffe, Fluocinolone Acetonide Uveitis Study Group. Fluocinolone Acetonide Intravitreal Implant for Uveitis Affecting the Posterior Segment of the Eye. ARVO 2004, poster #3369.
31. Macugenin diabeettisen retinopatian tutkimusryhmä. Vaiheen II satunnaistettu, kaksoispeitetutkimus pegaptanibista, verisuonten endoteelin kasvutekijän vasta-aptamerista, diabeettisen makulaturvotuksen hoidossa. Ophthalmology, In press.
32. 30. Diabeettisen makulaturvotuksen fotokoagulaatio. Varhaisen hoidon diabeettisen retinopatian tutkimusraportti numero 1. Arch Ophthalmol 1985;103:1796-806.
33. Christoforidis JB, D’Amico DJ. Diabeettisen makulaturvotuksen kirurgiset ja muut hoidot: päivitys. Int Ophthalmol Clin 2004;44:139-60.
34. Lewis H, Abrams GW, Blumenkranz MS, Campo RV. Vitrektomia diabeettisen makulan vetovoiman ja turvotuksen, johon liittyy posteriorinen hyaloidaalinen vetovoima, vuoksi. Ophthalmology 1992;99:753-9.
35. Kaiser PK, Riemann CD, Sears JE, Lewis H. Macular traction detachment and diabetic macular edema associated with posterior hyaloidal traction. Am J Ophthalmol 2001;131:44-9.
36. Lewis H. Vitrektomian merkitys diabeettisen makulaödeeman hoidossa. Am J Ophthalmol 2001;131:123-5.
37. Pendergast SD. Vitrektomia diabeettisen makulaödeeman hoidossa, johon liittyy kireä premakulaarinen posteriorinen hyaloidi. Curr Opin Ophthalmol 1998;9:71-5.
38. Tachi N, Ogino N. Vitrektomia diffuusin makulaödeeman hoitoon diabeettisen retinopatian yhteydessä. Am J Ophthalmol 1996;122:258-60.
39. Yamamoto T, Hitani K, Tsukahara I, Yamamoto S, et al. Varhaiset postoperatiiviset verkkokalvon paksuuden muutokset ja komplikaatiot diabeettisen makulaturvotuksen vitrektomian jälkeen. Am J Ophthalmol 2003;135:14-9.
.