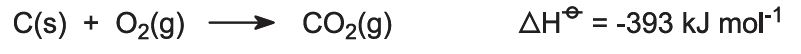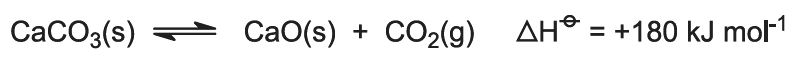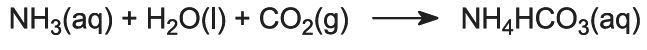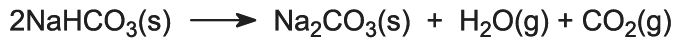- Natriumkarbonaatin käyttötarkoitukset
- Natriumkarbonaatin vuosituotanto
- Natriumkarbonaatin valmistus
- (a) natriumkloridista ja kalsiumkarbonaatista
- (1) Suolaliuoksen ammoniakointi
- (2) Kalsiumoksidin ja hiilidioksidin muodostuminen
- (3) Solvay-torni
- (4) Kiinteän natriumvetykarbonaatin erottaminen
- (5) Natriumkarbonaatin muodostuminen
- (6) Kalsiumhydroksidin muodostuminen
- (7) Ammoniakin regenerointi
- (b) Trona- ja nahkoliittimalmista
Natriumkarbonaatin käyttötarkoitukset
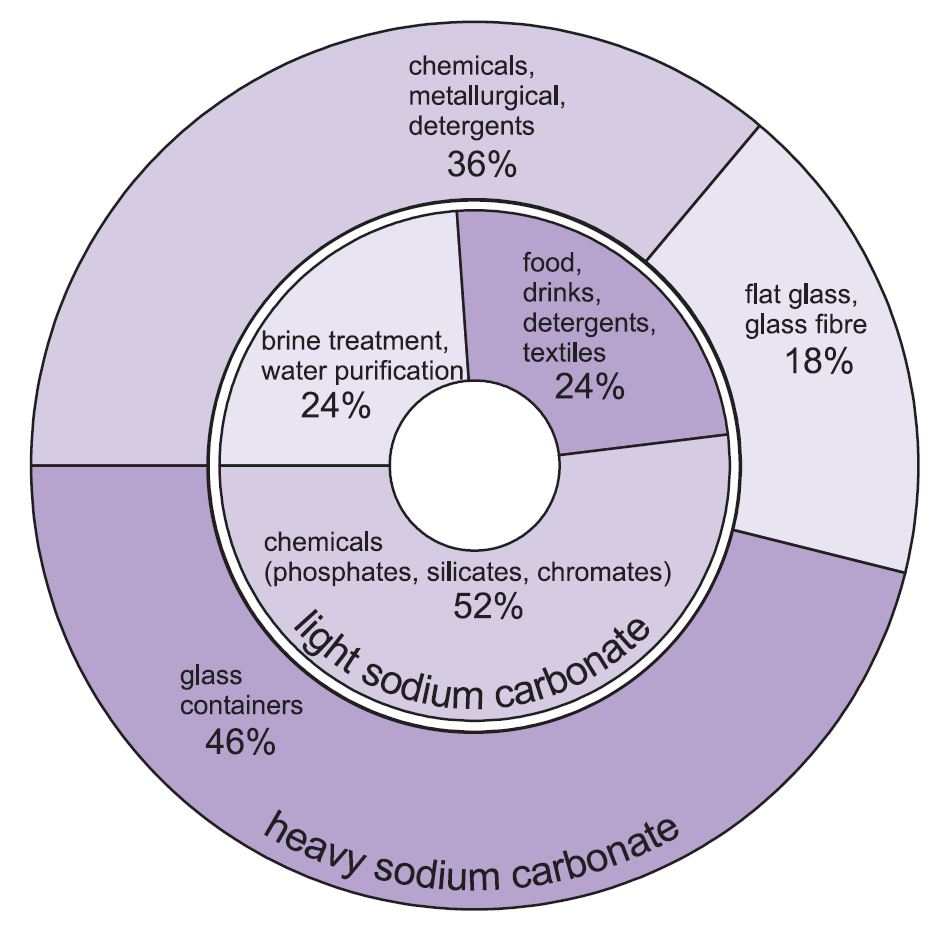
Natriumkarbonaattia (soodaa) käytetään kahdessa muodossa – raskaassa ja kevyessä. Kevyttä muotoa saadaan ensin ja osa siitä muutetaan sitten raskaaksi muodoksi. Kevyt natriumkarbonaatti sisältää alle 0,5 % natriumkloridia. Raskasta natriumkarbonaattia saadaan hydratoimalla kevyt natriumkarbonaatti monohydraatiksi (Na2CO3.H2O) ja sitten dehydratoimalla se, jolloin saadaan tuote, jonka kiderakenne ja tiheys ovat suuremmat.
Kahdella laadulla on eri käyttötarkoitukset.
Raskan natriumkarbonaatin tärkeimmät käyttökohteet ovat kiinteänä aineena, erityisesti lasinvalmistuksessa, jossa sitä käytetään vuona piidioksidin (hiekan) sulatuksessa.
Kevyen natriumkarbonaatin käyttökohteet ovat perinteisesti sellaisia, joissa kemikaalia tarvitaan liuoksena.
Kuvio 1. Sekä raskaan että kevyen natriumkarbonaatin käyttötarkoitukset.
Kokonaisuudessaan noin 50 % natriumkarbonaatin kokonaistuotannosta käytetään lasin valmistukseen, 18 % muiden kemikaalien valmistukseen ja 10 % saippuoissa ja pesuaineissa.
Natriumkarbonaatin vuosituotanto
Kiina on maailman suurin natriumkarbonaatin tuottaja, jonka osuus maailman tuotannosta on 46 % ja Yhdysvaltojen 23 %. (IHS Markit, 2015)
| Maailma | 52 miljoonaa tonnia1,2 |
| Kiina | 25 miljoonaa tonnia3 |
| USA. | 12 miljoonaa tonnia1 |
| Eurooppa | 11 miljoonaa tonnia |
| Venäjä | 0.71 miljoonaa tonnia4 |
Tiedot:
1. 2018 Elements of the Business of Chemistry, American Chemistry Council.
2. Näistä 14,7 tonnia louhitaan. Valtaosa louhitaan Yhdysvalloissa (11,7 miljoonaa tonnia) ja Turkissa (2 miljoonaa tonnia). Loput valmistetaan natriumkloridista ja kalsiumkarbonaatista.
3. IHS Markit, 2015
4. Federal State Statistics Service: Venäjän federaatio 2011
Natriumkarbonaatin valmistus
Natriumkarbonaattia saadaan pääasiassa kahdesta lähteestä:
a) suolasta ja kalsiumkarbonaatista (ammoniakkisooda (Solvay) -prosessin kautta)
b) natriumkarbonaatista ja vetykarbonaattimalmeista (trona ja nahkoliitti)
(a) natriumkloridista ja kalsiumkarbonaatista
Kokonaisreaktiota voidaan pitää kalsiumkarbonaatin ja natriumkloridin välisenä:
Kalsiumkarbonaatti on kuitenkin liian liukenematon reagoidakseen suolaliuoksen kanssa. Sen sijaan tuote saadaan seitsemän vaiheen sarjassa.
Prosessi tunnetaan nimellä ammoniakkisoodaprosessi tai Solvay-prosessi, joka on saanut nimensä sen vuonna 186I patentoineen belgialaisen teollisuuskemistin mukaan.
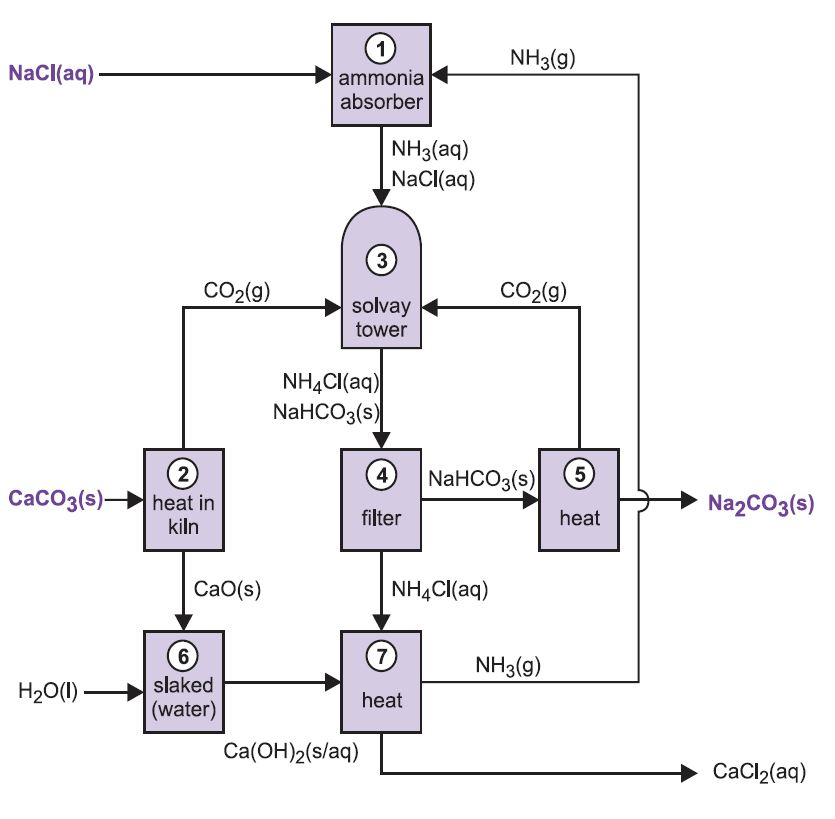
Solvay-prosessin eri vaiheet liittyvät toisiinsa, kuten alla olevasta kaaviosta ja kuvauksesta käy ilmi.
Kuvio 2 Solvay-prosessin eri vaiheet.
(1) Suolaliuoksen ammoniakointi
Ammoniakkikaasu imeytetään väkevään suolaliuokseen, jolloin saadaan liuos, joka sisältää sekä natriumkloridia että ammoniakkia. Läsnä on Na+(aq), Cl-(aq), NH4+(aq), OH-(aq) -ioneja ja NH3(aq).
(2) Kalsiumoksidin ja hiilidioksidin muodostuminen
Kattiloihin syötetään kalkkikivi/koksiseosta (13:1 massaltaan). Koksi palaa esilämmitetyn ilman vastavirrassa:
Palamislämpö nostaa uunin lämpötilaa ja kalkkikivi hajoaa:
Gaasista, joka sisältää noin 40 % hiilidioksidia, poistetaan kalkkipölyä ja se ohjataan hiilihapotustorniin (Solvay). Jäännös, kalsiumoksidi, käytetään ammoniakin talteenottoon (ks. vaihe 7 jäljempänä).
(3) Solvay-torni
Tämä on prosessin tärkein vaihe. Vaiheesta (1) peräisin oleva ammoniakkipitoinen suolavesi johdetaan Solvay-tornin läpi alaspäin, kun taas vaiheista (2) ja (5) peräisin oleva hiilidioksidi johdetaan torniin ylöspäin. Solvay-torni on korkea, ja siinä on sienenmuotoiset läpiviennit, jotka hidastavat ja hajottavat nestevirtausta, jotta hiilidioksidi voi imeytyä tehokkaasti liuokseen. Hiilidioksidi reagoi liuetessaan liuenneen ammoniakin kanssa muodostaen ammoniumvetykarbonaattia:
Liuos sisältää nyt ionit Na+(aq), Cl-(aq), NH4+(aq) ja HCO3-(aq). Niistä neljästä aineesta, jotka voisivat muodostua näiden ionien eri yhdistelmistä, natriumvetykarbonaatti (NaHCO3) on vähiten liukeneva. Se saostuu kiinteänä aineena tornin alaosaan, joka jäähdytetään. Nettoprosessi on:
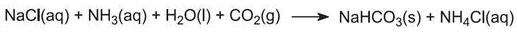
Suspensio, jossa on kiinteää natriumvetykarbonaattia ammoniumkloridiliuoksessa, juoksutetaan ulos tornin alaosasta.
(4) Kiinteän natriumvetykarbonaatin erottaminen
Suspensio suodatetaan, jotta kiinteä natriumvetykarbonaatti saadaan erotetuksi ammoniumkloridiliuoksesta, jota käytetään vaiheessa (7).
(5) Natriumkarbonaatin muodostuminen
Natriumvetykarbonaatti kuumennetaan pyörivissä uuneissa 450 K:n lämpötilassa niin, että se hajoaa natriumkarbonaatiksi, vedeksi ja hiilidioksidiksi:
Hiilidioksidi lähetetään takaisin Solvay-torniin, jotta se voidaan käyttää vaiheessa (3). Prosessin tuote, vedetön natriumkarbonaatti, saadaan hienona valkoisena jauheena, jota kutsutaan kevyeksi natriumkarbonaatiksi.
(6) Kalsiumhydroksidin muodostuminen
Kahdessa viimeisessä vaiheessa (6) ja (7) on kyse ammoniakin regeneroinnista ammoniumkloridista (joka on valmistettu vaiheessa 3). Vaiheesta (2) peräisin oleva kalkki liuotetaan ylimääräisellä vedellä, jolloin saadaan kalkkimaitoa:
(7) Ammoniakin regenerointi
Tämä kalsiumhydroksidisuspensio sekoitetaan vaiheesta (4) jäljelle jääneeseen ammoniumkloridiliuokseen ja kuumennetaan:
Ammoniakki otetaan näin talteen, ja se lähetetään takaisin vaiheeseen (1). Kalsiumkloridi on koko prosessin ainoa sivutuote.
Kokonaisprosessi on tyylikäs. Teoriassa ainoat raaka-aineet ovat kalkkikivi ja suolavesi. Ammoniakkihäviöitä syntyy väistämättä, ja ne korvataan lisäämällä ylimääräisiä tarvikkeita, kuten vaiheessa (1) vaaditaan.
(b) Trona- ja nahkoliittimalmista
Solvay-prosessia ei käytetä Yhdysvalloissa. Sen sijaan teollisuus käyttää kahta malmia, ja niiden osuus maailman tuotannosta on noin 30 %. Toinen on trona, jota löytyy valtavia määriä Wyomingista. Tronan kaava on:
Malmi louhitaan kiinteänä ja kuumennetaan hiilidioksidin karkottamiseksi, jolloin saadaan natriumkarbonaattia:
Toinen malmi on nahkoliitti, joka on natriumvetykarbonaattia. Kuumennettaessa se muodostaa natriumkarbonaattia.