INTRODUCTION
La maladie de Chagas ou trypanosomiase américaine est une parasitose originaire du continent américain. Carlos Chagas a décrit la maladie au début du 20e siècle et elle continue de représenter l’un des défis de santé publique les plus importants en Amérique latine.
Les tendances épidémiologiques des 20 dernières années révèlent clairement une réduction générale de la transmission vectorielle due aux programmes de contrôle et à l’amélioration de l’habitat rural, ainsi que l’interruption de la transmission vectorielle au Chili, en Uruguay et, récemment, au Brésil, tout cela ayant contribué à une réduction de l’incidence de la maladie sur l’ensemble du continent1-3.
Dans l’environnement naturel, Trypanosoma cruzi est transmis par une variété d’espèces de punaises triatomes, qui agissent comme des vecteurs. Cependant, d’autres mécanismes de transmission non vectoriels ont été décrits via les produits sanguins, les transplantations d’organes et la transmission verticale. Dans les régions où l’infection est endémique, la transmission orale a également été décrite par l’ingestion d’aliments contaminés par des excréments de punaises infectées.4,5
A l’heure actuelle, la maladie de Chagas touche 10 à 12 millions d’individus dans le monde.6 Sa distribution géographique s’étend du 40e parallèle nord, dans la partie sud de l’Amérique du Nord, au 45e parallèle sud, en Argentine et au Chili.7 L’urbanisation de l’Amérique latine, qui s’est intensifiée dans la seconde moitié du XXe siècle, a modifié le profil épidémiologique de la maladie, et les mouvements migratoires en provenance des pays endémiques ont permis de diagnostiquer la maladie de Chagas dans des régions où elle n’est pas endémique.8,9
L’Espagne est devenue l’un des pays européens qui accueille le plus grand nombre d’immigrants en provenance d’Amérique latine. Au 31 décembre 2005, près d’un million de personnes originaires d’Amérique latine figuraient dans les registres des ressortissants étrangers titulaires d’une carte d’identité de résident espagnol10, bien que les registres de recensement municipaux pour l’année 2005 indiquent des chiffres plus élevés (1 445 796 personnes). Des unités et des services spécialisés en médecine tropicale et en santé internationale en Espagne ont déjà commencé à diagnostiquer et à traiter les individus atteints de la maladie.11
La récente réunion de l’Organisation panaméricaine de la santé à Montevideo a discuté de cette situation et a mentionné dans son rapport final les besoins des pays accueillant des immigrants en provenance de zones endémiques afin de faire face à la maladie de Chagas et d’être en mesure de fournir un traitement approprié aux individus affectés, ainsi que de prévenir la transmission verticale et sanguine de T cruzi.12
PATHOGÉNÈSE ET HISTOIRE NATURELLE DES MALADIES CARDIAQUES DE LA MALADIE DE CHAGAS
Après la phase aiguë de l’infection, la maladie de Chagas non traitée entre dans une phase chronique qui est initialement asymptomatique ou non reconnue. Par la suite, 20 à 30% des patients développent des anomalies cardiaques (forme cardiaque), 10% des plaintes digestives (forme digestive) ou les deux (forme mixte), et moins de 5% des patients développent une forme neurologique de la maladie. Les autres resteront asymptomatiques, sans manifestation clinique tout au long de leur vie.13
En raison de la gravité potentielle des complications cardiaques de la maladie et de leur fréquence, le deuxième atelier sur la maladie de Chagas importée s’est concentré sur les caractéristiques cliniques de la cardiopathie chronique de Chagas et sur les conditions requises pour un diagnostic, une prise en charge et un traitement corrects. La pathogénie de la maladie n’est pas claire, bien que les connaissances actuelles s’orientent vers une étiologie mixte, dans laquelle le parasite serait directement impliqué dans la production de lésions myocardiques14,15 et d’un phénomène auto-immun associé.16,17 Parmi les autres mécanismes pathogéniques décrits figurent des altérations microvasculaires et une dénervation autonome18-21.
La cardiopathie de Chagas présente certaines caractéristiques qui la différencient d’autres affections cardiaques plus fréquemment observées en Espagne :
C’est une maladie fibrotique qui est généralement localisée dans la région postéro-inférieure et apicale du ventricule gauche, le nœud sinusal et le système de conduction sous la branche de faisceau, et elle entraîne des anomalies segmentaires prédominantes dans la contractilité
C’est une cardiomyopathie dilatée avec une tendance à la formation d’anévrismes, en particulier dans la région apicale
Elle a un puissant potentiel arythmogène et les arythmies ventriculaires sont fréquentes, souvent associées à des bradyarythmies (d’origine auriculo-ventriculaire ou survenant dans le nœud sinusal)
Elle est associée à un taux élevé d’événements thromboemboliques
Elle peut se présenter sous la forme d’une douleur précordiale, généralement atypique bien qu’elle puisse parfois mimer une cardiopathie ischémique.
Dans l’évolution naturelle de la maladie, les anomalies cardiaques apparaissent progressivement vers 20 à 30 ans après l’infection22. Cependant, 5 à 10 % des patients présentent une myocardite pendant la phase aiguë qui évolue rapidement vers une forme sévère de cardiopathie de Chagas.23,24 Plus rarement, les patients qui sont en phase chronique de la maladie, avec une atteinte cardiaque légère, peuvent présenter une exacerbation soudaine avec une parasitémie intense et des symptômes d’insuffisance cardiaque aiguë ; les immunosuppresseurs favorisent également ces exacerbations25.
ÉVALUATION DES PATIENTS SUSPECTÉS DE LA MALADIE DE CHAGAS ET DE LA MALADIE CARDIAQUE DE CHAGAS
Diagnostic de l’infection à T cruzi
Le diagnostic de la maladie de Chagas en Espagne a été abordé dans le document de consensus du premier atelier sur la maladie de Chagas importée26. En résumé, il repose sur le respect de 2 critères :
Antécédents compatibles avec l’épidémiologie de la maladie : les antécédents du patient doivent comporter au moins 1 élément qui aurait rendu possible la transmission de T cruzi par l’une des voies d’infection décrites (individus originaires de zones endémiques ou enfants de mères originaires de zones endémiques ; voyageurs ayant effectué des séjours dans des régions endémiques et ayant un mode de vie les exposant au risque d’infection)
Diagnostic microbiologique : les individus sont considérés comme infectés lorsqu’ils ont un résultat positif en parasitologie ou 2 résultats positifs avec 2 techniques sérologiques qui emploient des antigènes différents. En cas de résultats ambigus ou incohérents, une troisième technique doit être utilisée. Il existe plusieurs tests sérologiques pour le diagnostic de la maladie de Chagas qui utilisent différentes techniques (test immuno-enzymatique, ELISA modifié ou ELISA avec antigènes recombinants, immunofluorescence, hémagglutination indirecte et immunochromatographie). La réaction en chaîne par polymérase (PCR) est peut-être la technique la plus sensible pour l’analyse parasitologique de la maladie de Chagas chronique, mais son utilisation ne supprime pas la nécessité d’un test sérologique
Examen cardiaque de base chez les patients atteints d’une infection à T cruzi
Pour exclure une atteinte cardiaque chez les patients atteints d’une infection à T cruzi, une anamnèse complète et un examen physique complet doivent être effectués, ainsi qu’une électrocardiographie, une radiographie pulmonaire et une échocardiographie. Les symptômes et les signes de la cardiopathie de Chagas observés à l’examen physique sont les mêmes que pour la cardiomyopathie en général et aucun n’est caractéristique de la maladie.
Analyse médicale
Le principal objectif de l’anamnèse est de détecter les symptômes d’une éventuelle cardiopathie sous-jacente. Le tableau 1 montre les signes et les symptômes qui sont le plus souvent associés à une maladie cardiaque due à T cruzi. Il est également important d’évaluer les troubles digestifs (dysphagie, constipation, etc.), car les deux formes peuvent parfois coexister.

Lorsque l’anamnèse est réalisée, il est important de se rappeler que les différences linguistiques et culturelles peuvent interférer avec la communication entre le patient et le médecin. Parfois, les patients n’appliquent pas la même signification à certains mots (par exemple, les termes utilisés en espagnol pour l’essoufflement, les vertiges ou les palpitations) et il peut être nécessaire de définir ce à quoi on fait référence dans chaque cas. En outre, les immigrants souffrent souvent de difficultés d’adaptation, du mal du pays et de troubles de l’humeur liés à leur situation sociale et familiale27, ce qui peut poser des problèmes pour identifier avec précision le symptôme cardinal ou le motif de consultation. Enfin, les conditions de travail défavorables doivent également être prises en compte (longues heures de travail, peur de perdre son emploi, contrats illégaux, etc.) car elles représentent un obstacle supplémentaire à la fréquentation des rendez-vous prévus. Étant donné que la maladie est familière à ces patients et qu’elle les inquiète, la notification d’un résultat positif à l’infection ou à la maladie de Chagas nécessite un processus de communication minutieux au cours duquel la confiance est établie.12 Les médiateurs culturels jouent un rôle important dans ce processus.
Examen physique
Un examen physique détaillé doit être effectué en accordant une attention particulière au système cardiovasculaire. Des souffles cardiaques dus à un dysfonctionnement valvulaire peuvent apparaître en raison de la dilatation des chambres. À des stades plus avancés, on observe les signes habituels de congestion et d’hypoperfusion périphérique. La cachexie cardiaque est également un indicateur de stades plus avancés de la cardiopathie de Chagas et a une valeur pronostique élevée.
Electrocardiogramme
Un électrocardiogramme (ECG) conventionnel à 12 dérivations avec un enregistrement long (30 secondes) en DII doit être réalisé chez tous les patients atteints d’une infection par T cruzi. Dans la phase chronique de l’infection, les altérations de l’ECG apparaissent un certain nombre d’années avant les symptômes et la cardiomégalie (tableau 2). Bien qu’il n’y ait pas de schéma caractéristique à l’ECG, ces modifications, en particulier le bloc de branche droit, isolé ou associé à un hémibloc antérieur gauche chez les patients ayant une sérologie positive, peuvent être considérées comme des indicateurs de la cardiopathie chronique de Chagas28-30. Néanmoins, étant donné leur manque de spécificité, le diagnostic nécessite une confirmation, car leur présence ne signifie pas nécessairement une étiologie chagasique.

Un ECG normal exclut la présence d’une dysfonction ventriculaire gauche modérée ou sévère, avec une valeur prédictive négative proche de 100% : En revanche, plus le nombre de modifications de l’ECG est élevé, plus la fonction ventriculaire est mauvaise.31
Les altérations de la conduction intraventriculaire et l’élargissement du complexe QRS apparaissent précocement dans la cardiopathie chronique de Chagas, alors que les anomalies de la contraction myocardique ne sont pas encore présentes, ce qui signifie qu’elles n’ont pas la valeur pronostique qu’elles affichent dans d’autres cardiopathies32.
Radiographie thoracique
La radiographie thoracique a une faible sensibilité pour la détection de la cardiopathie de Chagas, car une dysfonction ventriculaire peut se produire tout en obtenant une radiographie normale. Cependant, la mise en évidence d’une cardiomégalie pourrait être prédictive d’une mort subite chez les patients atteints de la maladie de Chagas chronique33. Elle doit être réalisée avec le patient en situation de compensation clinique, en évaluant l’hypertension veino-capillaire, l’expansion des cavités ou un index cardiothoracique supérieur à 0,6 comme signes positifs.
Échocardiographie
Étant donné que l’échocardiographie est une technique non invasive largement disponible et très utile pour l’évaluation de la fonction ventriculaire, tous les patients atteints de la maladie de Chagas sont candidats à une échocardiographie de base.
Les altérations échocardiographiques les plus courantes sont résumées dans le tableau 3.34,35 Les recommandations suivantes sont utiles pour l’échocardiographie :

Il est conseillé de réaliser un examen d’échocardiographie transthoracique conventionnel, en suivant un système spécifique.
1. Utiliser un transducteur à haute fréquence.
2. Obtenir une échocardiographie transversale (pour une analyse segmentaire de la région inféropostérieure), une vue apicale à 2 chambres, et des vues intermédiaires entre 2 et 4 chambres, pour détecter d’éventuels anévrismes apicaux.
3- Une attention particulière doit être portée à la région postéro-inférieure du ventricule gauche, y compris l’apex cardiaque, dans le but d’identifier une hypokinésie ou une akinésie segmentaire, ainsi que des anévrismes apicaux. Il est également fréquent d’observer une hyperéchogénicité et un rétrécissement de la paroi, similaires à ceux décrits dans les cardiopathies ischémiques ; ceci constitue un substrat pour le développement d’arythmies ventriculaires réentrantes.
4. Il est recommandé d’accorder une attention particulière à la recherche d’un contraste spontané de l’écho et à l’existence de thrombi dans les cavités.
5. Évaluer spécifiquement la fonction diastolique et la fonction ventriculaire droite chez tous les patients suspects de cardiopathie de Chagas. L’altération de la fonction diastolique du ventricule gauche se produit tôt dans la maladie de Chagas et sa gravité est généralement corrélée au degré de dysfonctionnement systolique36,37.
6 L’examen transœsophagien est indiqué lorsque la fenêtre transthoracique ne permet pas d’évaluer les cavités gauches.
La réduction de la fraction d’éjection du ventricule gauche, l’augmentation du diamètre endo-systolique et un schéma d’écoulement mitral restrictif sont les meilleurs indicateurs pronostiques obtenus par échocardiographie chez les patients atteints de la maladie cardiaque de Chagas.38,39
A des stades avancés de la maladie, lorsque l’insuffisance cardiaque congestive est présente, le profil échocardiographique prédominant implique une hypokinésie biventriculaire diffuse avec une hypertrophie des 4 cavités.
Autres examens cardiologiques chez les patients suspects de cardiopathie de Chagas
En plus des études de base mentionnées, d’autres examens complémentaires peuvent être utiles chez certains patients ou dans certaines circonstances :
Monitorage Holter 24 heures
Un monitorage Holter 24 heures est recommandé chez les patients présentant les symptômes suivants :
Symptômes évocateurs d’une arythmie cardiaque (syncope, présyncope ou palpitations)
Présence de certaines arythmies cardiaques à l’ECG, telles que les bradyarythmies sinusales (avec une fréquence cardiaque moyenne inférieure à 40 battements par minute et/ou des pauses sinusales prolongées), les blocs auriculo-ventriculaires du second degré, et les extrasystoles ventriculaires fréquentes et/ou répétitives (salves)
La surveillance Holter de vingt-quatre heures permettra d’évaluer l’association possible des symptômes à une arythmie, d’identifier les patients à risque de mort subite et d’identifier un dysfonctionnement autonome.33,40 Des épisodes de tachycardie ventriculaire non soutenue sont enregistrés chez environ 90 % des patients atteints de la maladie cardiaque de Chagas et d’une dysfonction ventriculaire ou d’une insuffisance cardiaque.41
La surveillance Holter doit être réalisée à l’aide d’une technique conventionnelle, de préférence avec un système à 3 canaux. La sensibilité de l’enregistrement Holter est faible lorsque les épisodes d’arythmie sont peu fréquents et d’autres techniques telles que le Holter implantable peuvent être utilisées dans ces cas.
Étude électrophysiologique
L’objectif d’une étude électrophysiologique chez ces patients est d’identifier les anomalies de conduction auriculo-ventriculaire et intra-ventriculaire et d’évaluer l’induction d’arythmies ventriculaires malignes. Les indications sont les mêmes que pour l’évaluation d’autres troubles présentant un risque de mort subite :
Patients présentant des symptômes évocateurs d’arythmie (syncope ou présyncope) non confirmés par des études antérieures
Tachycardie ventriculaire soutenue, avec ou sans symptômes, quel que soit le degré de la fonction ventriculaire
Patient réanimé d’une mort subite
Patients présentant des altérations de l’ECG ou du monitorage Holter associées à un risque accru de mort subite : extrasystoles ventriculaires répétées ou appariées, épisodes de tachycardie ventriculaire non soutenue et étalement accru de l’intervalle QT associé à la présence d’un dysfonctionnement ventriculaire.42 Dans ce sous-ensemble de patients, si une étude électrophysiologique n’est pas possible, l’amiodarone peut être administrée empiriquement tant qu’il n’y a pas de contre-indications.
Tests à l’effort
Les tests à l’effort seraient principalement indiqués dans les cas suivants :
Évaluation de la capacité fonctionnelle
Évaluation de la réponse chronotrope
En présence d’une douleur thoracique et d’une cardiopathie de Chagas, le test d’effort est peu utile pour déterminer l’étiologie de la douleur ; dans ces cas, une coronarographie doit être réalisée
Coronarographie
La coronarographie est indiquée selon les critères de la Société espagnole de cardiologie43, en tenant compte des considérations relatives aux épreuves d’effort.
Biopsie myocardique
La biopsie myocardique n’est pas actuellement considérée comme une technique diagnostique dans la cardiopathie de Chagas en raison de son risque et de sa spécificité limitée.
Gestion des patients atteints d’une infection à T CRUZI
Patients asymptomatiques ayant un électrocardiogramme et une radiographie pulmonaire normaux
Le risque de cardiopathie de Chagas est plus important au cours des deuxième et troisième décennies suivant l’infection44. Chez les patients présentant des signes d’infection par T cruzi et ayant un ECG normal ou des anomalies minimes qui ne sont pas évocatrices d’une cardiopathie chronique de Chagas, le risque annuel d’évolution vers une cardiopathie se situe entre 2 % et 5 %.45,46 Par conséquent, une échocardiographie de référence est recommandée.
Patients asymptomatiques présentant des anomalies à l’ECG
L’échocardiographie de référence est recommandée chez les patients asymptomatiques présentant des anomalies à l’ECG. Les résultats sont très variables, et un dysfonctionnement ventriculaire gauche (fraction d’éjection inférieure à 40 %) est détecté dans environ 30 % des cas. Le tableau 4 montre la prévalence de la dysfonction ventriculaire gauche en fonction du tracé ECG.47 En général, le pronostic est déterminé par le degré de dysfonction ventriculaire.48
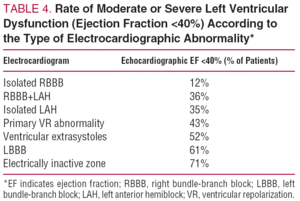
La fréquence à laquelle l’échocardiographie doit être répétée dépend de l’état clinique du patient. Bien que des études ne soient pas disponibles, la progression de la maladie est lente chez les patients asymptomatiques ayant un échocardiogramme normal ; par conséquent, il est suffisant de répéter l’évaluation dans les 5 années suivantes dans ce groupe, tant que des symptômes n’apparaissent pas. Lorsque l’étude initiale révèle des anomalies, elle doit être répétée dans un délai de 1 à 3 ans, en raison du risque accru de progression49, surtout s’il existe une dysfonction ventriculaire significative (fraction d’éjection inférieure à 40 %). Chez tout patient, l’apparition de nouveaux symptômes ou d’anomalies ECG doit être considérée comme une indication pour une nouvelle échocardiographie.
Le but du suivi échocardiographique est d’identifier les patients présentant une dysfonction modérée ou sévère, qui sont souvent encore asymptomatiques mais qui pourraient bénéficier de l’apport précoce de médicaments pour la prise en charge de la maladie cardiaque50.
Patients symptomatiques
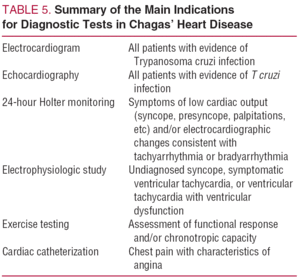
Les patients présentant une cardiopathie de Chagas symptomatique (tableau 1) doivent être considérés comme présentant un risque accru de mort subite. Des symptômes aussi peu spécifiques que la faiblesse ou la vacillation ont beaucoup plus d’importance dans ce contexte car ils pourraient être prédictifs d’un épisode de syncope. Il est important de se rappeler que la mort subite peut souvent être la première manifestation de la maladie cardiaque de Chagas51,52. Le tableau 5 résume les principales indications des tests diagnostiques dans l’évaluation de la cardiopathie de Chagas.
Traitement des patients atteints de cardiopathie de CHAGAS
Gestion de la dysfonction ventriculaire et de l’insuffisance cardiaque
En général, la gestion de ces patients a beaucoup en commun avec celle des autres maladies cardiaques. Il faut également tenir compte du fait que l’on applique souvent à la cardiopathie de Chagas des mesures générales qui ne sont pas spécifiquement validées pour être utilisées dans cette maladie. Les β-bloquants (avec les précautions mentionnées dans le paragraphe suivant) et les inhibiteurs de l’enzyme de conversion de l’angiotensine (IEC) sont les médicaments recommandés chez les patients présentant une dysfonction ventriculaire modérée ou sévère (fraction d’éjection 53
Il existe des particularités dans la cardiopathie de Chagas qu’il est important de prendre en considération pour la prise en charge thérapeutique de ces patients :
La cardiopathie chronique de Chagas est associée à un taux élevé de bradyarythmies (bloc auriculo-ventriculaire, dysfonctionnement du nœud sinusal, etc). Par conséquent, les médicaments tels que les glycosides digitaliques, les β-bloquants, certains antagonistes des canaux calciques et l’amiodarone doivent être utilisés avec précaution, en initiant le traitement à faible dose et en surveillant attentivement l’apparition éventuelle de complications
Les patients présentant une insuffisance cardiaque réfractaire peuvent être évalués comme candidats à une transplantation cardiaque. Malgré la description de quelques cas de réactivation de la maladie de Chagas, Malgré la description de quelques cas de réactivation de la maladie de Chagas, les séries de cas publiées montrent des résultats satisfaisants et une meilleure survie chez ces patients par rapport aux patients atteints de cardiopathie ischémique ou de cardiomyopathie dilatée idiopathique54
Il n’y a pas d’indication de cardiomyoplastie ou de chirurgie reconstructive dans cette maladie
L’utilité de la thérapie de resynchronisation chez ces patients est encore en discussion et des critères échocardiographiques et d’ECG doivent être utilisés pour évaluer l’efficacité de la thérapie. ECG doivent être utilisés pour évaluer son indication
Certains résultats préliminaires non publiés ont été obtenus sur l’amélioration de la fonction myocardique par l’utilisation de cellules souches chez les patients atteints de la maladie de Chagas
Gestion et prévention des thromboembolies
Le taux élevé d’événements thrombotiques et emboliques doit être pris en considération chez les patients atteints de la maladie de Chagas. La plupart de ces événements sont des accidents ischémiques cérébraux et de nombreux patients présentent des causes cardiovasculaires qui expliquent le phénomène, bien que d’autres facteurs soient impliqués55,56.
Dans une étude réalisée au Brésil, 4 prédicteurs d’accident vasculaire cérébral embolique ont été identifiés chez des patients présentant une cardiopathie de Chagas sous-jacente : âge supérieur à 48 ans, anomalie primaire de la repolarisation ventriculaire, anévrisme apical et fraction d’éjection ventriculaire gauche inférieure à 50 %.57 La présence de ces 4 prédicteurs était associée à une incidence annuelle d’accident vasculaire cérébral de 4 %. En l’absence de preuves plus définitives, la prévention de la thromboembolie chez les patients atteints de cardiopathie chronique de Chagas devrait néanmoins être guidée par les recommandations cliniques standard : patients présentant une fibrillation auriculaire, des événements emboliques antérieurs et/ou l’existence de thrombus muraux. Le rôle des médicaments antiplaquettaires dans la prévention des événements thromboemboliques reste à déterminer.
Gestion des bradyarythmies
Les bradyarythmies symptomatiques sont parfois candidates à l’implantation d’un stimulateur cardiaque. Les directives internationales sur l’implantation de stimulateurs cardiaques sont utiles chez les patients atteints de la maladie cardiaque de Chagas.
Gestion des arythmies ventriculaires
Les patients atteints de la maladie cardiaque de Chagas présentent souvent des extrasystoles et des tachycardies ventriculaires, le plus souvent associées à des lésions myocardiques qui génèrent des phénomènes de réentrée. La plupart des tachyarythmies ventriculaires soutenues chez les patients atteints de la maladie cardiaque de Chagas ne proviennent pas de l’anévrisme apical du ventricule gauche mais plutôt de la région inféro-latérale58,59.
Puisqu’il s’agit d’une anomalie progressive avec de multiples foyers arythmogènes, l’ablation par radiofréquence ne doit pas être considérée comme une technique de premier choix.
En revanche, et malgré l’absence d’études spécifiques dans la maladie cardiaque chronique de Chagas, l’implantation d’un défibrillateur cardioverteur implantable est recommandée pour réduire le risque de mort subite dans les situations suivantes :
Tachycardie ventriculaire soutenue. En outre, chez ces patients, il est conseillé d’administrer empiriquement de l’amiodarone afin de réduire le taux de décharge et de diminuer la probabilité d’orage électrique. Si le patient reçoit trop de décharges malgré ce traitement, l’ablation par radiofréquence doit être envisagée60,61
Tachycardie ventriculaire soutenue monomorphe pendant l’étude électrophysiologique
L’administration d’amiodarone est une possibilité chez les patients présentant une tachycardie ventriculaire non soutenue et une étude électrophysiologique normale (non inductible).
Gestion de la douleur angineuse
La douleur thoracique constitue parfois une manifestation clinique de la maladie cardiaque de Chagas, voire de la maladie de Chagas œsophagienne. Il est postulé que le mécanisme physiopathologique sous-jacent à ce symptôme est une anomalie de la microvasculature myocardique.
Si la douleur thoracique est le symptôme principal ou prédominant de la cardiopathie de Chagas, le diagnostic différentiel doit inclure l’évaluation d’une cardiopathie ischémique associée par cathétérisme cardiaque. L’évaluation de la perfusion myocardique avec des techniques utilisant des isotopes radioactifs peut être utilisée, bien que leur utilité pour le diagnostic différentiel de la douleur angineuse soit limitée par la présence de zones de fibrose myocardique chez les patients atteints de la maladie cardiaque de Chagas. Aucun traitement spécifique n’est disponible pour ces cas.
Traitement étiologique dans la maladie de Chagas chronique
On sait que dans la phase chronique de la maladie, le taux de guérison chez les adultes varie de 8 % à 25 %.62 La réduction du titre des anticorps sériques est utilisée comme marqueur de guérison, mais la lenteur avec laquelle les changements sérologiques se produisent, les infections répétées possibles dans les zones endémiques et le manque de marqueurs cliniques ont rendu difficile de déterminer clairement l’efficacité du traitement. Par conséquent, et en raison des effets indésirables potentiels du médicament, il n’existe pas de consensus international sur le traitement étiologique dans cette phase de la maladie. Cependant, une étude récente a montré une réduction de la progression de la maladie de Chagas chez les patients traités par benznidazole63. Selon le document de consensus de 2005,26 les patients dont les tests parasitologiques sont positifs doivent recevoir un traitement étiologique et celui-ci doit être envisagé pour les autres ; un accord doit être établi entre le médecin et le patient et une information adéquate sur les effets indésirables potentiels du médicament doit être fournie.
Considérations supplémentaires
La maladie de Chagas doit être suspectée chez tous les patients dont l’histoire est compatible avec l’épidémiologie de la maladie et qui présentent des symptômes d’atteinte cardiaque. Les caractéristiques différentielles de la cardiopathie de Chagas, le peu d’informations disponibles sur la maladie en Espagne et le taux élevé d’arythmies et de mort subite comme manifestations primaires potentielles de la maladie font qu’il est prioritaire de préparer et de distribuer des protocoles de diagnostic et de traitement pour la prise en charge de ces patients afin d’améliorer la compréhension de la maladie par les professionnels de santé impliqués dans sa détection et sa prise en charge.
Dans certains contextes, les techniques nécessaires peuvent ne pas être disponibles pour un diagnostic et un traitement corrects des patients suspects de maladie de Chagas ou de cardiopathie de Chagas. Si un patient ayant des antécédents compatibles avec l’épidémiologie de la maladie présente des signes et des symptômes de maladie cardiaque, il est recommandé de l’adresser à un spécialiste en cardiologie et à un hôpital spécialisé dans les maladies importées. Dans les deux cas, l’orientation ne doit pas impliquer que le médecin de soins primaires, qui est responsable de l’évaluation initiale du patient, n’obtienne pas de bons antécédents médicaux et ne procède pas à une évaluation clinique, à un ECG conventionnel et à une radiographie pulmonaire avant d’orienter le patient.
Il est clair que la gestion de la cardiopathie chronique de Chagas a été, et continue d’être, un sujet de discussion scientifique dans les pays endémiques. Pour plus d’informations, les lecteurs sont dirigés vers les rapports de consensus de la Société argentine de cardiologie et de la Société brésilienne de cardiologie64,65 ; ces documents sont disponibles sur internet.
L’atelier sur la maladie de Chagas importée a eu lieu les 6 et 7 mars 2006 et a été financé par l’Agència de Gestió d’Ajuts Universitaris i de Recerca (AGAUR ; 2005/ARCS2/00040) du gouvernement régional catalan, le ministère espagnol de l’Éducation et des Sciences (SAF-200524601-E), et le Réseau de médecine tropicale du Fonds espagnol de recherche en santé (RICET). Diverses personnes impliquées dans la préparation du document de consensus participent au réseau RICET et au Réseau catalan de surveillance épidémiologique des maladies tropicales et importées (RIVEMTI).
Correspondance : Dr. J. Gascón.
Secció Medicina Tropical. Centre de Salut Internacional. Hôpital Clínic.
Villarroel, 170. 08036 Barcelone. España.
E-mail : [email protected]