3, voir Carbonate. Pour le district postal britannique, voir CO postcode area.
Le trioxyde de carbone (CO3) est un oxyde de carbone instable (un oxocarbone). Les isomères possibles du trioxyde de carbone comprennent ceux dont les groupes de points de symétrie moléculaire sont Cs, D3h et C2v. Il a été démontré que l’état C2v, consistant en un dioxirane, est l’état fondamental de la molécule. Le trioxyde de carbone ne doit pas être confondu avec l’ion carbonate stable (CO32-).
 |
|
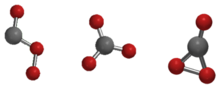
Les isomères Cs, D3h, et C2v du trioxyde de carbone
|
|
| Noms | |
|---|---|
| Nom IUPAC
Dioxiran-3-one
|
|
| Identifiants | |
|
Modèle 3D (JSmol)
|
|
|
PubChem CID
|
|
|
|
|
|
| Propriétés | |
| CO3 | |
| Masse molaire | 60.008 g-mol-1 |
|
Sauf indication contraire, les données sont données pour des matériaux dans leur état standard (à 25 °C , 100 kPa).
|
|
| Références infobox | |
Le trioxyde de carbone peut être produit, par exemple, dans la zone de dérive d’une décharge corona négative par des réactions entre le dioxyde de carbone (CO2) et l’oxygène atomique (O) créé à partir de l’oxygène moléculaire par les électrons libres du plasma. Une autre méthode rapportée est la photolyse de l’ozone O3 dissous dans du CO2 liquide, ou dans des mélanges CO2/SF6 à -45 °C, irradiés par une lumière de 253,7 nm. La formation de CO3 est déduite mais il semble se désintégrer spontanément par la voie 2CO3 → 2CO2 + O2 avec une durée de vie bien inférieure à 1 minute. Le trioxyde de carbone peut être produit en soufflant de l’ozone sur de la glace sèche (CO2 solide), et il a également été détecté dans des réactions entre le monoxyde de carbone (CO) et l’oxygène moléculaire (O2). Avec l’isomère C2v de l’état fondamental, la première détection spectroscopique de l’isomère D3h a eu lieu dans des glaces de dioxyde de carbone irradiées par des électrons.