El elemento químico cobalto está clasificado como un metal de transición. Fue descubierto en 1735 por George Brandt.

Zona de datos
| blanco azulado | |
| Punto de fusión: | 1495 oC, 1768 K |
| 2930 oC, 3203 K | |
| 27 | |
| 27 | |
| 32 | |
| 2,8,15,2 | |
| 3d7 4s2 | |
| 8.90 g/cm3 |
Mostrar más: Calores, Energías, Oxidación, Reacciones,
Compuestos, Radios, Conductividades
| Volumen atómico: | 6.7 cm3/mol |
| Estructura: | |
| Dureza: | 5,0 mohs |
| Capacidad calorífica específica | |
| Calor de fusión | 16.190 kJ mol-1 |
| Calor de atomización | 426 kJ mol-1 |
| Primera energía de ionización | 758.4 kJ mol-1 |
| 2ª energía de ionización | 1646 kJ mol-1 |
| 3ª energía de ionización | 3232.2 kJ mol-1 |
| Afinidad de los electrones | 63,8 kJ mol-1 |
| Número de oxidación mínimo | -1 |
| Número de oxidación mínimo común. | 0 |
| Número máximo de oxidación | 5 |
| Número máximo de oxidación común | 3 |
| Electronegatividad (escala de Pauling) | 1.88 |
| Volumen de polarizabilidad | 7,5 Å3 |
| Reacción con el aire | |
| Reacción con 15 M HNO3 | vigorosa, ? Co(NO3)2, NOx |
| Reacción con 6 M HCl | suave, ? H2, CoCl2 |
| Reacción con 6 M NaOH | – |
| Oxido(s) | CoO, Co3O4 |
| Nada | |
| Cloruro(s) | CoCl2 |
| 135 pm | |
| Radio iónico (ion 1+) | – |
| Radio iónico (ion 2+) | 83.8 pm |
| 71.8 pm | |
| – | |
| Radio iónico (2 ion) | – |
| – | |
| Conductividad térmica | 100 W m-1 K-1 |
| Conductividad eléctrica | 17.9 x 106 S m-1 |
| Punto de congelación/fusión: | 1495 oC, 1768 K |
Descubrimiento del cobalto
Desde la antigüedad se han utilizado compuestos de cobalto para producir vidrio azul y cerámica.
El elemento fue aislado por primera vez por el químico sueco George Brandt en 1735. Demostró que era la presencia del elemento cobalto la que causaba el color azul en el vidrio, y no el bismuto como se pensaba anteriormente.
Alrededor de 1741 escribió: «Al igual que hay seis tipos de metales, también he demostrado con experimentos fiables… que también hay seis tipos de semimetales: un nuevo semimetal, a saber, el cobalto regulus, además del mercurio, el bismuto, el zinc y los regulus del antimonio y el arsénico»
La palabra cobalto se deriva del alemán ‘kobold’, que significa duende o elfo. La imagen del cobalto que aparece a continuación es de Ben Mills.


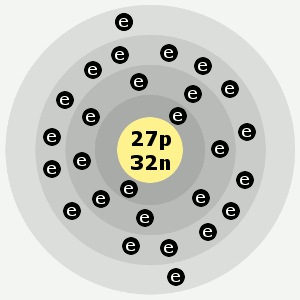
Capas de electrones del cobalto
Aspecto y características
Efectos nocivos:
El cobalto y sus compuestos se consideran ligeramente tóxicos por contacto con la piel y moderadamente tóxicos por ingestión.
Características:
El cobalto es un metal blanco azulado, lustroso, duro y quebradizo. Es ferromagnético.
El metal es activo químicamente, formando muchos compuestos. El cobalto se mantiene magnético hasta la temperatura más alta de todos los elementos magnéticos (tiene un punto Curie de 1121oC).
Usos del cobalto
El cobalto se utiliza en aleaciones para piezas de motores de aviones y en aleaciones con usos resistentes a la corrosión/desgaste.
El cobalto se utiliza ampliamente en baterías y en galvanoplastia.
Las sales de cobalto se utilizan para impartir colores azules y verdes en el vidrio y la cerámica.
El 60Co radiactivo se utiliza en el tratamiento del cáncer.
El cobalto es esencial para muchos seres vivos y es un componente de la vitamina B12.
El cobalto también se utiliza en imanes permanentes de samario-cobalto. Estos se utilizan en pastillas de guitarra y motores de alta velocidad.
Abundancia e isótopos
Abundancia corteza terrestre: 25 partes por millón en peso, 8 partes por millón en moles
Abundancia sistema solar: 4 partes por millón en peso, 0,7 partes por millón en moles
Costo, puro: 21 dólares por 100g
Costo, a granel: 4,40 dólares por 100g
Fuente: El cobalto no se encuentra como elemento libre en la naturaleza. Se encuentra en minerales. Los principales minerales de cobalto son la cobaltita (CoAsS), la eritrita (arseniato hidratado de cobalto), el glaucodot (Co,Fe)AsS y la skutterudita (Co,Ni)As3. El cobalto se produce generalmente como subproducto de la minería del níquel y del cobre.
Isótopos: El cobalto tiene 22 isótopos cuya vida media se conoce, con números de masa de 50 a 72. El cobalto natural consiste en su único isótopo estable, 59Co.

- Edward Smedley, Hugh James Rose, Henry John Rose, Encyclopaedia Metropolitana; or Universal Dictionary of Knowledge., 1845, Volume 4, p693 William Clowes and Sons.
Cite this Page
Cite this Page
Para enlazar en línea, por favor copie y pegue uno de los siguientes:
<a href="https://www.chemicool.com/elements/cobalt.html">Cobalt</a>
o
<a href="https://www.chemicool.com/elements/cobalt.html">Cobalt Element Facts</a>
Para citar esta página en un documento académico, por favor utilice la siguiente cita que cumple con MLA:
"Cobalt." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/cobalt.html>.