Az antibiotikumok felszámolják a kórokozó fertőzéseket és életeket mentenek – de ezzel egyidejűleg megzavarják a bél mikrobiom integritását is. Bár sok orvos felismeri, hogy az antibiotikum-terápiát követően helyre kell állítani a beteg mikrobiális egyensúlyát, sokkal kevesebben értik, hogyan lehet ezt hatékonyan megtenni.
Amie Skilton, ND szerint a bélflóra helyreállítása egyszerre művészet és tudomány. Ha jól csinálják, ez nagy változást jelenthet a betegek számára. Egyes esetekben még abban is segíthet, hogy a betegek legyőzzék azokat a betegségeket, amelyekre eredetileg az antibiotikumokat írták fel.
De többre van szükség annál, mint hogy csak egy készen kapható probiotikumot ajánljunk és a legjobbakat reméljük.
A Betegségellenőrző Központok tavaly tavasszal jelentették, hogy az orvosi rendelőkben és sürgősségi osztályokon évente felírt 154 millió antibiotikum-felírás 30 százaléka szükségtelen. A CDC megállapítása szerint a legtöbb felesleges receptet vírusok által okozott légzőszervi megbetegedésekre, például megfázásra, vírusos torokfájásra, hörghurutra, valamint arcüreg- és fülgyulladásra adták ki, amelyek nem reagálnak az antibiotikumokra. Ezeknek a gyógyszereknek a használata “feleslegesen teszi ki a betegeket az allergiás reakciók vagy a néha halálos hasmenés, a Clostridium difficile kockázatának.”
A képet tovább bonyolítja az a tény, hogy az antibiotikumokat nemcsak az orvosi rendelőkből terjesztik, hanem bőségesen etetik az állatállományt és nagy mennyiségben permetezik a termékeket, apró, de biológiailag aktív nyomokat hagyva az élelmiszerekben, amelyeket az emberek fogyasztanak.
A dózis, az időzítés határozza meg a hatást
Mivel az antibiotikumok elpusztítják a fertőzést okozó mikroorganizmusokat, nem szelektíven elpusztítják a hasznos bélbaktériumok közösségeit is, gyengítve a bél mikrobiom stabilitását. Ez a nagymértékű pusztítás tömeges lehet; egy qPCR-t alkalmazó vizsgálatból gyűjtött kísérleti adatok szerint a baktériumizolátumok száma akár 10-szeresére is csökkenhet közvetlenül az antibiotikumos kezelést követően (Panda, S. et al. PLoS One. 2014; 9(4): e95476).
“Ez valóban megtizedelő hatású” – mondja Dr. Skilton, az ausztráliai Sydneyben (NSW) található Elysium Clinic of Natural Medicine természetgyógyász orvosa és gyógynövényszakértője.
A Holistic Primary Care and Bioceuticals által szponzorált webináriumon felvázolta az antibiotikumok számtalan hatását az emberi mikrobiomra, megjegyezve, hogy nem minden antibiotikum egyformán pusztítja a bélbaktériumokat.
Az, hogy ezek a gyógyszerek milyen mértékben károsítják a bélmikrobiótát, a gyógyszer típusától, a kezelés időtartamától és az alkalmazás gyakoriságától függ, mondta Skilton. Bizonyos antibiotikumok például nagyobb mértékű endotoxinok és citokinek felszabadulását váltják ki, mint mások. A nagyobb napi adagok nagyobb hatással vannak. A nagy dózisú antibiotikumok tartós alkalmazása rendkívüli károkat okozhat a mikrobiomban, amelyek visszafordításához évekig tartó helyreállító terápiára lehet szükség, ha egyáltalán visszafordítható.
És a közhiedelemmel ellentétben az intravénás antibiotikumok ugyanolyan negatív hatással lehetnek a bélflórára, mint a szájon át szedett gyógyszerek. “Sokáig úgy gondolták, hogy az intravénás gyógyszerek megkerülik a bélrendszert, és nem fejtik ki ugyanazt a hatást. Ma már tudjuk, hogy ez nem igaz.”
Az antibiotikum beadásának időzítése is különbséget jelent. Azok az egyének, akik életük korai szakaszában gyakran használnak antibiotikumokat, életkoruk előrehaladtával sokféle betegségre érzékenyebbek. Egy idén megjelent tanulmányban a kutatók összefüggést mutattak ki a csecsemőkori antibiotikum-használat és a későbbi rossz neurokognitív eredmények között, azt sugallva, hogy az antibiotikum-fogyasztás a beteg első életévében kis mértékű, de statisztikailag szignifikáns különbségekkel járt együtt a gyermekkori kognitív, viselkedési és hangulati mérésekben (Slykerman, R. et al. Acta Paediatr. 2017; 106(1): 87-94).
Mások összefüggésbe hozták a magzati és kora gyermekkori antibiotikum-expozíciót az asztma későbbi, későbbi életkori kialakulásával (Örtqvist, A. et al. Brit Med J. 2014; 349. doi: https://doi.org/10.1136/bmj.g6979). Az antibiotikumokat összefüggésbe hozták az elhízással és a súlygyarapodással is gyermekeknél és felnőtteknél egyaránt (Million, M. et al. Clin Microbiol & Infec. 2013; 19(4): 305-313). A kutatók ezeket a változásokat a megváltozott bélmikrobiális összetételnek tulajdonítják.
Az antibiotikumok kiválthatják a toxikus lipopoliszacharidok (LPS), a patogén Gram-negatív baktériumok külső membránjában található nagy molekulák felszabadulását. Egyesek szerint az antibiotikumok által kiváltott LPS-felszabadulás hozzájárulhat a szeptikus sokk kialakulásához a Gram-negatív baktériumok által okozott súlyos fertőzések miatt kezelt betegeknél. Mások kimutatták, hogy az LPS gyulladásos citokinek felszabadításával immunválaszt vált ki, ami az antibiotikum-kezelést követően súlyosbodik – jegyezte meg Skilton webináriumában (Wu, T. et al. Toxicol Lett. 2009; 191(2-3): 195-202).
A kórokozó szempontjából az LPS termelése túlélési stratégia. Ezek a molekulák a sejtek felszínén kölcsönhatásba lépve gátat képeznek, megakadályozva az antibiotikumok és más hidrofób vegyületek bejutását, és lehetővé téve a Gram-negatív baktériumok életét még zord környezetben is (Zhang, G. et al. Curr Opin Microbiol. 2013; 16(6): 779-785).
Hogyan állítsuk helyre a bélflórát
A probiotikumok az antibiotikumokat követően a bélflóra helyreállítására irányuló átfogó stratégia egyik aspektusa. Tekintettel az egészséges bél-ökoszisztéma mikrobiális sokféleségére, Skilton olyan termékek használatát ajánlja, amelyek a hasznos mikrobák számos különböző faját tartalmazzák, ahelyett, hogy egy vagy két egyetlen törzzsel “monokultúráznának”.
Az általános szabály szerint minden olyan hétre, amikor a beteg antibiotikumot szedett, egy hónapnyi probiotikus kezelést javasol. Azok, akik hosszan tartó folyamatos antibiotikum-kezelésen voltak, szintén hosszú távú helyreállításra szorulnak. Hangsúlyozta, hogy a legtöbb ember számára nem jár egészségügyi kockázattal a hosszabb probiotikum-kiegészítés.
Azoknak a betegeknek, akik intravénás antibiotikumot kapnak, szintén komensális probiotikumokat kell szedniük. Egyes klinikusok, akik tisztában vannak ezzel a problémával, már négy órával az intravénás antibiotikum adag után elkezdik a probiotikumokat.
A glikokalyx újjáépítése
A hosszú távú vagy többszöri antibiotikum-kúrán átesett embereknél általában a bél mikrovillákat normális esetben borító glikokalyx súlyos eróziója figyelhető meg. Ezt általában a kefehatárok elvesztése és a szekréciós IgA-termelés jelentős csökkenése kíséri.
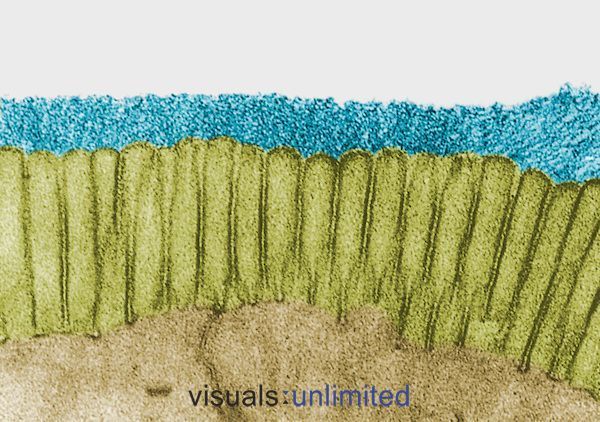 Ezeket a változásokat egyes esetekben maguk az antibiotikumok hatásai okozzák. Más esetekben annak a fertőzésnek a hatását tükrözik, amelyre az antibiotikumokat felírták. Akárhogy is, a hatás ugyanaz: egy olyan mikrokörnyezet kialakítása, amely vendégszerető az opportunista kórokozók, például a Candida számára, de egyre nehezebb a normál komensális baktériumok számára.
Ezeket a változásokat egyes esetekben maguk az antibiotikumok hatásai okozzák. Más esetekben annak a fertőzésnek a hatását tükrözik, amelyre az antibiotikumokat felírták. Akárhogy is, a hatás ugyanaz: egy olyan mikrokörnyezet kialakítása, amely vendégszerető az opportunista kórokozók, például a Candida számára, de egyre nehezebb a normál komensális baktériumok számára.
A gombás fertőzéseket szinte mindig elégtelen IgA-termelés kíséri, mivel a Candida mind a glikokalyxot, mind az sIgA-t üzemanyagként fogyasztja. Ez egy ördögi körré válik: az alacsony IgA Candida-t szül, ami tovább csökkenti az IgA-t. A krónikus húgyúti fertőzések és a nyálkahártya-fertőzések, mint például a szájpenész, az alacsony sIgA-termelésre utalnak, mutatott rá Skilton.
Egészséges glikokalyx nélkül az olyan organizmusoknak, mint a Lactobacillusok és Bifidobacillusok, nagyon nehéz megtelepedniük. Ebben az összefüggésben a közönséges probiotikumokkal való kiegészítés általában kudarcot vall.
“Még ha a világ legjobb probiotikumát ajánljuk is, akkor sincs módjuk megtapadni és kolonizálni, ha a glikokalyx erodálódott” – magyarázta Dr. Skilton. “A probiotikumok adásával valójában eltúlozhatjuk a GI-szimptómákat, ha a glikokalyx termelésének képessége csökken.”
Az egészségesebb mikrokörnyezet helyreállításához ezekben az esetekben ki kell használni a Saccharomyces boulardii, egy antibiotikum-rezisztens, probiotikus élesztőgomba egyedi tulajdonságait, amelyet eredetileg Indokínában a licsi gyümölcséből izoláltak. Bár a S. boulardii nem igazi kommensális organizmus, a glikokalyx termelésének és az IgA szekréciójának erős indukálója. Serkenti továbbá a kefehatár enzimeket, és elősegíti a poliamin termelést, ami táplálja a bél mikrovillákat, és hasznos lehet a fekélyes vastagbélgyulladás, a Crohn-betegség és az irritábilis bél szindróma gyógyításában.
A S. boulardii képes a rendkívül patogén antibiotikum-rezisztens baktériumokkal, például a Clostridium difficile-vel szemben is működni, és ténylegesen megelőző terápiaként alkalmazzák a C. difficile-vel összefüggő hasmenés ellen (Goldstein, E. et al. Clin Infect Dis. 2015; 60 (suppl_2): S148-S158). A S. boulardii csökkentheti az enterotoxin A toxin A-receptor kötődésének gátlásával és az enterotoxin B képződésének megakadályozásával az enterotoxin A néhány toxikus hatását.
A legfigyelemreméltóbb azonban az, hogy képes gyorsan kolonizálni a sérült endothelt és kiszorítani a patogén élesztőgombákat, miközben egyidejűleg egészségesebb mikrokörnyezetet hoz létre a komensális baktériumok számára. “A S. boulardii valójában a Candida fizikai kiürítését kényszeríti ki” – mondta Dr. Skilton, megjegyezve, hogy a 8 leggyakoribb patogén Candida fajból 7 ellen kifejezetten aktív. Az egyetlen kivétel a C. tropicalis.
“Gondoljunk a helyzetre úgy, mint amikor egy hurrikán lecsap egy falura. Az antibiotikumok a hurrikán. A S. boulardii olyan, mint a vállalkozó, aki bejön és kijavítja a faluban keletkezett károkat. Ezután újra benépesíthetjük a falut komenzálisokkal.”
A BioCeuticals, egy ausztrál, kizárólag gyakorló orvosokkal foglalkozó táplálkozástudományi vállalat nemrégiben mutatta be az SB Floractiv nevű terméket, amely kapszulánként 250 mg S. boulardii-t (más néven S. cereviciae) tartalmaz.
Azoknál a betegeknél, akik hosszú ideig antibiotikumot kaptak, lassan kezdjük napi egy kapszulával (250 mg) 3-4 napig, majd növeljük napi kettőre további 3-4 napig, majd hasonlóan fokozatosan növeljük napi négy kapszuláig (1000 mg), amit a fennmaradó 4 hétig kell folytatni.
A S. boulardii nagyon biztonságos, és az egyetlen valódi ellenjavallat az élesztőgombákkal szembeni valódi IgE-mediált reakciókban szenvedő betegeknél van, amelyek anafilaxia vagy  csalánkiütés formájában jelentkeznek. Ennek ellenére fontos tisztában lenni azzal, hogy az S. boulardii szedésének első néhány napján néhány betegnél észrevehető “bélöblítés” tapasztalható, mivel a probiotikus élesztő kiszorítja a Candida fajokat. A Candidák kipusztulásától az emberek rosszul is érezhetik magukat. A legjobb, ha előzetesen tájékoztatjuk a betegeket ezekről a lehetőségekről, hogy ne lepődjenek meg, ha ezek bekövetkeznek.
csalánkiütés formájában jelentkeznek. Ennek ellenére fontos tisztában lenni azzal, hogy az S. boulardii szedésének első néhány napján néhány betegnél észrevehető “bélöblítés” tapasztalható, mivel a probiotikus élesztő kiszorítja a Candida fajokat. A Candidák kipusztulásától az emberek rosszul is érezhetik magukat. A legjobb, ha előzetesen tájékoztatjuk a betegeket ezekről a lehetőségekről, hogy ne lepődjenek meg, ha ezek bekövetkeznek.
Dr. Skelton szerint 10-ből 9 betegnél négy hét intenzív S. boulardii-kiegészítés elegendő az egészséges glikokalyxréteg helyreállításához és a megfelelő IgA-szekréció beindításához. Ez aztán megteremti az alapot egy sokkal hatékonyabb helyreállítási körhöz egy többtörzsű probiotikummal.
A Bioceuticals kifejezetten az antibiotikumok utáni használatra tervezett egy terméket. A BioFloractiv 500 nevű termék 500 milliárd CFU-t, 12 fajt és 14 törzset tartalmaz a hasznos baktériumokból. Dr. Skilton szerint maximum 14 napig ajánlott, bár a legtöbbeknek elegendő az egyhetes napi kezelés Skilton szerint.
Az irritábilis bél szindrómában vagy Crohn-betegségben szenvedő betegeknek azonban hosszabb távú támogatásra lehet szükségük az egészséges mikrobiom újjáépítéséhez az antibiotikumok szedése után.
Egy átfogó megközelítés
A probiotikumok csak egy részét képezik a képnek. És ha egy beteg semmilyen probiotikumot nem tolerál, az egy piros zászló, hogy a beteg immunrendszere nem működik megfelelően.
“Először az idegrendszer minden olyan aspektusával foglalkozni kell, különösen a szimpatikus dominanciával, amely hatással lehet az emésztőrendszerre” – mondta Dr. Skilton. Úgy találta, hogy a halolaj, a cink, az A-vitamin és a kolosztrum sok esetben hasznos lehet. Ez utóbbi “nagyon jó az sIgA helyreállítására. Csinálja ezt körülbelül egy hétig, mielőtt még probiotikumokkal próbálkozna”. A Slippery Elm és a glutamin kiegészítők szintén hasznosak lehetnek bizonyos esetekben.
A növényi alapú gyógyszerek, mint az oregánóolaj, a teafaolaj vagy a pau d’arco kivonat segíthetnek megszabadítani a GI traktust a kórokozó élesztőgombáktól. Dr. Skilton azonban hangsúlyozta, hogy ezek semmit sem tesznek az sIgA-termelés serkentéséért, és a krónikus élesztőgomba-fertőzések szinte mindig alacsony IgA-val járnak együtt. Ezeket a természetes élesztőirtókat soha nem szabad a S. boulardii-val egyidejűleg használni; ez a “barátságos” élesztő ugyanolyan érzékeny az olyan dolgokra, mint az oregánó és a teafa, mint a patogén élesztők.
Egy sor probiotikus és prebiotikus élelmiszer segítheti a bélrendszer helyreállításának folyamatát. Tom O’Bryan, DC, a Gluten Summit és a Certified Gluten Practitioner képzési program alapítója számos olyan ételt ajánl, amelyet érdemes fogyasztani – és néhányat, amelyet érdemes kerülni -, amikor a bélrendszer antibiotikumos kezelés utáni helyreállításáról van szó.
“Ha a bélrendszerünk károsodott, nem akarjuk megterhelni a bélrendszerünket” – mondja O’Bryan. Az “adóztató” élelmiszerek közé tartozik a búza, a tejtermékek, a cukor, az egészségtelen zsírok és a sült ételek. Ezek az ételek – jegyzi meg – “benzint öntenek a helyreálló bélrendszer tűzére”.
Másrészt viszont sok olyan ételt kell fogyasztani, amelyek elősegítik az egészséges komensális organizmusok növekedését. O’Bryan a bio párolt almát ajánlja, amelyet puhára és csillogóvá főzünk, mint egy jó lehetőséget. Az alma főzése, magyarázza, pektint szabadít fel – egy oldható rostot, amely üzemanyagot biztosít a hasznos baktériumok számára.
A párolt almában található pektin segíthet a sérült bélbélés gyógyításában és a lyukas bélszakadások lezárásában is, megakadályozva a nagyméretű ételmolekulák átcsúszását.
Hasonlóan a kollagén is segít lezárni a lyukas bélszakaszt. O’Bryan arra is bátorítja az antibiotikum-kezelésből lábadozó betegeket, hogy egyenek csirkecsontlevest, amely jó kollagénforrás, és amely természetes prebiotikumként is működik, táplálva a bélben lévő egészséges baktériumokat.
A butirát – egy természetes anyag, amely a bélben termelődik – egy másik fontos szereplője a bélbaktériumok helyreállításának. O’Bryan elmagyarázza, hogy a bél belsejét bélelő sejtek gyorsan szaporodnak, és a butirát táplálja az új sejtek újjáépítését. Az elégtelen butiráttermelés és a bélsejtek lassú cserélődése sebezhetőbbé teszi a szervezetet a rákos sejtek kialakulásával szemben, ami a vastagbélrák nagyobb kockázatát eredményezi.
A prebiotikus gyümölcsök és zöldségek, köztük az ételek közül a banán, az édesburgonya és más gumósok segítenek a bélmikrobiom újjáépítésében, mivel oldhatatlan rostokat biztosítanak, amelyek a jó – de nem káros – baktériumokat táplálják.
A természetes probiotikumok másik kiváló forrása a fermentált, pasztőrözetlen zöldségek, mint a savanyú káposzta, a kimchi és az erjesztett cékla. Minden zöldség az erjesztés során a jótékony baktériumok különböző családjait termeli, jegyzi meg O’Bryan, aki arra biztatja a betegeket, hogy naponta kétszer egy villányi erjesztett zöldséget fogyasszanak. “A bélrendszer egészségének kulcsa a mikrobiom sokfélesége” – érvel, rámutatva, hogy a bélrendszerben több ezer különböző baktériumcsalád él és játszik egymással, amelyek széleskörű hatással vannak az egészségünkre.
END