Gli antibiotici eliminano le infezioni patogene e salvano la vita – ma così facendo, distruggono anche l’integrità del microbioma intestinale. Mentre molti medici riconoscono la necessità di ripristinare l’equilibrio microbico di un paziente dopo un ciclo di terapia antibiotica, molti meno capiscono come farlo efficacemente.
Secondo Amie Skilton, ND, il ripristino della flora intestinale è sia arte che scienza. Fatto bene, può fare un mondo di differenza per i pazienti. In alcuni casi, può anche aiutare i pazienti a superare le malattie per le quali gli antibiotici sono stati inizialmente prescritti.
Ma ci vuole più di raccomandare un probiotico off-the-shelf e sperare per il meglio.
I centri per il controllo delle malattie hanno riferito la scorsa primavera che dei 154 milioni di prescrizioni di antibiotici scritti negli uffici del medico e reparti di emergenza ogni anno, 30 per cento sono inutili. La maggior parte delle prescrizioni superflue, il CDC ha trovato, sono state distribuite per condizioni respiratorie causate da virus come raffreddori comuni, mal di gola virale, bronchite e infezioni del seno e dell’orecchio, che non rispondono agli antibiotici. L’uso di questi farmaci “mette i pazienti a rischio inutile di reazioni allergiche o la diarrea a volte mortale, Clostridium difficile.”
A complicare ulteriormente il quadro è la realtà che gli antibiotici non sono solo dispersi dagli studi medici; sono anche alimentati liberamente al bestiame e spruzzati ampiamente sui prodotti, lasciando tracce minime ma biologicamente attive negli alimenti che gli esseri umani poi consumano.
Dose, tempi determinano l’impatto
Come gli antibiotici uccidono i microrganismi che causano infezioni, distruggono anche non selettivamente le comunità di batteri intestinali benefici, indebolendo la stabilità del microbioma intestinale. Questa distruzione all’ingrosso può essere massiccia; i dati sperimentali raccolti da uno studio con qPCR indicano una riduzione fino a 10 volte degli isolati batterici subito dopo il trattamento con antibiotici (Panda, S. et al. PLoS One. 2014; 9(4): e95476).
“È veramente un effetto decimante”, dice il dottor Skilton, un medico naturopata ed erborista presso la Elysium Clinic of Natural Medicine, Sydney, NSW, Australia.
In un webinar sponsorizzato da Holistic Primary Care e Bioceuticals, ha delineato la miriade di impatti degli antibiotici sul microbioma umano, notando che non tutti gli antibiotici sono ugualmente distruttivi per i batteri intestinali.
Il grado in cui questi farmaci danneggiano il microbiota intestinale dipende dal tipo di farmaco, dalla durata del trattamento e dalla frequenza di utilizzo, ha detto Skilton. Alcuni antibiotici, per esempio, innescano un maggiore rilascio di endotossine e citochine rispetto ad altri. Dosi giornaliere più elevate hanno un impatto maggiore. L’uso prolungato di antibiotici ad alte dosi può causare danni estremi al microbioma che può richiedere anni di terapia riparativa per invertire, se può essere invertito a tutti.
E contrariamente alla credenza comune, gli antibiotici endovenosi possono avere lo stesso impatto negativo sulla flora intestinale come farmaci orali. “Per molto tempo si è pensato che i farmaci per via endovenosa avrebbero bypassato l’intestino e non avrebbero avuto lo stesso impatto. Ora sappiamo che questo non è vero.”
Anche il momento della somministrazione degli antibiotici fa la differenza. Gli individui che utilizzano frequentemente gli antibiotici all’inizio della vita sono più vulnerabili a molti tipi di malattie quando invecchiano. In un documento pubblicato all’inizio di quest’anno, i ricercatori hanno dimostrato un’associazione tra uso di antibiotici durante l’infanzia e successivi risultati neurocognitivi poveri, suggerendo che il consumo di antibiotici nel primo anno di vita di un paziente era associato a piccole ma statisticamente significative differenze nelle misure cognitive, comportamentali e dell’umore durante l’infanzia (Slykerman, R. et al. Acta Paediatr. 2017; 106(1): 87-94).
Altri hanno collegato l’esposizione agli antibiotici del feto e della prima infanzia al successivo sviluppo di asma più tardi nella vita (Örtqvist, A. et al. Brit Med J. 2014; 349. doi: https://doi.org/10.1136/bmj.g6979). Gli antibiotici sono stati anche associati con l’obesità e l’aumento di peso nei bambini così come gli adulti (Milione, M. et al. Clin Microbiol & Infec. 2013; 19(4): 305-313). I ricercatori attribuiscono questi cambiamenti alla composizione microbica intestinale alterata.
Antibiotici possono innescare il rilascio di lipopolisaccaridi tossici (LPS), grandi molecole trovate nelle membrane esterne dei batteri Gram-negativi patogeni. Alcuni suggeriscono che il rilascio di LPS indotto dagli antibiotici può contribuire allo sviluppo di shock settico in pazienti trattati per gravi infezioni causate da batteri Gram-negativi. Altri hanno dimostrato che LPS innesca una risposta immunitaria rilasciando citochine infiammatorie, un problema che peggiora dopo il trattamento antibiotico, ha notato Skilton nel suo webinar (Wu, T. et al. Toxicol Lett. 2009; 191(2-3): 195-202).
Dal punto di vista di un patogeno, la produzione di LPS è una strategia di sopravvivenza. Queste molecole interagiscono sulle superfici cellulari per formare una barriera, impedendo agli antibiotici e ad altri composti idrofobici di entrare e permettendo ai batteri Gram-negativi di vivere anche in ambienti difficili (Zhang, G. et al. Curr Opin Microbiol. 2013; 16(6): 779-785).
Come ripristinare la flora
I probiotici sono un aspetto di una strategia globale per ripristinare la flora intestinale dopo l’uso di antibiotici. Data la diversità microbica di un ecosistema intestinale sano, Skilton raccomanda di utilizzare prodotti che contengono molte specie diverse di microbi benefici piuttosto che “monocoltivare” con uno o due ceppi singoli.
Come regola generale, consiglia un mese di trattamento probiotico per ogni settimana in cui un paziente era sotto antibiotici. Coloro che sono stati su regimi antibiotici continui e prolungati, avranno anche bisogno di un ripristino a lungo termine. Ha sottolineato che per la maggior parte delle persone, non ci sono rischi per la salute associati a un’integrazione probiotica estesa.
I pazienti che ricevono antibiotici per via endovenosa dovrebbero anche assumere probiotici commensali. Alcuni medici che sono consapevoli di questo problema inizieranno i probiotici già quattro ore dopo una dose di antibiotici per via endovenosa.
Ricostruire il glicocalice
Le persone che sono state a lungo o più cicli di antibiotici in genere mostrano una grave erosione del glicocalice che normalmente riveste i microvilli intestinali. Questo è di solito accompagnato da una perdita di bordi a spazzola e una marcata riduzione della produzione di IgA secretorie.
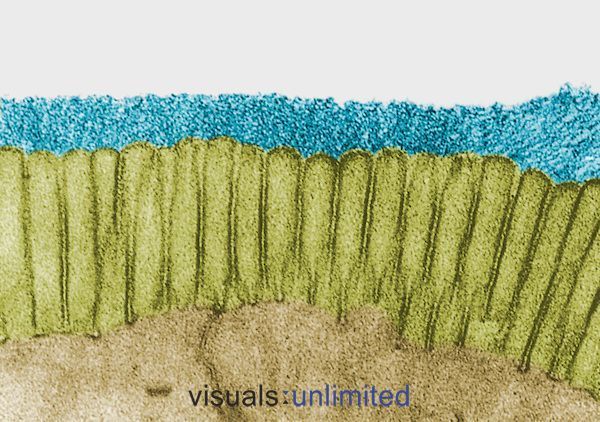 In alcuni casi, questi cambiamenti sono causati dagli effetti degli antibiotici stessi. In altri, riflettono l’impatto dell’infezione per la quale gli antibiotici sono stati prescritti. In entrambi i casi, l’effetto è lo stesso: la creazione di un microambiente che è ospitale per i patogeni opportunisti come la Candida, ma sempre più difficile per i normali batteri commensali.
In alcuni casi, questi cambiamenti sono causati dagli effetti degli antibiotici stessi. In altri, riflettono l’impatto dell’infezione per la quale gli antibiotici sono stati prescritti. In entrambi i casi, l’effetto è lo stesso: la creazione di un microambiente che è ospitale per i patogeni opportunisti come la Candida, ma sempre più difficile per i normali batteri commensali.
Le infezioni fungine sono quasi sempre accompagnate da una produzione insufficiente di IgA, poiché la Candida consuma sia il glicocalice che la sIgA come combustibile. Diventa un circolo vizioso: un basso livello di IgA genera la Candida che impoverisce ulteriormente le IgA. Le infezioni croniche del tratto urinario e le infezioni delle mucose come il mughetto sono bandiere rosse per una bassa produzione di sIgA, ha sottolineato Skilton.
Senza un glicocalice sano, organismi come i lattobacilli e i bifidobacilli hanno grandi difficoltà a stabilirsi. In questo contesto, l’integrazione con probiotici ordinari di solito fallisce.
“Anche se si raccomandano i migliori probiotici del mondo, non c’è modo per loro di attaccare e colonizzare se il glicocalice è eroso”, ha spiegato il dottor Skilton. “Si può effettivamente esagerare i sintomi GI dando probiotici, se c’è la perdita di capacità di produrre glicocalice.”
Per ripristinare un microambiente più sano in questi casi, è necessario sfruttare le caratteristiche uniche di Saccharomyces boulardii, un antibiotico-resistente, lievito probiotico originariamente isolato da frutta litchi in Indocina. Anche se non è un vero organismo commensale, S. boulardii è un potente induttore della produzione di glicocalice e della secrezione di IgA. Stimola anche gli enzimi del bordo delle spazzole e promuove la produzione di poliammina, che alimenta i microvilli intestinali e può essere utile per la guarigione della colite ulcerosa, del morbo di Crohn e della sindrome dell’intestino irritabile.
S. boulardii è in grado di lavorare nel contesto di batteri altamente patogeni resistenti agli antibiotici come Clostridium difficile ed è stato effettivamente utilizzato come terapia preventiva contro la diarrea associata a C. difficile (Goldstein, E. et al. Clin Infect Dis. 2015; 60 (suppl_2): S148-S158). S. boulardii può ridurre alcuni degli effetti tossici dell’enterotossina A inibendo il legame con il recettore della tossina A e prevenendo la formazione dell’enterotossina B.
Ma la cosa più notevole è la sua capacità di colonizzare rapidamente l’endotelio danneggiato e spostare i lieviti patogeni mentre contemporaneamente crea un microambiente più sano per i batteri commensali. “S. boulardii forza effettivamente un’evacuazione fisica della Candida”, ha detto il Dr. Skilton notando che è specificamente attivo contro 7 delle 8 specie patogene più comuni di Candida. L’unica eccezione è C. tropicalis.
“Pensate alla situazione come alle conseguenze di un uragano che colpisce un villaggio. Gli antibiotici sono l’uragano. S. boulardii è come l’appaltatore che arriva e ripara i danni al villaggio. È quindi possibile ripopolare il villaggio con commensali.”
BioCeuticals, un’azienda australiana di nutraceutica per soli professionisti, ha recentemente introdotto un prodotto chiamato SB Floractiv, fornendo 250 mg di S. boulardii (chiamato anche S. cereviciae) per capsula.
Per i pazienti che sono stati sotto antibiotici a lungo termine, iniziare lentamente con una capsula (250 mg) al giorno per 3-4 giorni, poi aumentare a due al giorno per altri 3-4 giorni, e poi aumentare in un simile schema graduale fino a quattro al giorno (1000 mg) che dovrebbe essere continuato per il resto di un periodo di 4 settimane.
S. boulardii è molto sicuro, e l’unica vera controindicazione è nei pazienti con vere reazioni IgE-mediate ai lieviti, che si manifestano come anafilassi o  orci. Detto questo, è importante essere consapevoli che nei primi giorni di assunzione di S. boulardii, alcuni pazienti possono sperimentare un notevole “lavaggio intestinale” come il lievito probiotico sposta le specie di Candida. La morte della Candida può anche far sentire le persone malate. È meglio avvisare i pazienti di queste possibilità in anticipo, in modo che non siano sorpresi se si verificano.
orci. Detto questo, è importante essere consapevoli che nei primi giorni di assunzione di S. boulardii, alcuni pazienti possono sperimentare un notevole “lavaggio intestinale” come il lievito probiotico sposta le specie di Candida. La morte della Candida può anche far sentire le persone malate. È meglio avvisare i pazienti di queste possibilità in anticipo, in modo che non siano sorpresi se si verificano.
Secondo il dottor Skelton, in 9 pazienti su 10, quattro settimane di integrazione intensiva di S. boulardii sono sufficienti per ripristinare uno strato di glicocalice sano e indurre un’adeguata secrezione di IgA. Questo poi pone le basi per un ciclo molto più efficace di ripristino con un probiotico multi-ceppo.
Bioceuticals ha progettato un prodotto specifico per l’uso dopo gli antibiotici. Chiamato BioFloractiv 500, contiene 500 miliardi di CFU, 12 specie e 14 ceppi di batteri benefici. Il Dr. Skilton raccomanda un massimo di 14 giorni, anche se una settimana di terapia giornaliera è sufficiente per la maggior parte, secondo Skilton.
I pazienti con sindrome dell’intestino irritabile o malattia di Crohn, tuttavia, possono avere bisogno di un supporto più a lungo termine per ricostruire un microbioma sano dopo l’assunzione di antibiotici.
Un approccio completo
I probiotici sono solo una parte del quadro. E se un paziente non può tollerare qualsiasi tipo di probiotico, è una bandiera rossa che il sistema immunitario del paziente non funziona correttamente.
“È necessario prima affrontare qualsiasi aspetto del sistema nervoso, soprattutto la dominanza simpatica, che può influenzare il tratto digestivo”, ha detto il dottor Skilton. Ha trovato che l’olio di pesce, lo zinco, la vitamina A e il colostro sono utili in molti casi. Quest’ultimo “è veramente buono per ripristinare la sIgA. Fatelo per una settimana o giù di lì prima di provare i probiotici”. L’olmo scivoloso e gli integratori di glutammina possono anche essere utili in alcuni casi.
I farmaci a base di piante come l’olio di origano, l’olio dell’albero del tè o l’estratto di pau d’arco possono essere utili per liberare il tratto GI dal lievito patogeno. Ma il Dr. Skilton ha sottolineato che questi non faranno nulla per stimolare la produzione di sIgA, e le infezioni croniche da lievito sono quasi sempre associate a basse IgA. Questi lieviti naturali non dovrebbero mai essere usati insieme a S. boulardii; questo lievito “amico” è vulnerabile a cose come l’origano e l’albero del tè tanto quanto i lieviti patogeni.
Un certo numero di alimenti probiotici e prebiotici può aiutare il processo di ripristino dell’intestino. Tom O’Bryan, DC, fondatore del Gluten Summit e del programma di formazione Certified Gluten Practitioner, raccomanda diversi cibi da mangiare – e diversi da evitare – quando si ricostruisce l’intestino dopo un trattamento antibiotico.
“Quando l’intestino è stato compromesso, non si vuole tassare il tuo intestino”, dice O’Bryan. Gli alimenti “tassanti” includono grano, latticini, zucchero, grassi malsani e fritti. Questi alimenti, nota, “gettano benzina sul fuoco” di un sistema intestinale in fase di recupero.
D’altra parte, si dovrebbe mangiare un sacco di alimenti che promuovono la crescita di organismi commensali sani. O’Bryan raccomanda le mele biologiche stufate, cotte fino a quando sono morbide e lucenti, come una buona opzione. La cottura delle mele, spiega, rilascia pectina – una fibra solubile che fornisce carburante per i batteri benefici.
La pectina presente nelle mele stufate può anche aiutare a guarire un rivestimento intestinale danneggiato e sigillare le lacerazioni in un intestino che perde, impedendo alle grandi molecole di cibo di scivolare attraverso.
Similmente, il collagene aiuta a sigillare un intestino che perde. O’Bryan incoraggia anche i pazienti che si stanno riprendendo dal trattamento antibiotico a mangiare brodo di ossa di pollo, una buona fonte di collagene, che agisce anche come un prebiotico naturale, alimentando i batteri sani nell’intestino.
Il butirrato – una sostanza naturale prodotta nell’intestino – è un altro giocatore importante nel ripristino dei batteri intestinali. O’Bryan spiega che le cellule che rivestono l’interno dell’intestino si riproducono rapidamente e che il butirrato alimenta la ricostruzione di nuove cellule. Una produzione insufficiente di butirrato e un ricambio lento delle cellule intestinali rendono il corpo più vulnerabile allo sviluppo di cellule tumorali, con un conseguente aumento del rischio di cancro al colon.
Una serie di frutta e verdura prebiotiche, tra cui banane, patate dolci e altri tuberi aiutano a ricostruire il microbioma intestinale, fornendo fibra insolubile che alimenta i batteri buoni – ma non quelli nocivi.
Verdura fermentata e non pastorizzata come crauti, kimchi e barbabietole fermentate, sono un’altra eccellente fonte di probiotici naturali. Ogni verdura produce diverse famiglie di batteri benefici durante la fermentazione, nota O’Bryan, incoraggiando i pazienti a mangiare una forchettata di verdure fermentate due volte al giorno. “La chiave per la salute del vostro intestino è la diversità del vostro microbioma”, sostiene, sottolineando che migliaia di diverse famiglie di batteri vivono e interagiscono nell’intestino con un ampio impatto sulla nostra salute.
FINE