Az epesók és az epesavak poláris koleszterinszármazékok, és a szteroid szervezetből való kiürülésének fő útvonalát jelentik.
Hasonló, de nem azonos szerkezetű, változatos fizikai és biológiai tulajdonságokkal rendelkező molekulák.
A májban szintetizálódnak, az epehólyagban tárolódnak, a nyombélbe szekretálódnak, és végül nagyrészt az ileumban visszaszívódnak.
Mivel fiziológiás pH-n ezek a molekulák anionként vannak jelen, az epesav és az epesók kifejezéseket itt szinonimaként használjuk.
Összetevők
- Az epesók kémiai szerkezete
- Prim, konjugált és másodlagos epesók
- Az epesavak funkciója
- Az epesók enterohepatikus keringése
- Az epesavak bélrendszeri anyagcseréje
- Az oldható rostok és a reabszorpció. az epesók
- Az elsődleges epesavak szintézise
- A klasszikus vagy semleges útvonal
- Az alternatív vagy savas útvonal
- Kisebb útvonalak
- Epe sók:
- Az epesók kémiai szerkezete
- Primer, konjugált és másodlagos epesók
- Az epesavak funkciója
- Az epesók enterohepatikus keringése
- Az epesavak bélrendszeri metabolizmusa
- Az oldható rostok és az epesók reabszorpciója
- A primer epesavak szintézise
- A klasszikus vagy semleges útvonal
- Az alternatív vagy savas útvonal
- Kisebb útvonalak
- Epe sók: a szintézis szabályozása
Az epesók kémiai szerkezete
Az epesók hasonlóságok és különbségek a koleszterin molekulával.
A szteroidhoz hasonlóan négy fuzionált gyűrűből álló magjuk van: három ciklohexángyűrű, amelyeket A, B és C jelöli, és egy ciklopentángyűrű, amelyet D jelöli. Ez a szerkezet a perhidrociklopentánfenantrén, közismertebb nevén a szteroidmag.
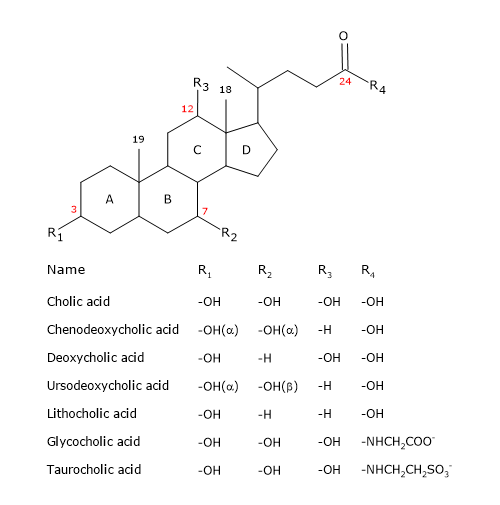
A magasabb gerincesekben 24 szénatomot tartalmaznak, mivel az oldallánc három szénatommal rövidebb, mint az eredeti. Az alacsonyabb rendű gerincesekben az epesavaknak 25, 26 vagy 27 szénatomjuk van. Az oldallánc egy 7-es pH-n ionizált karboxilcsoporttal végződik, amely a glicin vagy a taurin aminosavhoz kapcsolódhat (lásd alább).
A 3. pozícióban lévő hidroxilcsoport mellett a 7. és/vagy 12. pozícióban hidroxilcsoportjuk van.
Mindezek miatt sokkal polárisabbak, mint a koleszterin.
Mivel az A- és B-gyűrűk cisz-konfigurációban fuzionálnak, a szteroidmag síkbeli szerkezete görbült, és azonosítható:
- egy homorú oldal, amely hidrofil, mert az oldallánc hidroxilcsoportjai és karboxilcsoportja – a kapcsolódó aminosavval vagy anélkül – felé orientálódnak;
- egy domború oldal, amely hidrofób, mert a 18. és 19. pozícióban lévő metilcsoportok felé orientálódnak.
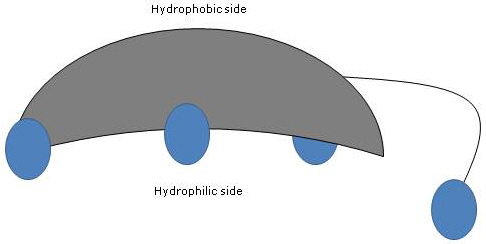
Ezért, mivel poláris és nem poláris csoportokkal egyaránt rendelkeznek, amfifil molekulák és kiváló felületaktív anyagok. Kémiai szerkezetük azonban sok más felületaktív anyagtól eltérővé teszi őket, gyakran egy poláros fejrészből és egy nem poláros farokból állnak.
Primer, konjugált és másodlagos epesók
A primer epesavak azok, amelyek közvetlenül a koleszterinből szintetizálódnak a hepatocitákban. Az emberben a legfontosabbak a kolinsav és a fenodeoxikolsav, amelyek az összes epesav 80%-át teszik ki. Mielőtt kiválasztódnának az epeutakba, szinte teljesen, akár 98%-ban konjugálódnak a glicinnel vagy a taurinnal, glikokonjugátumokat, illetve taurokonjugátumokat alkotva. Különösen a cholsav és a chenodeoxycholsav körülbelül 75%-a konjugálódik glicinnel, hogy glikocholsav és glikochenodeoxycholsav, a fennmaradó 25% pedig taurinnal, hogy taurocholsav és taurochenodeoxycholsav képződjön.
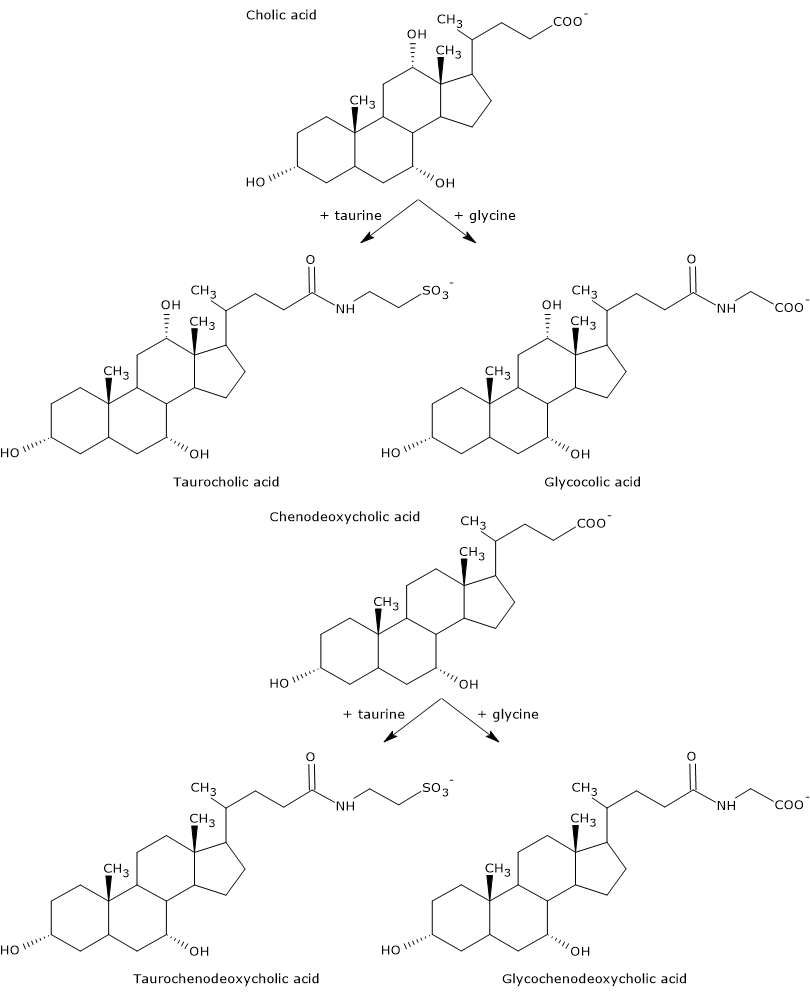
A konjugált epesavak több hidrofil csoporttal rendelkező molekulák, mint a nem konjugált epesavak, ezért fokozott emulgeáló képességgel rendelkeznek. A konjugálás valójában csökkenti az epesavak pKa értékét, a nem konjugált molekulákra jellemző 6-os értékről a glikokolsav esetében körülbelül 4-re, a taurokolsav esetében pedig körülbelül 2-re. Ezáltal a konjugált epesavak szélesebb pH-tartományban ionizálódnak a megfelelő sók képződéséhez.
A közös savak és epesók hidrofilitása a következő sorrendben csökken: glicin-konjugált < taurin-konjugált < litokolsav < deoxikolsav < kénodeoxikolsav < kénodeoxikolsav < kénsav <ursodeoxikolsav.
Végül a konjugálás csökkenti az elsődleges epesavak citotoxicitását is.
A másodlagos epesavak a vékonybélből vissza nem szívódott elsődleges epesavakból képződnek. A vastagbélbe jutva a bélmikrobióta által számos módosításon mehetnek keresztül, hogy másodlagos epesavakat képezzenek (lásd alább). Ezek alkotják a szervezet epesavkészletének fennmaradó 20%-át.
Az epesavak kategorizálásának másik módja a glicinnel és taurinnal való konjugációjuk és a hidroxilációjuk mértéke alapján történik. Ez alapján három kategóriát különböztetünk meg.
- Trihidroxi konjugáltak, mint például a taurokolsav és a glikokolsav.
- Dihidroxi konjugáltak, mint például a glikodeoxikolsav, glikochenodeoxikolsav, taurochenodeoxikolsav és taurodeoxikolsav. Ezek teszik ki az epében lévő epesók mintegy 60%-át.
- Konjugálatlan formák, mint például a kólsav, dezoxikólsav, kénodeoxikólsav és litokólsav.
Az epesavak funkciója
Minden élettani funkciójukat a konjugált formában látják el.
- Az emberi szervezetből a koleszterin kiválasztásának fő útvonala.
Az ember ugyanis nem rendelkezik a szteroidmag ciklohexángyűrűinek vagy ciklopentángyűrűjének felbontására, illetve a koleszterin CO2-vé és vízzé oxidálására alkalmas enzimekkel.
A szteroid szervezetből való eltávolításának másik mechanizmusa a koleszterin önmagában, az epével történő kiválasztása. - Az epesók erős felületaktív anyagok. És különösen a di- és trihidroxi konjugáltak a legjobb felületaktív anyagok az epesavak közül, sokkal hatékonyabbak, mint a konjugálatlan társaik, mivel több poláris csoportjuk van.
A vékonybél lumenében az apoláris lipidekkel érintkezve a domború apoláris felület kölcsönhatásba lép az apoláris lipidekkel, például a trigliceridekkel, koleszterinészterekkel és a zsírban oldódó vitaminok észtereivel, míg a homorú poláris felület a környező vizes közeggel. Ez növeli az apoláris lipidek diszperzióját a vizes közegben, mivel lehetővé teszi apró lipidcseppek kialakulását, növelve a felületet:
lipáz aktivitás, elsősorban a hasnyálmirigy lipáz, (az epesók is közvetlen szerepet játszanak ennek az enzimnek az aktiválásában);
bél-észteráz aktivitás.
Ezek következtében elősegítik a lipidemésztési termékek, valamint a zsírban oldódó vitaminok felszívódását a bélnyálkahártya által a vegyes micellák képződésének köszönhetően.
Az epesavak hasonló funkciót töltenek be az epehólyagban, ahol a foszfolipidekkel vegyes micellákat alkotva megakadályozzák a koleszterin kicsapódását.
Megjegyzés: A poláris és nem poláris csoportok elrendeződésének következményeként az epesavak vizes oldatban micellákat képeznek, amelyek általában 10-nél kevesebb monomerből állnak, amennyiben koncentrációjuk az úgynevezett kritikus micellás koncentráció vagy CMC felett van.
- Bélrendszeri szinten modulálják a hasnyálmirigy enzimek és a kolecisztokinin szekrécióját.
- A vékony- és vastagbélben erős antimikrobiális hatásuk van, elsősorban a dezoxikolsavnak, különösen a Gram-pozitív baktériumokkal szemben. Ez az aktivitás az oxidatív DNS-károsodásnak és/vagy a sejtmembrán károsodásának köszönhető. Ezért fontos szerepet játszanak a baktériumok túlszaporodásának megelőzésében, de a bél mikrobióta összetételének szabályozásában is.
- Az utóbbi években nyilvánvalóvá vált szabályozó szerepük az energiaanyagcsere szabályozásában, különösen a máj glükózkezelésében.
Az epesók enterohepatikus keringése
A zsírbevitel után a duodenum enteroendokrin sejtjei kolecisztokinint választanak ki a véráramba. A hormon az epehólyag simaizomsejtjeinek receptoraihoz kötődve elősegíti azok összehúzódását; a hormon az Oddi-sphincter relaxációját is okozza. Mindez az epe, és így az epesavak kiválasztását eredményezi a nyombélbe.
Fiziológiás körülmények között az emberi epesó pool állandó, és körülbelül 3-5 g-nak felel meg. Ezt két folyamat teszi lehetővé:
- a bélrendszeri reabszorpciójuk;
- a de novo szintézisük (lásd alább).
A szekretált epesók akár 95%-a is visszaszívódik a bélből, de nem a lipidemésztés termékeivel együtt, hanem egy enterohepatikus keringésnek nevezett folyamat révén.
Ez egy rendkívül hatékony újrahasznosító rendszer, amely úgy tűnik, hogy minden étkezésnél legalább kétszer történik, és magában foglalja a májat, az epeutakat, a vékonybelet, a vastagbelet és a portális keringést, amelyen keresztül a visszaszívott molekulák visszatérnek a májba. Erre a recirkulációra azért van szükség, mert a máj kapacitása az epesavak szintézisére korlátozott és nem elegendő a bél szükségleteinek kielégítésére, ha az epesók nagy mennyiségben ürülnének a széklettel.
A legtöbb epesót a disztális ileumba, a vékonybél alsó részébe egy nátriumfüggő transzporter, az enterociták kefeszegélyében található nátriumfüggő epesav transzporter vagy ASBT, amely egy epesavmolekula és két nátriumion együttes szállítását végzi, visszaszívja.
Az enterocitán belül úgy gondolják, hogy az epesavakat a citoszolon keresztül az ileális epesavkötő fehérje vagy IBABP szállítja a bazolaterális membránhoz. A bazolaterális membránon a szerves oldott anyag transzporter alfa-béta vagy OSTα/OSTβ segítségével haladnak át, a portális keringésbe jutnak, és albuminhoz kötődve elérik a májat.
Meg kell jegyezni, hogy az epesavak kis százaléka a májartérián keresztül jut a májba.
A máj szintjén a kivonásuk nagyon hatékony, az első áthaladási extrakciós frakció 50 és 90% között mozog, ez a százalékos arány az epesav szerkezetétől függ. A konjugált epesavak felvételét főként egy Na+-függő aktív transzportrendszer, azaz a nátriumfüggő taurokolát-kotranszportáló polipeptid vagy NTCP közvetíti. Előfordulhat azonban nátrium-független felvétel is, amelyet a szerves aniont szállító polipeptidek vagy OATP családjába tartozó fehérjék, elsősorban az OATP1B1 és az OATP1B3 végeznek.
A sebességkorlátozó lépés az enterohepatikus keringésben a csatornaszekréciójuk, amelyet nagyrészt az epesó-export pumpa vagy BSEP közvetít, egy ATP-függő folyamat során. Ez a pumpa szállítja a monoanionos epesókat, amelyek a legnagyobb mennyiségben fordulnak elő. A glükuronsavval vagy szulfáttal konjugált epesavakat, amelyek dianionosok, különböző hordozók, például az MRP2 és a BCRP szállítja.
Megjegyzés: Az epesavak szérumszintje a reabszorpciójuk sebessége alapján változik, ezért étkezéskor magasabb, amikor az enterohepatikus keringés aktívabb.
Az epesavak bélrendszeri metabolizmusa
A bélrendszeri felszívódást megúszó epesavak a vastagbélbe jutnak, ahol részben a bél mikrobióta által átalakulnak és másodlagos epesavakká alakulnak át.
A főbb reakciókat az alábbiakban soroljuk fel:
- Dekonjugáció
Az oldalláncon a C24 N-acil amidkötés hidrolízise történhet, melynek során nem konjugált epesavak és glicin vagy taurin szabadul fel. Ezt a reakciót a vékonybélben és a vastagbélben egyaránt jelen lévő bakteriális hidrolázok katalizálják. - 7α-dehidroxiláció
Kvantitatíve ez a legfontosabb reakció, amelyet a vastagbél bakteriális dehidratázai végeznek, amelyek eltávolítják a hidroxilcsoportot a 7-es pozícióban, így 7-deoxi epesavak keletkeznek. Különösen a dezoxikólsav keletkezik a kolinsavból, és a litokólsav, egy toxikus másodlagos epesav, a kenodeoxikólsavból.
Meg kell jegyezni, hogy a 7α-dehidroxiláció, ellentétben az oxidációval és az epimerizációval (lásd alább), csak nem konjugált epesavakon mehet végbe, ezért a dekonjugáció elengedhetetlen előfeltétel. - Oxidáció és epimerizáció
A 3., 7. és 12. pozícióban lévő hidroxilcsoportokat érintő reakciók, amelyeket bakteriális hidroxiszteroid-dehidrogenázok katalizálnak. Például az ursodeoxikolsav a kénodeoxikolsav epimerizációjából származik.
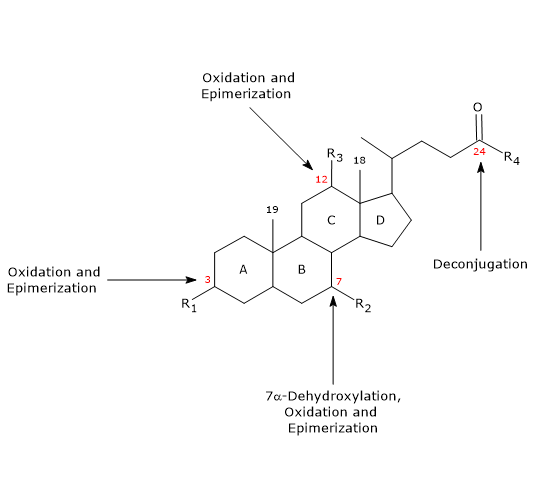
A másodlagos epesavak egy része ezután visszaszívódik a vastagbélből, és visszatér a májba. A hepatocitákban szükség esetén újrakonjugálódnak, és újra kiválasztódnak. Azok, amelyek nem szívódnak fel újra, a széklettel ürülnek ki.
Míg az oxidációkat és dekonjugációkat az anaerob baktériumok széles spektruma végzi, a 7α-dehidroxilációt a vastagbél anaerobjainak korlátozott száma végzi.
A 7α-dehidroxilációk és a dekonjugációk növelik az epesavak pKa értékét, és ezáltal hidrofobicitásukat, ami bizonyos fokú passzív felszívódást tesz lehetővé a vastagbél falán keresztül.
A hidrofobicitás növekedése e molekulák fokozott toxicitásával is együtt jár. A másodlagos epesavak magas koncentrációját az epében, a vérben és a székletben pedig összefüggésbe hozták a vastagbélrák patogenezisével.
Az oldható rostok és az epesók reabszorpciója
Az epesók reabszorpcióját csökkentheti az oldható rostok kelátképző hatása, például a friss gyümölcsökben, hüvelyesekben, zabban és zabkorpában találhatóaké, amelyek megkötik őket, csökkentve a felvételüket. Ez viszont növeli az epesav de novo szintézisét, felszabályozza a 7α-hidroxiláz és a szterol 12α-hidroxiláz expresszióját (lásd alább), és ezáltal csökkenti a hepatocita koleszterinkoncentrációt.
A májkoleszterin kimerülése növeli az LDL-receptor expresszióját, és így csökkenti az LDL-koleszterin plazmakoncentrációját. Másrészt serkenti a HMG-CoA reduktáz, a koleszterin bioszintézisében kulcsfontosságú enzim szintézisét is.
Figyelem: Egyes koleszterincsökkentő gyógyszerek úgy hatnak, hogy a bélben megkötik az epesavakat, ezáltal megakadályozzák azok visszaszívódását.
A primer epesavak szintézise
Kvantitatíve az epesavak a koleszterin-anyagcsere fő termékei.
Mint korábban említettük, az enterohepatikus keringés és de novo szintézisük állandóan fenntartja az epesav-pool méretét. Különösen a de novo szintézis teszi lehetővé az arccal ürülő epesavak pótlását, a szervezet pooljának kb. 5-10%-át, azaz ~ 0,5 g/nap.
A következőkben a kolinsav és a fenodeoxikolsav szintézisét, valamint a taurin és glicin aminosavakkal való konjugációjukat ismertetjük.
Az epesavszintézisnek két fő útja van: a klasszikus út és az alternatív út. Ezen kívül néhány más kisebb útvonalat is ismertetünk.
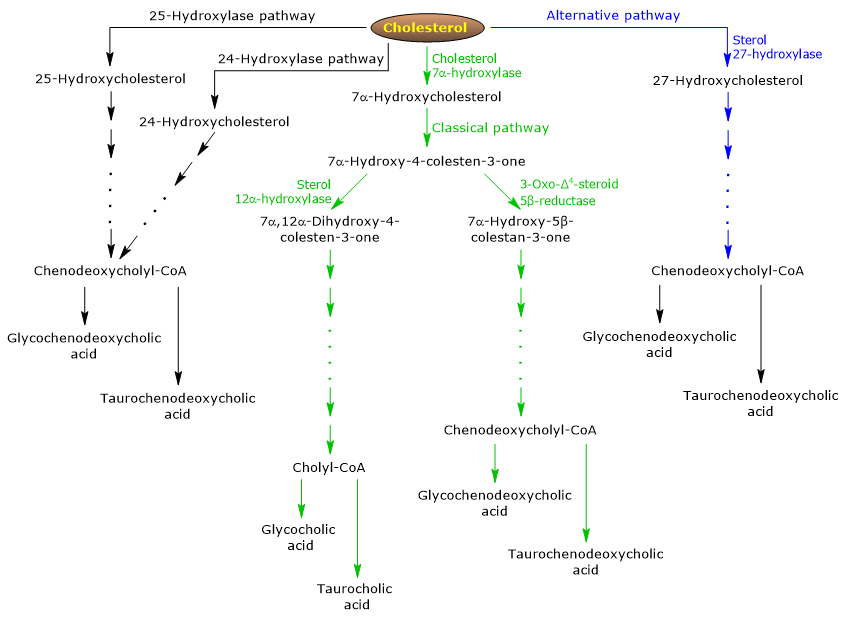
A klasszikus vagy semleges útvonal
Az emberben az epesók akár 90%-a a klasszikus úton (lásd az 5. ábrát) termelődik, amelyet “semleges” útvonalnak is neveznek, mivel az intermedierek semleges molekulák.
Ez egy csak a májban jelen lévő metabolikus útvonal, amely a citoszolban, az endoplazmatikus retikulumban, a peroxiszómákban és a mitokondriumokban lokalizált enzimek által katalizált reakciókból áll, és amelynek végtermékei a koleszterinsav és a kenodeoxikolsav konjugátumai.
- Az első reakció a koleszterin 7. pozíciójában történő hidroxilálás, amelynek során 7α-hidroxikoleszterin keletkezik. A reakciót a koleszterin 7α-hidroxiláz vagy CYP7A1 (E.C. 1.14.14.23) katalizálja. Ez egy endoplazmatikus retikulumban lokalizálódó enzim, és az útvonal sebességkorlátozó lépését katalizálja.
Koleszterin + NADPH + H+ + O2 → 7α-hidroxikoleszterin + NADP+ + H2O
- A 7α-hidroxikoleszterin a 3β-hidroxilcsoport oxidációján és a kettős kötés 5,6 pozícióból 4,5 pozícióba történő eltolásán megy keresztül, 7α-hidroxi-4-kolesten-3-on képződik. A reakciót a 3β-hidroxi-Δ5-C27-szteroid-oxidoreduktáz vagy HSD3B7 (E.C. 1.1.1.181) katalizálja, amely enzim az endoplazmatikus retikulumban lokalizálódik.
- A 7α-hidroxi-4-kolesten-3-on két útvonalon haladhat:
a 7α-hidroxi-4-kolesten-3-on 12α-monooxigenáz vagy szterol 12α-hidroxiláz vagy CYP8B1 (E.C. 1.14.18) által katalizált reakción keresztül beléphet a kolinsav szintéziséhez vezető útvonalba.8), amely enzim az endoplazmatikus retikulumban lokalizálódik;
a 3-oxo-Δ4-szteroid 5β-reduktáz vagy AKR1D1 (E.C. 1.3.1.1.) által katalizált reakción keresztül belép a kénodeoxikolsav szintéziséhez vezető útvonalba.1.3), egy citoszolikus enzim.
Kiemelendő, hogy a szterol 12α-hidroxiláz aktivitása határozza meg a kolinsav és a fenodeoxikolsav arányát, és végső soron az epesavkészlet detergens kapacitását. És valójában a szterol 12α-hidroxiláz gén átírásának szabályozása a klasszikus útvonal egyik fő szabályozási lépése.
Ezért, ha a 7α-hidroxi-4-kolesten-3-on a szterol 12α-hidroxiláz által katalizált reakción keresztül halad, a következő reakciók következnek be.
- A 7α-hidroxi-4-kolesten-3-ont a szterol 12α-hidroxiláz a 12. pozícióban hidroxilálja, 7α,12α-dihidroxi-4-kolesten-3-ont képezve.
- A 7α,12α-Dihidroxi-4-kolesten-3-on a 3-oxo-Δ4-szteroid 5β-reductáz által katalizált reakcióban a 4,5 pozícióban lévő kettős kötés redukcióján megy keresztül, 5β-kolestan-7α,12α-diol-3-ont képezve.
- Az 5β-kolesztán-7α,12α-diol-3-on a 4. pozícióban lévő hidroxilcsoport redukcióján megy keresztül a 3α-hidroxiszteroid-dehidrogenáz vagy AKR1C4 (EC 1.1.1.1.213), egy citoszolikus enzim, az 5β-kolesztán-3α,7α,12α-triol képződéséhez.
- Az 5β-kolesztán-3α,7α,12α-triol az oldallánc oxidációján megy keresztül a szterol-27-hidroxiláz vagy CYP27A1 (EC 1.14.15.15) által katalizált három reakción keresztül. Ez egy mitokondriális enzim, amely extrahepatikus szövetekben és makrofágokban is jelen van, és egy hidroxilcsoportot vezet be a 27-es pozícióban. A hidroxilcsoport aldehiddé, majd karbonsavvá oxidálódik, és 3α,7α,12α-trihidroxi-5β-kolesztánsav keletkezik.
- A 3α,7α,12α-trihidroxi-5β-kolesztánsav a koenzim A észterévé, a 3α,7α,12α-trihidroxi-5β-kolesztánoil-CoA-vá aktiválódik a reakcióban, amelyet vagy a nagyon hosszú láncú acil-CoA-szintetáz vagy VLCS (EC 6.2.1.1.-), vagy az epesav-CoA-szintetáz vagy BACS (EC 6.2.1.7), mindkettő az endoplazmatikus retikulumban lokalizálódik.
- 3α,7α,12α-trihidroxi-5β-kolestanoil-CoA a peroxiszómákba kerül, ahol öt egymást követő reakción megy keresztül, amelyeket egy-egy különböző enzim katalizál. Az utolsó két reakcióban az oldallánc négy szénatomra rövidül, és végül kolilCoA keletkezik.
- Az utolsó lépésben az oldallánc karbonsavcsoportjának amidkötésen keresztül történő konjugációja történik az aminosav glicinnel vagy taurinnal. A reakciót az epesav-CoA:aminosav N-aciltranszferáz vagy a BAAT (EC 2.3.1.65) katalizálja, amely túlnyomórészt a peroxiszómákban lokalizálódik.
A reakció termékei tehát a konjugált epesavak: a glikokolsav és a taurokolsav.
Ha a 7α-hidroxi-4-kolesten-3-on nem a szterol 12α-hidroxiláz által katalizált reakción keresztül halad tovább, akkor az alább leírt reakciókon keresztül belép abba az útvonalba, amely a kénodeoxikolsav-konjugátumok szintéziséhez vezet.
- 7α-hidroxi-4-kolesztán-3-on a 3-oxo-Δ4-szteroid 5β-reductáz által katalizált reakcióban 7α-hidroxi-5β-kolesztán-3-onná alakul át.
- 7α-hidroxi-5β-kolesztán-3-on a 3α-hidroxiszteroid-dehidrogenáz által katalizált reakcióban 5β-kolesztán-3α,7α-diollá alakul.
Ezután a konjugált epesavak, a glikochenodeoxikolsav és a taurochenodeoxikolsav a kolinsav konjugációjánál tapasztaltakhoz hasonló módosításokkal keletkeznek, és többnyire ugyanazok az enzimek katalizálják őket.
Figyelem: A bélben képződött nem konjugált epesavaknak el kell jutniuk a májba, hogy újra konjugálódjanak.
Az alternatív vagy savas útvonal
Ez a magzatban és az újszülöttben uralkodó, míg felnőttekben az epesók kevesebb mint 10%-ának szintéziséhez vezet.
Ez az útvonal (lásd az ábrát. 5) abban különbözik a klasszikus útvonaltól, hogy:
- a köztes termékek savas molekulák, innen az alternatív elnevezés “savas útvonal”;
- az oldallánc oxidációját a szteroidmag módosulása követi, és nem fordítva;
- a végtermékek a fenodeoxikolsav konjugátumai.
Az első lépésben a koleszterin 27-hidroxikoleszterinné alakul át a szterol 27-hidroxiláz által katalizált reakcióban.
A 27-hidroxikoleszterin két útvonalon haladhat.
A útvonal A
- A 27-hidroxikoleszterin a szterol 27-hidroxiláz által katalizált reakcióban 3β-hidroxi-5-kolesztensavvá alakul.
- A 3β-hidroxi-5-koleszténsav az endoplazmatikus retikulumban lokalizálódó oxiszterol-7α-hidroxiláz vagy CYP7B1 (EC 1.14.13.100) enzim által katalizált reakcióban a 7. pozícióban hidroxilálódik 3β-7α-dihidroxi-5-koleszténsavvá.
- A 3β-7α-dihidroxi-5-koleszténsav a 3β-hidroxi-Δ5-C27-szteroid-oxidoreduktáz által katalizált reakcióban 3-oxo-7α-hidroxi-4-koleszténsavvá alakul át.
- A 3-Oxo-7α-hidroxi-4-koleszténsav az oldallánc-módosítások eredményeként kénodeoxikolsavat, majd annak konjugátumait képezi.
B útvonal
- A 27-hidroxikoleszterin 7α,27-dihidroxikoleszterinné alakul át az oxiszterol-7α-hidroxiláz és a koleszterin-7α-hidroxiláz által katalizált reakcióban.
- A 7α,27-dihidroxikoleszterin a 3β-hidroxi-Δ5-C27-szteroid-oxidoreduktáz által katalizált reakcióban alakul át 7α,26-dihidroxi-4-kolesten-3-onná;
7α,26-Dihidroxi-4-kolesten-3-on közvetlenül átalakulhat a kénodeoxikolsav konjugátumaivá, vagy átalakulhat 3-oxo-7α-hidroxi-4-kolesténsavvá, majd oldallánc-módosításokon és egyéb reakciókon megy keresztül, amelyek a kénodeoxikolsav konjugátumainak szintéziséhez vezetnek.
Kisebb útvonalak
Vannak kisebb útvonalak is (lásd az 5. ábrát), amelyek hozzájárulnak az epesók szintéziséhez, bár kisebb mértékben, mint a klasszikus és alternatív útvonalak.
Például:
- A koleszterin 25-hidroxiláz (EC 1.14.99.38) a májban fejeződik ki.
- A koleszterin 24-hidroxiláz vagy CYP46A1 (EC 1.14.14.25) az agyban fejeződik ki, és ezért, bár a szerv nem tud koleszterint exportálni, oxiszterolokat exportál.
- Egy nem specifikus 7α-hidroxilázt is felfedeztek. Ez minden szövetben expresszálódik, és úgy tűnik, hogy részt vesz az oxiszterolok keletkezésében, amelyek a hepatocitákba szállíthatók, hogy ott kénodeoxikolsavvá alakuljanak át.
Kiegészítésképpen a szterol 27-hidroxiláz különböző szövetekben expresszálódik, és ezért reakciótermékeit a májba kell szállítani, hogy epesóvá alakuljanak át.
Epe sók: a szintézis szabályozása
Az epesavszintézis szabályozása negatív visszacsatolási mechanizmuson keresztül történik, különösen a koleszterin 7α-hidroxiláz és a szterol 12α-hidroxiláz expresszióján keresztül.
A szabad és konjugált epesavak feleslege esetén ezek a molekulák a nukleáris receptor farnesoid X receptorhoz vagy FRX-hez kötődnek, és aktiválják azt: a leghatékonyabb epesav a kenodeoxikolsav, míg mások, például az ursodeoxikolsav, nem aktiválják azt.
AFRX indukálja a transzkripciós represszor kis heterodimer partner vagy SHP expresszióját, amely viszont kölcsönhatásba lép más transzkripciós faktorokkal, például a májreceptor homológ-1 vagy LRH-1 és a hepatocita nukleáris faktor-4α vagy HNF-4α. Ezek a transzkripciós faktorok a 7α-hidroxiláz és 12α-hidroxiláz gének promóter régiójában lévő szekvenciához, az úgynevezett epesav válaszelemek vagy BARE-k régiójához kötődnek, gátolva azok átírását.
Az epesavak szintézisének szigorú szabályozásának egyik oka, hogy számos metabolitjuk toxikus.
Chiang J.Y.L. Bile acids: regulation of synthesis. J Lipid Res 2009;50(10):1955-66. doi:10.1194/jlr.R900010-JLR200
Gropper S.S., Smith J.L. Advanced nutrition and human metabolism. 6. kiadás. Cengage Learning, 2012
Moghimipour E., Ameri A. és Handali S. Az epesók felszívódást fokozó hatása. Molecules 2015;20(8); 14451-73. doi:10.3390/molecules200814451
Monte M.J., Marin J.J.G., Antelo A., Vazquez-Tato J. Bile acids: Chemistry, physiology, and pathophysiology. World J Gastroenterol 2009;15(7):804-16. doi:10.3748/wjg.15.804
Rawn J.D. Biochimica. Mc Graw-Hill, Neil Patterson Publishers, 1990
Rosenthal M.D., Glew R.H. Medical biochemistry – Human metabolism in health and disease. John Wiley J. & Sons, Inc. kiadvány, 2009
Sundaram S.S., Bove K.E., Lovell M.A. és Sokol R.J. Mechanisms of Disease: inborn errors of bile acid synthesis. Nat Clin Pract Gastroenterol Hepatol 2008;5(8):456-68. doi:10.1038/ncpgasthep1179