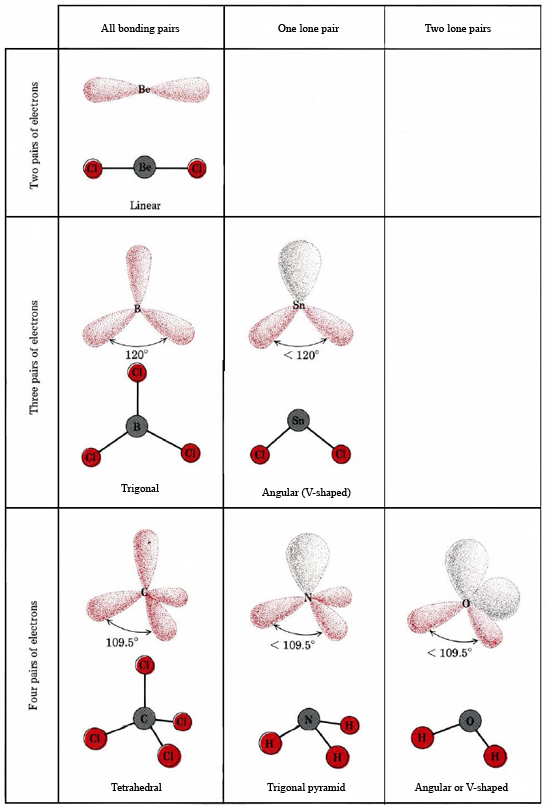
VSEPR理論は孤立ペアを含む分子の形を説明し予測することができる。 このような場合、ローンペアと結合ペアは互いに反発し、回避し合うと考えられる。 例えば、SnCl2分子は結合が2つあるので、BeCl2のような直線的な形状になると思われるかもしれない。 しかしルイス図を描くと、Sn原子の価電子帯には2つの結合対の他に1つの孤立対があることが分かります。 この分子はオクテット則に従っているので、N原子は4つの電子対に囲まれている:
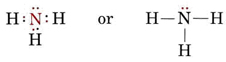
これらの対がすべて等価であれば、それらの間の角度は正四面体の角度である109.5°と予想されます。 実験的には、この角度はやや小さく、107°であることがわかりました。 これもローンペアが結合ペアより太いので、結合ペアをより近くに押し付けることができるためです。 ローンペアとボンディングペアの電子雲の比較。 (a)アンモニア分子の窒素にある孤立電子対。 (b)アンモニア分子の3つの結合電子のうちの1つ。 それぞれの電子雲の割合が等しくなるように境界線が引かれている。
H2O 分子の電子構造は、1つの結合対がローン対に置き換わっていること以外はNH3分子の電子構造と似ています:
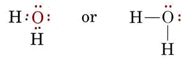
Example (\PageIndex{1}) : Molecular Geometry
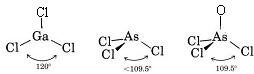
Sketch and describe the geometry of the following molecules.原子核は四面体の隅にあるわけではありませんので、分子形状を説明しなさい。 (a) GaCl3, (b) AsCl3, (c) AsOCl3。
解答
a) ガリウムは第3族に属するので価電子は3つである。 GaCl3のルイス図は
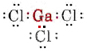
Ga原子の周りに3つの結合対があり、孤立対がないので、3つのCl原子が三角形に配列し、4つの原子はすべて同じ平面上にあると結論する。
b) ArsenicはV族に属するので5価の電子を持つ。 AsCl3のルイス構造はこうなる
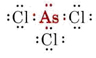
Lone pairがあるので、この分子の形は三角錐で、Cl原子核の正三角形の上にAs原子核が少し乗っている形になる。
c) AsOCl3のルイス図はAsCl3のそれと似ている。

VSEPR理論は5対、6対の価電子を含む分子にも適用でき、その一部はローンペアである。 5417>
Contributors
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff, and Adam Hahn.
はそのような化合物種をここに含んでいない。