化学元素の塩素はハロゲンおよび非金属として分類されています。 1774年にカール・ヴィルヘルム・シェーレによって発見されました。

Data Zone
| 分類されます。 | 塩素はハロゲンで非金属 |
| 色: | 緑がかった黄色 |
| 原子量: | 35.453 |
| 状態: | 気体 |
| 融点: | -101 oC , 172 K |
| 沸点.沸騰。 | -34 oC , 239 K |
| 電子: | 17 |
| プロトン: | 17 |
| 最も豊富な同位体の中性子: | 18 |
| 電子の殻。 | 2,8,7 |
| 電子配置: | 1s2 2s2 2p6 3s2 3p5 |
| 密度@20oC: | 0.003214 g/cm3 |
以下を含む、もっと表示する。 熱、エネルギー、酸化、反応、
化合物、半径、導電率
| 原子容積: | 22.7 cm3/mol | |
| 構造: | 固体中のCl2層 | |
| 硬度.を表示することができます。 | 比熱容量 | 0.48 J g-1 K-1 |
| 融解熱 | 6.406 kJ mol-1 Cl2 | |
| 霧化熱 | 122 kJ mol-1 | |
| 気化熱 | 20.41 kJ mol-1 Cl2 | |
| 第1イオン化エネルギー | 1251.1 kJ mol-1 | |
| 第2イオン化エネルギー | 2297.2 kJ mol-1 | |
| 第1イオン化エネルギー | 1251.1 kJ mol-23 kJ mol-1 | |
| 第3イオン化エネルギー | 3821.8 kJ mol-1 | |
| 電子親和力 | 349 kJ mol-1 | |
| 最小酸化数 | -1 | |
| 最小値(Minimum) 共通酸化数 | -1 | |
| 最大酸化数 | 7 | |
| Max.共通酸化数 | 7 | |
| 電気陰性度(Pauling Scale) | 3.16 | |
| 分極率体積 | 2.2 Å3 | |
| 空気との反応 | なし | |
| 15 M HNO3との反応 | 穏やか、 ⇒ HClOx, NOxCl, NOx | |
| 6 M HClとの反応 | 穏やか, ⇒ HOCl, Cl- | |
| 6M NaOHとの反応 | mild, ⇒ OCl-, Cl- | |
| Oxide(s) | Cl2O, ClO2.S. | OCl-, Cl- |
| ヒドリド(s) | HCl | |
| クロライド(s) | Cl2 | |
| 原子半径 | 100 pm | |
| イオン的性質 イオン半径(1+イオン) | – | |
| イオン半径(2+イオン) | – | |
| イオン半径(3+イオン) | – | |
| イオン半径(1-イオン) | イオン半径(2+イオン) – | |
| イオン半径(1+イオン) – | – | 167 pm |
| イオン半径(2-イオン) | – | |
| イオン半径(3-イオン) | – | |
| 熱伝導率 | 0.0089 W m-1 K-1 | |
| 電気伝導率 | – | |
| 凝固点/融解点: | -101 oC , 172 K |

Chlorine In Test Tube (Photo: Ben Mills)
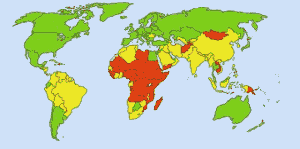
Safe Drinking Water(安全な飲み水)です。 画像はイメージです。 Ionut_Cojocaru。 緑色のエリアでは、誰もが安全な水を手に入れることができます。 赤色の地域では、少なくとも25%の人が処理水を得ることができない。 黄色の地域はその中間。 米国の水道水に塩素が日常的に使用されるようになる前は、腸チフスで毎年25,000人が死亡していました。 現在では、公共水道の98%が塩素または塩素化合物で処理されています。 現在では、腸チフスの犠牲者は平均して年に1人程度となっています。 (4)

Carl Wilhelm Scheele, who discovered chlorine in 1774.
Discovery of Chlorine
1774年にスウェーデンでカールウィルヘルム・シェールによって初めて塩素が生成されました。 Scheeleはパイロルサイトとspiritus salis-錬金術用語で塩の精/息を意味する-の反応により放出されるガスを採取しました。 この新しいガスは、シェーレによると「非常に感じやすい息苦しい匂いで、肺を最も圧迫し…水にわずかに酸味を与え…その中の空気は黄色い色を帯びる…」というものだった。 (1)
シェーレはまた、彼の作った新しいガスの反応性の高さと漂白の性質に注目した。 すべての金属が攻撃され…固定アルカリは普通の塩に変えられた…すべての野菜の花、赤、青、黄色は短時間で白くなり、同じことが緑の植物にも起こった…虫はすぐに死んだ」。 (1)
シェーレは、その観測の正確さにもかかわらず、この新しい気体をムリヤス酸の脱フロン化だと勘違いした。
有名なフランスの化学者アントワーヌ・ラヴォアジエは、まだ発見されていないムリウム元素からオキシムリア酸という名前を付けるべきと考えていた。 (2)
* 塩素の正体に関する混乱はフロギストン説によって引き起こされた。フロギストンは1700年代のほとんどの期間、化学者に受け入れられていたが、ラヴォアジエ自身がそれを否定したのである。 フロギストンは、当時不可解だったことを説明するために使われた「物質」である。
ラヴォアジエはフロギストンの没落の立役者で、化学反応においてはフロギストンよりも酸素の化学の方がよりよい説明であることを示したのである。 (3)
1810年までに、現在我々が塩素と呼んでいる元素は、実は酸素を含む化合物であるというのが科学的なコンセンサスとなった。 彼はこの新しい黄緑色の気体を木炭電極で反応させることができず、酸素を含んでいないのではないかと考えた。 デイヴィーは、リンとアンモニアとの反応で、この新しいガスが酸素を含んでいないことを証明した。 彼は、2000枚もの巨大な板状火山を使って、このガスの燐と硫黄の化合物から酸素を取り出せるかどうかを確かめたが、やはり酸素は見つからなかった。 (1a)
1811年、デイヴィはこの新しいガスを実は新元素であると結論づけた。 (1b) 彼はそれを、淡い緑や黄緑を意味するギリシャ語の「クロロス」から、塩素と名付けました。
塩素の興味深い事実
- 最初に発見された連鎖反応は、核反応ではなく、化学連鎖反応だった。 1913年にマックス・ボーデンシュタインが塩素と水素の混合ガスに光を当てると爆発するのを見て発見しました。 連鎖反応のメカニズムは、1918年にワルター・ネルンストによって完全に説明されました。
- 地球の海には大量の塩素が含まれています。 この塩素が気体として放出された場合、その重量は現在の地球全体の大気の5倍にもなる。 (私たちの海には約2.6×1016メートルトンの塩素があり、そのほとんどは塩化ナトリウムである。)
- 塩素は海に豊富にあるだけではなく、地球の地殻では6番目に多い元素である。
- 少量の塩素に短時間でもさらされると、死に至る可能性がある。 空気中の塩素が1000分の1(あるいはさらに低い濃度の場合もある)で致死が予想される。 (5)
- 塩素は空気より重い。 放出されると、毒のある毛布のようになって風に乗って漂う。 塩素は第一次世界大戦で化学兵器として、最初は1915年にドイツ軍によって、次に西側連合国によって使用された。 というのも、塩素はその強烈な臭いで容易に発見されるからである。 また、水溶性であるため、兵士は湿った布を通して呼吸することで、その最悪の影響から身を守ることができました。

塩素は皮膚、目、呼吸器系を刺激する有毒ガスです。
特徴:
塩素は緑がかった黄色で二原子の濃いガスで、鋭い臭い(漂白剤の臭い)がします。
他のほぼすべての元素と容易に結合するので自然界には自由に存在しないのですが、このガスを使用すると、塩素を除去することができます。
自然界では、主に普通塩(NaCl)、カルナライト、シルバイト(KCl)として存在します。
液体および固体では、強力な漂白剤、酸化剤、殺菌剤です。
塩素の用途
塩素化合物は、衛生、パルプ漂白、殺菌剤、繊維加工に主に使用されています。
塩素は塩素酸塩の製造にも使用され、有機化学において重要で、クロロホルム、四塩化炭素、ポリ塩化ビニル、合成ゴムなどの化合物を形成する。
その他の塩素化合物の用途としては、染料、石油製品、医薬品、防腐剤、殺虫剤、食品、溶剤、塗料、プラスチックなどがある。
存在量と同位体
存在量 地殻:重量で145ppm、モルで85ppm
存在量 太陽系:重量で8ppm、モルで0.3ppm
コスト、純粋:100gあたり0.15ドル
コスト、バルク:100gあたりドル
源流は? 塩素ガスは、海水や塩鉱山のかん水から塩化ナトリウム(NaCl)を電気分解することで商業的に生産されています。
同位体。 塩素には半減期がわかっている同位体が16種類あり、質量数は31~46である。

- Henry M. Leicester, Herbert S. Klickstein, A Source Book in Chemistry, 1400-1900, (1969) Harvard University Press.p111; 1a. p241.; 1b. p257.
- J.W. Mellor, A Comprehensive Treatise on Inorganic and Theoretical Chemistry., 1922, vol 2, Longmans, Green and Co., p21.
- Antoine Lavoisier, Memoires de l’ Academie royale des sciences 1783.1786, p505-538.
- 塩素樹(塩素樹).
- OSHA, 塩素に関する労働安全衛生指針.
このページを引用する
オンラインリンクの場合は、次のいずれかをコピーして貼り付けてください:
<a href="https://www.chemicool.com/elements/chlorine.html">Chlorine</a>
または
<a href="https://www.chemicool.com/elements/chlorine.html">Chlorine Element Facts</a>
学術文書でこのページを引用する場合は、次のMLA準拠の引用文を使用してください:
"Chlorine." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/chlorine.html>.
.