Bile salts and bile acids are polar cholesterol derivatives, and represent major route for elimination of the steroid from the body.
They are molecules with similar but not identical structures, and diverse physical and biological characteristics.
肝臓で合成され、胆嚢に貯蔵され、十二指腸に分泌され、最終的に大部分は回腸で再吸収される。
生理的pHではこれらの分子はアニオンとして存在するので、胆汁酸および胆汁酸塩という用語は本書では同義語として使用されている。
CONTENTS
- 胆汁酸塩の化学構造
- Primary, 胆汁酸の機能
- 胆汁酸の肝内循環
- 胆汁酸の腸内代謝
- 水溶性食物繊維と再吸収 胆汁酸の合成
- 古典的または中性経路
- 代替または酸性経路
- マイナー経路
- 胆汁酸の合成。
合成の調節
胆汁酸塩の化学構造
胆汁酸塩はコレステロール分子と類似点と相違点があります。
ステロイドと同じように、A、B、Cと書かれた3つのシクロヘキサン環とDと書かれたシクロペンタン環の4つが縮合した構造を核とし、この構造はペルヒドロシクロペンタノフェナンスレン、より一般的にはステロイド核と呼ばれています。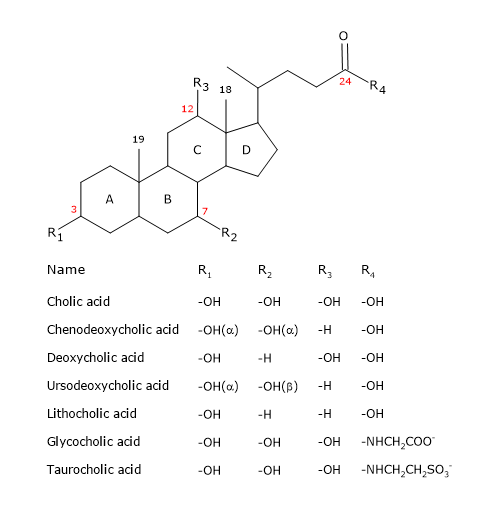
胆汁酸とその共役体 高等脊椎動物では、側鎖が3炭素短くなるので、炭素原子数は24個になります。 低脊椎動物では、胆汁酸は25、26、または27の炭素原子を有する。 側鎖の末端にはpH7でイオン化するカルボキシル基があり、アミノ酸のグリシンやタウリン(下記参照)に結合することができる。
3位の水酸基に加え、7位および/または12位に水酸基を持つ。
これらのことからコレステロールよりもはるかに極性が高いことがわかる。
A環とB環がシス配置で融合しているため、ステロイド核の平面構造は湾曲しており、- 側鎖の水酸基とカルボキシル基が、連結したアミノ酸の有無にかかわらず、そちらに向いているので親水性の凹面、
- 18位と19位にあるメチル基がそちらに向いているので疎水性の凸面、が識別可能であった。
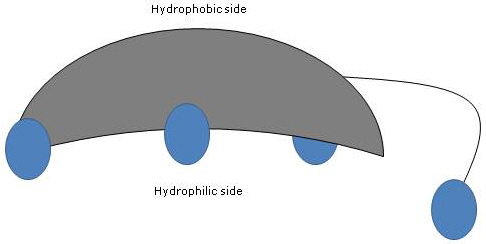
コール酸の構造 このように極性と非極性の基を持つため、両親媒性分子であり優れた界面活性剤であるといえます。 しかし、その化学構造は他の多くの界面活性剤とは異なり、多くの場合、極性頭部領域と非極性尾部から構成されています。
一次、共役、二次胆汁酸塩
一次胆汁酸とは肝細胞でコレステロールから直接合成されるもので、胆汁酸と共役(共役)胆汁酸(胆汁酸)があります。 ヒトではコール酸とチェノデオキシコール酸が最も重要で、全胆汁酸の80%を占めています。 胆汁酸は胆道系に分泌される前に、グリシンやタウリンと98%まで完全に共役し、それぞれグリコン・コンジュゲート、タウロ・コンジュゲートとなる。 特に、コール酸およびチェノデオキシコール酸の約75%はグリシンと共役し、グリココール酸およびグリコチェノデオキシコール酸を形成し、残りの25%はタウリンと共役し、タウロコール酸およびタウロチェノデオキシコールを形成している。
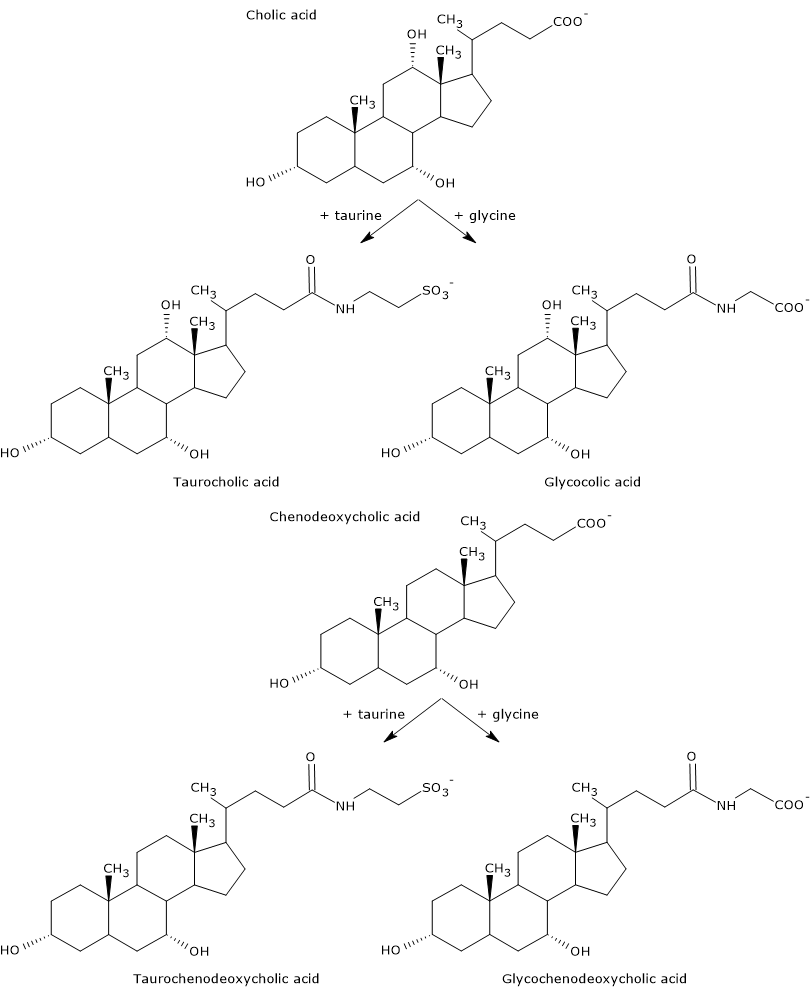
共役胆汁酸の合成 共役胆汁酸は、非共役胆汁酸よりも親水基が多い分子で、乳化能力が高くなる。 実際、共役によって胆汁酸のpKaは、非共役分子の典型的な値である約6から、グリココール酸では約4、タウロコール酸では約2に低下する。 このことから、共役胆汁酸はより広い範囲のpHでイオン化して対応する塩を形成することになる。
一般の酸と胆汁酸塩の親水性は、グリシン共役<タウリン共役<リトコール酸<デオシコール酸<チェノデオキシコール酸<コール酸<ウルソデオキシコール酸の順で低下する。
最後に、抱合は一次胆汁酸の細胞毒性をも低下させる。二次胆汁酸は、小腸から再吸収されなかった一次胆汁酸から生成されます。 大腸に到達すると、腸内細菌叢によっていくつかの修飾を受け、二次胆汁酸が形成される(下記参照)。 7471>
胆汁酸塩を分類するもう一つの方法は、グリシンやタウリンとの抱合と水酸化の度合いに基づくものである。 グリシンやタウリンとの結合、水酸化の度合いによって分類される。
- トリヒドロキシ結合体:タウロコール酸、グリココール酸など
- ジヒドロキシ結合体:グリコードキシコール酸、グリコシェノデオキシコール酸、タウロシェノデオキシコール酸、タウロデオキシコール酸など
- タウロコールのような3つの分類に分けられる。 胆汁中に存在する胆汁酸塩の約60%を占める。
- 非共役型、例えば、コール酸、デオキシコール酸、チェノデオキシコール酸、リトコール酸などである。
胆汁酸の機能
すべての生理機能は抱合型で行われます。
- 人体からコレステロールを排泄する主要経路となっています。
実際、ヒトはステロイド核のシクロヘキサン環やシクロペンタン環を開環する酵素を持たず、コレステロールをCO2と水に酸化することもできません。
ステロイドを体外に排出するもう一つのメカニズムは、胆汁中にそれ自体としてコレステロールを入れることです。 - 胆汁酸塩は強い界面活性剤であること。 そして特に、ジ-およびトリヒドロキシ抱合体は、より多くの極性基を持っているので、非抱合体よりもはるかに効果的な、胆汁酸の中で最高の界面活性剤です。
小腸の内腔で無極性脂質と接触すると、凸の無極性表面は、トリグリセリド、コレステロールエステル、脂肪溶解ビタミンのエステルと対話し、一方凹の極性表面は周りの水媒体と対話することができるのです。 これは、水性媒体中の無極性脂質の分散を増加させ、小さな脂質小滴の形成を可能にし、表面積を増加させます:
リパーゼ活性、主に膵臓リパーゼ、(この酵素の活性化には胆汁酸塩も直接関与);
腸のエステラーゼ活性。
その結果、混合ミセルの形成により、脂質の消化産物や脂溶性ビタミンの腸管粘膜での吸収を促進します。
胆嚢でも同様の働きをし、リン脂質と混合ミセルを形成して、コレステロールの沈殿を防止しています。
注:胆汁酸は極性基と非極性基の配列の結果、水溶液中でミセルを形成し、その濃度がいわゆる臨界ミセル濃度(CMC)以上であれば、通常は10個以下のモノマーで構成されている。- 腸管レベルでは、膵臓酵素やコレシストキニンの分泌を調節する。
- 小腸や大腸では、特にグラム陽性菌に対してデオキシコール酸を中心に強力な抗菌活性を持つ。 この活性は、酸化的なDNA損傷、および/または、細胞膜の損傷によるものと考えられる。
- ここ数年、エネルギー代謝の制御、特に肝グルコース処理の制御における役割が明らかになっています。
胆汁酸の肝内循環
脂肪摂取後、十二指腸の腸内分泌細胞からコレシストキニンが血流に分泌される。 このホルモンは胆嚢の平滑筋細胞の受容体に結合してその収縮を促進し、またOddi括約筋を弛緩させる。
生理的条件下では、ヒトの胆汁酸塩プールは一定で、約3~5gである。これは、- 腸での再吸収、
- デノボ合成(下記参照)の2プロセスにより可能となる。
分泌された胆汁酸塩の最大95%は、脂質消化産物とともにではなく、腸肝循環と呼ばれる過程を経て腸から再吸収される。
この循環システムは非常に効率的で、1食ごとに少なくとも2回発生すると考えられ、肝臓、胆管、小腸、結腸および再吸収分子が肝臓に戻る門脈循環が含まれる。 肝臓の胆汁酸合成能力は限られており、胆汁酸塩が多量に糞便中に排泄された場合、腸の要求を満たすには不十分であるため、このような再循環が必要なのである。
胆汁酸の大部分は、腸管細胞の刷子縁にあるナトリウム依存性胆汁酸トランスポーター(ASBT)により、小腸の下部である回腸遠位部に再吸収され、胆汁酸1分子とナトリウムイオン2個の共輸送を行っている。
腸細胞内では、胆汁酸は回腸胆汁酸結合タンパク質(IBABP)によって細胞質から側底膜に輸送されると考えられています。 胆汁酸は、有機溶質トランスポーターαβ(OSTα/OSTβ)によって側底膜を通過し、門脈循環に入り、アルブミンと結合して肝臓に到達する。
肝臓レベルでは、胆汁酸の構造により、50~90%の初回通過抽出率があり、非常に効率的である。 共役胆汁酸の取り込みは、主にNa+依存性の活性輸送系、すなわちNa依存性タウロコール酸共輸送ポリペプチド(NTCP)が担っている。 しかし、ナトリウムに依存しない取り込みも起こり、有機アニオン輸送ポリペプチド(OATP)ファミリーのタンパク質、主にOATP1B1とOATP1B3によって行われる。
腸肝循環における律速段階は、胆汁塩輸出ポンプ(BSEP)によって、主にATP依存的なプロセスで行われる管状分泌物である。 このポンプは、最も多く存在するモノアニオン性の胆汁酸塩を輸送する。 グルクロン酸や硫酸と結合した胆汁酸はジアニオン性であり、MRP2やBCRPなどの異なる輸送体によって運ばれる。注:血清中の胆汁酸濃度は再吸収速度に基づいて変化するので、腸肝循環がより活発になる食事中に高くなる。
胆汁酸の腸内代謝
回腸吸収を逃れた胆汁酸は大腸に入り、一部は腸内細菌叢による修飾を受け、二次胆汁酸に変換される。
主な反応を以下に示す。- 脱共役
側鎖では、C24 N-アシルアミド結合の加水分解が起こり、未共役胆汁酸やグリシン、タウリンが放出されることがある。 この反応は小腸と大腸に存在する細菌性ヒドロラーゼによって触媒される。 - 7α-脱水素化反応
定量的には最も重要な反応で、7位の水酸基を除去して7デオキシ胆汁酸にする大腸菌性のデヒドラターゼによって行われる。 特に、コール酸からはデオキシコール酸が、チェノデオキシコール酸からは毒性のある二次胆汁酸であるリトコール酸が生成する。
7α-デヒドロキシル化は酸化やエピマー化(下記参照)と異なり、非共役胆汁酸にのみ起こるため、脱共役化が必須条件であることに注意しなければならない。 - 酸化・エピメリゼーション
3位、7位、12位の水酸基が関与する反応で、細菌のヒドロキシステロイドデヒドロゲナーゼによって触媒される。 例えば、ウルソデオキシコール酸は、チェノデオキシコール酸のエピマー化に由来します。
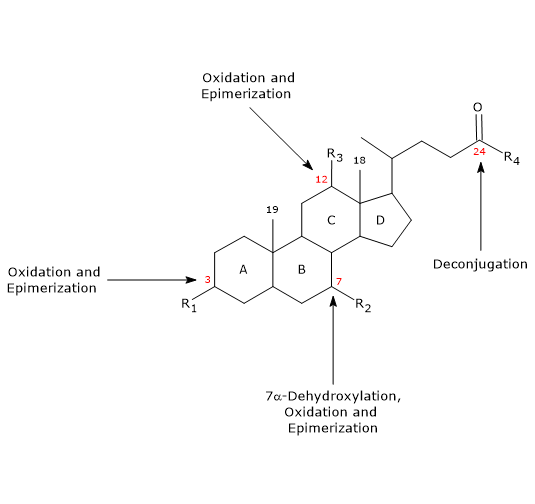
胆汁酸の腸内代謝 次に、第二胆汁酸の一部が大腸から再吸収されて肝臓へ戻されることになります。 肝細胞で、必要なら再共役化され、再分泌される。 酸化と脱共役は幅広い嫌気性菌によって行われるが、7α-脱水酸化は限られた大腸嫌気性菌によって行われる。
7α-脱水素化と脱共役化により、胆汁酸のpKaが上昇し、疎水性が高まり、大腸の壁を越えてある程度受動的に吸収されるようになる。 そして、胆汁、血液、便中の二次胆汁酸の高濃度は、大腸がんの病因と関連している。水溶性食物繊維と胆汁酸塩の再吸収
新鮮な果物、豆類、オーツ、オーツブランに見られるような水溶性繊維のキレート作用によって、胆汁酸塩を結合させてその吸収を抑えることが可能である。 その結果、胆汁酸のデノボ合成が増加し、7α-水酸化酵素やステロール12α-水酸化酵素(後述)の発現が上昇し、肝細胞のコレステロール濃度が低下します。
肝コレステロールが枯渇すると、LDL受容体の発現が上昇し、LDLコレステロールの血漿濃度が低下するのです。 一方、コレステロール生合成の重要な酵素であるHMG-CoA還元酵素の合成を促進します。
注:抗コレステロール薬の中には、腸内で胆汁酸と結合し、その再吸収を阻害することによって作用するものがあります。一次胆汁酸の合成
定量的には、胆汁酸はコレステロール代謝の主要産物です。
先に述べたように、腸肝循環とそのde novo合成によって胆汁酸プールサイズは一定に維持されます。 特に、デノボ合成により、顔面に排泄される胆汁酸塩、すなわち体内プールの約5~10%、~0.5g/日を補うことができる。
以下、コール酸およびチェノデオキシコール酸の合成と、アミノ酸のタウリンおよびグリシンとの抱合について述べる。
胆汁酸合成には、古典経路と代替経路の主に二つの経路が存在する。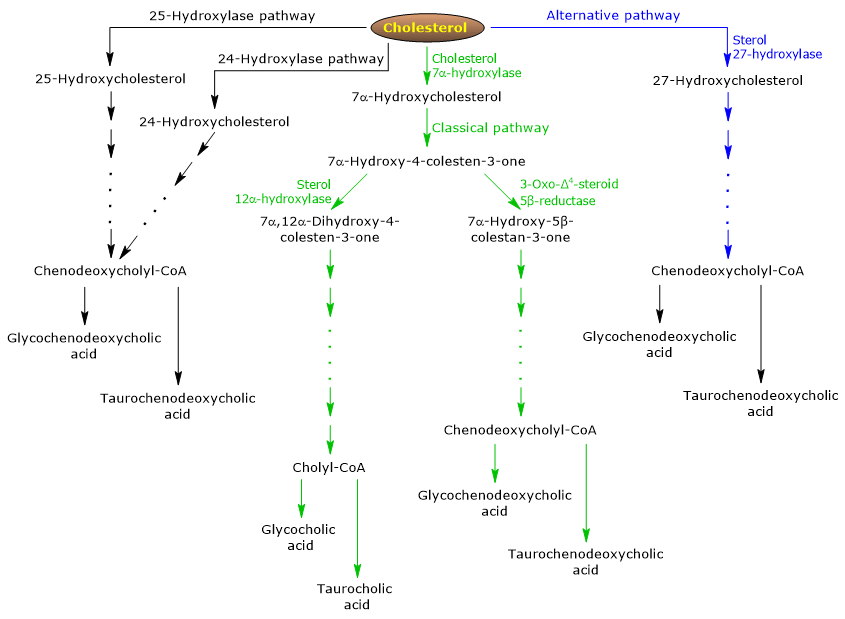
De Novo Synthesis of Primary Bile Acids and Their Conjugates The classical or neutral pathway
ヒトでは、90%までの胆汁酸が古典経路(図5参照)で作られ、中間体が中性分子なので「中性」経路とも呼ばれる。
これは肝臓にのみ存在する代謝経路で、細胞質、小胞体、ペルオキシソーム、ミトコンドリアに局在する酵素によって触媒される反応からなり、その最終生成物はコール酸とチェノデオキシコール酸の共役体である。- 最初の反応はコレステロールの7位を水酸化して7α-ヒドロキシコレステロールとするもので、このときコレステロールの水酸基は7α-ヒドロキシコレステロールとなる。 この反応はコレステロール7α-ヒドロキシラーゼまたはCYP7A1(E.C. 1.14.14.23)によって触媒される。 小胞体に局在する酵素であり、本経路の律速段階を触媒する。
コレステロール + NADPH + H+ + O2 → 7α-ヒドロキシコレステロール + NADP+ + H2O
- 7α-ヒドロキシコレステロールは3β-ヒドロキシル基の酸化と二重結合が5,6位から4,5位に移動して7α-ヒドロキシ-4-コレスチン-3を形成します。 この反応は、小胞体に局在する酵素である3ββ-ヒドロキシ-Δ5-C27-ステロイド酸化還元酵素またはHSD3B7 (E.C. 1.1.1.181) によって触媒される。
- 7α-ヒドロキシ-4-コレステン-3-オンには2つの経路があり、
7α-ヒドロキシ-4-コレステン-3-オン 12モノオキシゲナーゼまたはステロール12α-ヒドロキシラーゼまたはCYP8B1が触媒する反応によりコール酸合成に至る経路に入る (E.C. 1.14.18.8)、小胞体に局在する酵素;
3-オキソ-Δ4-ステロイド5β-リダクターゼまたはAKR1D1が触媒する反応によって、チェノデオキシコール酸の合成を導く経路に入る(E.C. 1.3.1.3)、細胞質酵素である。
ステロール12α-水酸化酵素の活性が、コール酸とチェノデオキシコール酸の比率、ひいては胆汁酸プールの洗浄能力を決定することを強調しておく必要がある。 そして実際、ステロール12α-水酸化酵素遺伝子の転写調節は古典的経路の主要な調節ステップの1つである。
したがって、7α-ヒドロキシ-4-コレステン-3-オンがステロール12α-水酸化酵素が触媒する反応を介して進行すると、以下の反応が起こることになる。
- 7α-Hydroxy-4-cholesten-3-one は、ステロール12α-hydroxylaseにより12位が水酸化され、7α,12α-dihydroxy-4-cholesten-3-one が生成される。
- 7α,12α-ジヒドロキシ-4-コレステン-3-オンは、3-oxo-Δ4-ステロイド5β-レダクターゼの触媒反応により4,5位の二重結合が還元されて5β-コレスタン-7α,12α-ジオ-3-オンに変化する。
- 5β-コレスタン-7α,12α-ジオール-3-オンは、3α-ヒドロキシステロイドデヒドロゲナーゼまたはAKR1C4(EC 1.4653>
- 5β-コレスタン-3α,7α,12α-トリオールは、ステロール27-ヒドロキシラーゼまたはCYP27A1 (EC 1.14.15.15) が触媒する3つの反応を経て側鎖の酸化を受け、細胞質酵素である5β-コレスタン3α,7α,12α-トリオールとなる。) この酵素は、肝外組織やマクロファージにも存在するミトコンドリア酵素であり、27位に水酸基を導入する。 水酸基はアルデヒドに酸化され、さらにカルボン酸に酸化されて、3α,7α,12α-トリヒドロキシ-5β-コレスタン酸を生成する。
- 3α,7α,12α-トリヒドロキシ-5β-コレスタン酸は、超長鎖アシル-CoA合成酵素またはVLCS(EC 6.6)の触媒反応により、そのコエンザイムAエステル、3α7α,12α-トリヒドロキシ-5β-コレスタノールCoAが活性化される。4653>
- 3α,7α,12α-Trihydroxy-5-cholestanoyl-CoA はペルオキシソームに輸送され、そこで5つの連続した反応を受け、それぞれ異なる酵素によって触媒される。 最後の2つの反応では、側鎖が4つの炭素原子に短縮され、最終的にcholylCoAが生成される。
- 最後のステップでは、側鎖のカルボン酸基とアミノ酸のグリシンまたはタウリンとのアミド結合による共役を生じる。 この反応は、ペルオキシソームに主に局在する胆汁酸-CoA:アミノ酸N-アシルトランスフェラーゼまたはBAAT(EC 2.3.1.65)により触媒される。
その結果、グリコール酸およびタウロコール酸という抱合胆汁酸が生成される。
7α-ヒドロキシ-4-コレステン-3-オンがステロール12α-ヒドロキシラーゼが触媒する反応を経由しない場合、以下に述べる反応により、チェノデオキシコール酸抱合体の合成に至る経路に入る。
- 7α-Hydroxy-4-cholesten-3-one は、3-oxo-Δ4-steroid 5ββ-reductaseが触媒する反応で7α-hydroxy-5β-cholestan-3-oneに変換され、
- 7α-Hydroxy-5β-cholestan-3-one は3α-hydroxysteroid dehydrogenaseが触媒する反応で 5β-cholestan-3α,7α-diol に変換されます。
次に、共役胆汁酸であるグリコチェノデオキシコール酸およびタウロチェノデオキシコール酸は、コール酸の共役に見られるのと同様の修飾を受け、ほとんどが同じ酵素によって触媒されて形成される。
注:腸で生成された未共役胆汁酸は、肝臓で再共役されなければならない。
代替または酸性経路
胎児と新生児に多く、成人では胆汁酸塩の10%未満しか合成されない。 この経路は、古典的な経路とは異なり、
- 中間生成物が酸性の分子であり、そこから「酸性経路」という別名が付けられたこと、
- 側鎖の酸化の後にステロイド核が修飾され、逆はないこと、
- 最終生成物がチェルノデオキシコール酸の共役物であること、が挙げられる。
最初のステップは、ステロール27-ヒドロキシラーゼによって触媒される反応で、コレステロールの27-ヒドロキシコレステロールへの変換を含む。
27-ヒドロキシコレステロールは、2つの経路をたどることができる。ルートA
- 27-ヒドロキシコレステロールは、ステロール27-ヒドロキシラーゼが触媒する反応で3β-ヒドロキシ-5-コレステノイン酸に変換される。
- 3β-ヒドロキシ-5-コレステン酸は、小胞体に局在する酵素であるオキシステロール7α-ヒドロキシラーゼまたはCYP7B1(EC 1.14.13.100)により触媒される反応で7位が水酸化されて3β-7α-ジヒドロキシ-5-コレステン酸を形成する。
- 3β-7α-ジヒドロキシ-5-コレステイン酸は、3β-ヒドロキシ-Δ5-C27-ステロイド酸化還元酵素の触媒反応により、3-オキソ-7α-ヒドロキシ-4-コレステイン酸に変換される。
3オキソ-7α-ヒドロキシ-4-コレステイン酸は側鎖改変によりケノデオキシコール酸と、その共役体とを形成する。
ルートB
- 27-ヒドロキシコレステロールは、オキシステロール7α-ヒドロキシラーゼとコレステロール7α-ヒドロキシラーゼの触媒反応により7α,27-ジヒドロキシコレステロールに変換される。
- 7α,27-ジヒドロキシコレステロールは、3β-ヒドロキシ-Δ5-C27-ステロイド酸化還元酵素の触媒反応により7α,26-ジヒドロキシ-4-コレステン-3-オンに変換される。
7,26-Dihydroxy-4-cholesten-3-one は、直接chenodeoxycholic acidの抱合体に変換されるか、または3-oxo-7α-hydroxy-4-colestenoic acidに変換されて、側鎖修飾および他の反応を経て、chenodeoxycholic acidの抱合体の合成に至る可能である。
マイナー経路
古典的経路や代替経路に比べれば程度は低いが、胆汁酸合成に寄与するマイナー経路(図5参照)も存在する。4653>
さらに、ステロール27-ヒドロキシラーゼがさまざまな組織で発現しているので、その反応生成物は肝臓に運ばれて胆汁酸塩に変換される必要があると思われる。
胆汁酸:合成の調節
胆汁酸合成の調節は、特にコレステロール7α-ヒドロキシラーゼとステロール12α-ヒドロキシラーゼの発現に対する負のフィードバック機構によって行われる。
遊離型、抱合型ともに胆汁酸が過剰になると、これらの分子は核内受容体ファルネソイドX受容体(FRX)に結合して活性化する。最も有効な胆汁酸はチェノデオキシコール酸で、ウルソデオキシコール酸など他のものはこれを活性化しない。
FRXは転写抑制因子であるスモールヘテロダイマーパートナー(SHP)の発現を誘導し、SHPは肝臓受容体ホモログ1(LRH-1)や肝細胞核因子4α(HNF-4α)といった他の転写因子と相互作用する。 これらの転写因子は、7α-水酸化酵素および12α-水酸化酵素遺伝子のプロモーター領域にある、胆汁酸応答要素(BARE)と呼ばれる領域に結合し、その転写を阻害する。
胆汁酸合成が厳密に制御されている理由の一つは、その代謝物の多くが有毒であるためだ。 J Lipid Res 2009;50(10):1955-66. doi:10.1194/jlr.R900010-JLR200
Gropper S.S., Smith J.L. Advanced nutrition and human metabolism.日本経済新聞出版社(2009):1994-1994。 6h Edition. Cengage Learning, 2012
Moghimipour E., Ameri A., and Handali S. Absorption-enhancing effects of bile salts.(胆汁酸塩の吸収促進効果)。 Molecules 2015;20(8); 14451-73. doi:10.3390/molecules200814451
Monte M.J., Marin J.J.G., Antelo A., Vazquez-Tato J. Bile acids: Chemistry, Physiology, and pathophysiology. World J Gastroenterol 2009;15(7):804-16. doi:10.3748/wjg.15.804
Rawn J.D. Biochimica. Mc Graw-Hill, Neil Patterson Publishers, 1990
Rosenthal M.D., Glew R.H. Medical biochemistry – Human metabolism in health and disease. John Wiley J. & Sons, Inc., Publication, 2009
Sundaram S.S., Bove K.E., Lovell M.A. and Sokol R.J. Mechanisms of Disease: Inborn errors of bile acid synthesis. Nat Clin Pract Gastroenterol Hepatol 2008;5(8):456-68. doi:10.1038/ncpgasthep1179
.