Het chemische element kobalt wordt geclassificeerd als een overgangsmetaal. Het werd in 1735 ontdekt door George Brandt.

Data Zone
| Classificatie: | Kobalt is een overgangsmetaal |
| Kleur: | blauwachtig-wit |
| Atomisch gewicht: | 58.9332 |
| Staat: | vast |
| Smeltpunt: | 1495 oC, 1768 K |
| Kookpunt: | 2930 oC, 3203 K |
| Elektronen: | 27 |
| Protonen: | 27 |
| Neutronen in meest voorkomende isotoop: | 32 |
| Elektronenschillen: | 2,8,15,2 |
| Elektronenconfiguratie: | 3d7 4s2 |
| Dichtheid bij 20oC: | 8.90 g/cm3 |
Toon meer: Warmte, Energie, Oxidatie, Reacties,
Samenstellingen, Stralen, Geleidbaarheden
| Atomair volume: | 6.7 cm3/mol | ||
| Structuur: | hcp: hexagonale nauwe pkd | ||
| Hardheid: | 5,0 mohs | ||
| Specifieke warmtecapaciteit | 0.42 J g-1 K-1 | ||
| Smeltwarmte | 16.190 kJ mol-1 | ||
| Smeltwarmte | 426 kJ mol-1 | ||
| Vermbrandingswarmte | 373.3 kJ mol-1 | ||
| 1e ionisatie-energie | 758.4 kJ mol-1 | ||
| 2e ionisatie-energie | 1646 kJ mol-1 | ||
| 3e ionisatie-energie | 3232.2 kJ mol-1 | ||
| Elektronenaffiniteit | 63.8 kJ mol-1 | ||
| Minimaal oxidatiegetal | -1 | ||
| Min. gangbaar oxidatiegetal | |||
| Min. gangbaar oxidatiegetal | . | 0 | |
| Maximaal oxidatiegetal | 5 | ||
| Max. gemeenschappelijk oxidatiegetal. | 3 | ||
| Electronegativiteit (Pauling-schaal) | 1.88 | ||
| Polariseerbaarheidsvolume | 7,5 Å3 | ||
| Reactie met lucht | mild, w/ht ? Co3O4 | ||
| Reactie met 15 M HNO3 | intensief, ? Co(NO3)2, NOx | ||
| Reactie met 6 M HCl | mild, ? H2, CoCl2 | ||
| Reactie met 6 M NaOH | – | ||
| Oxide(s) | CoO, Co3O4 | ||
| Hydride(s) | Neen | ||
| Chloride(s) | CoCl2 | ||
| Atomaire radius | 135 pm | ||
| Ionische radius (1+ ion) | – | ||
| Ionische radius (2+ ion) | 83.8 pm | ||
| Ionstraal (3+ ion) | 71.8 pm | ||
| Ionstraal (1-ion) | – | ||
| Ionstraal (2-ion) | – | ||
| Ionstraal (3- ion) | – | ||
| Thermische geleidbaarheid | 100 W m-1 K-1 | ||
| Elektrisch geleidingsvermogen | 17.9 x 106 S m-1 | ||
| Vries-/Smeltpunt: | 1495 oC, 1768 K |
Ontdekking van Kobalt
Sinds de oudheid worden kobaltverbindingen gebruikt om blauw glas en keramiek te produceren.
Het element werd voor het eerst geïsoleerd door de Zweedse chemicus George Brandt in 1735. Hij toonde aan dat het de aanwezigheid van het element kobalt was dat de blauwe kleur in glas veroorzaakte, en niet bismut zoals eerder werd gedacht.
Omstreeks 1741 schreef hij: “Zoals er zes soorten metalen zijn, zo heb ik ook met betrouwbare experimenten aangetoond… dat er ook zes soorten halfmetalen zijn: een nieuw halfmetaal, namelijk kobalt regulus naast kwik, bismut, zink, en de regulus van antimoon en arseen.”
Het woord kobalt is afgeleid van het Duitse ‘kobold’, dat goblin of elf betekent. De afbeelding van kobalt hieronder is van Ben Mills.


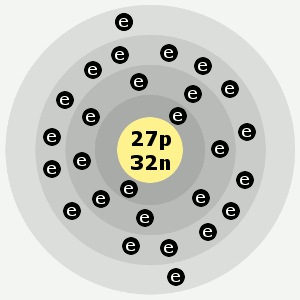
De elektronenschillen van kobalt
Opzicht en eigenschappen
schadelijke effecten:
Kobalt en zijn verbindingen worden beschouwd als licht giftig bij huidcontact en als matig giftig bij inslikken.
Karakteristieken:
Kobalt is een blauwachtig wit, glanzend, hard, bros metaal. Het is ferromagnetisch.
Het metaal is chemisch actief en vormt vele verbindingen. Kobalt blijft magnetisch tot de hoogste temperatuur van alle magnetische elementen (het heeft een Curie-punt van 1121oC).
Toepassingen van kobalt
Kobalt wordt gebruikt in legeringen voor onderdelen van vliegtuigmotoren en in legeringen met corrosie/slijtagebestendige toepassingen.
Kobalt wordt veel gebruikt in batterijen en bij galvaniseren.
Kobaltzouten worden gebruikt om blauwe en groene kleuren te geven in glas en keramiek.
Radioactief 60Co wordt gebruikt bij de behandeling van kanker.
Kobalt is essentieel voor veel levende wezens en is een bestanddeel van vitamine B12.
Kobalt wordt ook gebruikt in permanente magneten van samarium-kobalt. Deze worden gebruikt in gitaarpickups en hogesnelheidsmotoren.
Bundantie en isotopen
Bundantie aardkorst: 25 delen per miljoen gewicht, 8 delen per miljoen mol
Bundantie zonnestelsel: 4 delen per miljoen gewicht, 0,7 delen per miljoen mol
Kosten, zuiver: $21 per 100g
Kosten, bulk: $4,40 per 100g
Bron: Kobalt komt niet als vrij element in de natuur voor. Het wordt gevonden in minerale ertsen. De belangrijkste ertsen van kobalt zijn kobaltiet (CoAsS), erythriet (gehydrateerd arsenaat van kobalt), glaucodot (Co,Fe)AsS, en skutterudiet (Co,Ni)As3. Kobalt wordt over het algemeen geproduceerd als bijproduct van nikkel- en kopermijnbouw.
Isotopen: Kobalt heeft 22 isotopen waarvan de halveringstijd bekend is, met massagetallen 50 tot 72. Natuurlijk voorkomend kobalt bestaat uit zijn ene stabiele isotoop, 59Co.

- Edward Smedley, Hugh James Rose, Henry John Rose, Encyclopaedia Metropolitana; or Universal Dictionary of Knowledge., 1845, Volume 4, p693 William Clowes and Sons.
Cite this Page
Cite this Page
Voor online-linking, kopieer en plak een van de volgende:
<a href="https://www.chemicool.com/elements/cobalt.html">Cobalt</a>
of
<a href="https://www.chemicool.com/elements/cobalt.html">Cobalt Element Facts</a>
Om deze pagina in een academisch document te citeren, gebruik de volgende MLA-conforme citatie:
"Cobalt." Chemicool Periodic Table. Chemicool.com. 16 Oct. 2012. Web. <https://www.chemicool.com/elements/cobalt.html>.