Michael D. Ober, MD
Christina M. Klais, MD
Emmett T. Cunningham Jr, MD, PhD, MPH
Ciudad de Nueva York
El edema macular representa la acumulación patológica de líquido extracelular dentro de la retina, principalmente en las capas plexiforme externa y nuclear interna, como respuesta inespecífica a una ruptura de las barreras sangre-retina. La ME es una causa frecuente de pérdida de visión en pacientes con diabetes mellitus, oclusión venosa de la retina, uveítis y tras una cirugía intraocular. Ocurre con menos frecuencia en el contexto de la tracción vitreorretiniana, la neovascularización coroidea y una serie de otras condiciones. Se han empleado muchas estrategias para tratar la ME con un éxito variable. Este artículo revisa las opciones de tratamiento disponibles para esta condición común.
 |
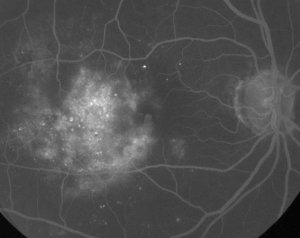 |
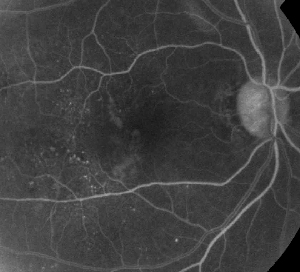
| Figura 1. A. Angiografía fluoresceínica en fase temprana de un paciente con retinopatía diabética no proliferativa. Se observan microaneurismas más prominentes temporales a la fóvea además de la fuga de fluoresceína en la zona avascular foveal. | B. FA de fase tardía del mismo paciente que muestra una fuga difusa temporal y dentro de la zona avascular foveal correspondiente al edema macular diabético. |
Diagnóstico
El diagnóstico clínico de ME se realiza mejor utilizando una lente de contacto y una biomicroscopía de fondo de ojo con lámpara de hendidura estereoscópica. La ME se manifiesta típicamente como una elevación irregular dentro de la retina, a menudo adyacente a lípidos intrarretinianos, microaneurismas y/o hemorragias en casos secundarios a diabetes mellitus, oclusión vascular o isquemia. El líquido intrarretiniano también puede acumularse en espacios quísticos localizados en la retina parafoveal con o sin anomalías vasculares adyacentes. Este edema macular cistoide (EMC) resulta más comúnmente de la inflamación, la tracción localizada, o después de la cirugía.
La angiografía con fluoresceína es una herramienta esencial en el diagnóstico del EM. En el ojo normal, la fluoresceína es impedida de pasar a la retina por las barreras sangre-retina. Sin embargo, en la EM, las moléculas de fluoresceína abandonan el espacio intravascular para entrar en la retina. Los lugares afectados muestran una hiperfluorescencia en los fotogramas tempranos y medios que aumenta en área e intensidad en los fotogramas posteriores (véase la figura 1). La AF no sólo resalta el edema para facilitar la visualización y la localización del tratamiento, sino que también crea un registro permanente para futuras comparaciones. Se ha desarrollado una escala cuantitativa de cuatro grados para la ME, en la que el grado 0 es la ausencia de hiperfluorescencia perifoveal, el grado 1 es la hiperfluorescencia perifoveal incompleta, el grado 2 es la hiperfluorescencia leve de 360 grados, el grado 3 es la hiperfluorescencia moderada de 360 grados con un área hiperfluorescente de aproximadamente 1 diámetro de disco, y el grado 4 es la hiperfluorescencia grave de 360 grados con un área hiperfluorescente de aproximadamente 1,5 diámetros de disco.1,2 Aunque la AF es un medio sensible para identificar la presencia de ME, proporciona relativamente poca información sobre la distribución anatómica del líquido, es decir, difusa o quística o subretiniana, y sobre la gravedad de la fuga a lo largo del tiempo. La AF no proporciona información cuantitativa sobre el engrosamiento de la retina. Por lo tanto, no es sorprendente que, en general, este sistema de clasificación bidimensional basado en la AF se correlacione mal con la visión.3,4
La tomografía de coherencia óptica (OCT III, Carl Zeiss) es una técnica de imagen no invasiva y sin contacto que proporciona un complemento útil para el diagnóstico de ME. Dirige un haz de luz infrarroja cercana (830 nm) perpendicular a la superficie de la retina y analiza las propiedades de los reflejos. En 1,5 segundos, produce una única imagen transversal lineal de alta resolución. Estas imágenes pueden mostrar e incluso medir la retina engrosada y quística que se encuentra en las zonas edematosas. También es útil para visualizar las propiedades de la interfaz vitreorretiniana y demuestra eficazmente cuándo la tracción vítrea desempeña un papel en la formación de ME (véase la figura 2).
Un estudio utilizó la OCT para examinar 84 ojos con ME secundario a uveítis, lo que proporcionó la ventaja añadida de revelar o confirmar la presencia de membranas epirretinianas y desprendimiento de retina seroso en el 41 y el 20% de sus casos, respectivamente.5 El estudio encontró una correlación moderada entre el grosor de la retina y la disminución de la agudeza visual, aunque el grado de correlación ha variado entre los estudios con otros investigadores informó de correlaciones débiles,6 moderadas,7 y fuertes8,9,10 utilizando diversos métodos estadísticos en diversas poblaciones de pacientes, incluyendo pacientes con retinopatía diabética, uveítis y CME.
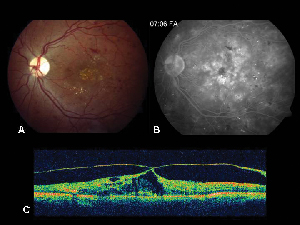
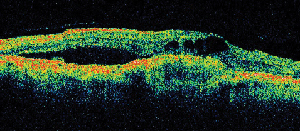
Figura 2. A. Fotografía de fondo de ojo en color del ojo izquierdo de un paciente con retinopatía diabética no proliferativa y exudación lipídica en y alrededor de la fóvea. B. La AF de fase tardía revela edema macular en la mácula central. C. La tomografía de coherencia óptica demuestra la interfaz vitreorretiniana anormal, así como el edema macular.
Otro grupo informó de que la OCT era tan eficaz como la AF en la detección de ME y superior a la AF en la descripción de la distribución axial del líquido.6 La OCT también tiene la capacidad de identificar a algunos pacientes con EM que no se visualizan con la AF, como en ciertos casos de EMC crónica en los que el tipo de fuga activa que se visualiza mejor con la AF es mínima o incluso inexistente, o cuando el examen del fondo de ojo se ve comprometido por la presencia de opacidades de los medios, como en los pacientes con hialosis asteroidea.11
El analizador de espesor de la retina (RTA, Talia Technology, Israel) es una técnica de imagen sin contacto similar que permite la cuantificación del espesor de la retina. Produce 16 escaneos transversales paralelos en un área de 3×3 mm cuadrados de la retina mediante el análisis de los reflejos de un pulso dirigido oblicuamente de luz verde (540 nm) suministrado durante 0,3 segundos. Tanto la OCT como la RTA han demostrado una excelente precisión en sus mediciones individuales del grosor de la retina, y una comparación directa de las tecnologías ha demostrado una correlación estadísticamente significativa entre sus mediciones. Aunque la RTA tiene la ventaja de una adquisición rápida con quizás menos artefactos, parece ser menos eficaz para medir el grosor de la retina que la OCT en presencia de opacidades de los medios.12
Otro estudio comparó el grosor foveal con RTA y OCT en 30 ojos sanos. El grosor foveal medio en los ojos normales se midió en 181 µm y 153 µm para la RTA y la OCT, respectivamente. Los autores concluyeron que la RTA produce ocasionalmente valores altos falsos y, por lo tanto, tiene una fiabilidad reducida en comparación con la OCT.13 Por el contrario, un análisis de pacientes con retinopatía diabética no proliferativa leve descubrió que la RTA era más sensible que la OCT a la hora de identificar áreas de engrosamiento de la retina durante las fases iniciales de la ME diabética.14
 |
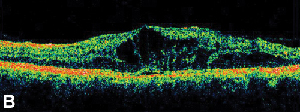 |
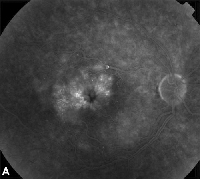
| Figura 3. A. Angiograma de fluoresceína en fase tardía de un paciente con edema macular cistoide. | B. Tomografía de coherencia óptica que muestra los grandes espacios quísticos en la fóvea. |
Tratamientos -Médicos
Los medicamentos antiinflamatorios no esteroideos tópicos son el tratamiento más común para el EM después de la cirugía de cataratas (Ver Figura 3). Estos agentes están dirigidos a disminuir los niveles de prostaglandinas intraoculares, que se han implicado en la patogénesis de la ME. Estudios aleatorizados, activos y controlados con placebo que incluyen a pacientes sometidos a cirugía de cataratas han informado de los efectos antiinflamatorios de la aplicación tópica de indometacina al 1%, flurbiprofeno al 0,03%, ketorolaco al 0,5% y preparados oftálmicos de diclofenaco al 0,1%.15,16 Sin embargo, las soluciones oftálmicas de diclofenaco al 0,1% y ketorolaco al 0,5% son los únicos AINE de aplicación tópica aprobados específicamente por la Food and Drug Administration para esta indicación. Se ha comprobado que la terapia que combina un corticosteroide tópico y gotas de AINE tiene mayor eficacia en el tratamiento de la ME que cualquiera de los dos medicamentos por separado.16 Aunque no está aprobado por la FDA, los AINE tópicos se utilizan a menudo antes de la cirugía de cataratas para prevenir la ME postoperatoria.
La acetazolamida oral se utiliza ocasionalmente en el tratamiento de la ME secundaria a afecciones inflamatorias y a la retinosis pigmentaria, especialmente cuando los AINE tópicos y los corticosteroides fracasan. Hay varios estudios prospectivos, enmascarados y cruzados que comparan la acetazolamida y el placebo en pacientes con ME debido a una variedad de causas. Un estudio cruzado de cinco ciclos en 41 pacientes encontró una respuesta reproducible, caracterizada como una resolución parcial o completa de la ME, en más de la mitad de los pacientes con enfermedades hereditarias o inflamatorias de la retina, pero ninguna respuesta de aquellos con enfermedades vasculares primarias de la retina.17 Se encontró que una acetazolamida de 500 mg/día u oral era más eficaz que 250 mg/día en el tratamiento de la ME en pacientes con ME secundaria a la RP.18 En este estudio se observó una mejoría en 10 de los 12 pacientes tratados.
Otro grupo llegó a la conclusión de que los pacientes menores de 55 años con EM atribuida a iridociclitis crónica tenían más posibilidades de responder a 500 mg de acetazolamida b.i.d. que los pacientes de más edad.19 Un estudio reciente ha sugerido que la acetazolamida también puede ser eficaz para el tratamiento de la EM inducida por la diabetes.20
Los corticosteroides son potentes agentes antiinflamatorios que se utilizan con frecuencia en el tratamiento de la EM. Tienen múltiples mecanismos de acción, incluyendo la estabilización de la barrera sangre-retina y la inhibición de los mediadores proinflamatorios. Las formas de administración incluyen la tópica, la inyección periocular, la inyección intravítrea y la administración oral e intravenosa. Aunque los corticosteroides orales e intravenosos alcanzan ciertamente niveles terapéuticos en el vítreo, exponen a los pacientes al riesgo adicional de complicaciones sistémicas, por lo que suelen reservarse para los pacientes con uveítis que ponen en peligro la vista en el contexto de una enfermedad sistémica. Las gotas de corticosteroides tópicos están en el otro extremo del espectro de seguridad, pero su capacidad para llegar al segmento posterior es limitada.
Las inyecciones sub-Tenon ofrecen una alternativa para administrar dosis relativamente altas de corticosteroides al ojo con menores riesgos de complicaciones sistémicas.21 Aunque no se han realizado ensayos aleatorios y controlados, la inyección de corticosteroides sub-Tenon se ha utilizado eficazmente en el tratamiento del edema macular durante muchos años. La técnica más común utiliza una aguja corta de calibre 25 colocada a través de la conjuntiva bulbar superotemporal en el espacio sub-Tenon mientras el paciente mira hacia abajo. La aguja se hace avanzar posteriormente a lo largo del globo utilizando un movimiento de barrido de lado a lado para evitar la penetración inadvertida del globo, hasta que el cubo alcanza el sitio de entrada conjuntival, cuando se administra la medicación. En un informe se incluyeron 20 pacientes consecutivos con uveítis intermedia asociada a pérdida de visión que fueron tratados con una inyección subtenoniana de 40 mg de acetónido de triamcinolona.22 Aunque no todos los pacientes demostraron ME en la AF, el 67% mejoró en dos líneas de visión tras un tratamiento. Los riesgos de este procedimiento incluyen la elevación persistente de la presión intraocular, la catarata, la ptosis y la penetración intraocular, entre otros.
Recientemente, el uso de la inyección intravítrea de acetónido de triamcinolona (Kenalog, 4,0 mg) ha aumentado debido a su potente capacidad para mejorar la ME refractaria secundaria a la diabetes mellitus (véase la figura 4), las oclusiones venosas de la retina, la inflamación y otras causas idiopáticas.23-26 Los estudios preliminares muestran una reducción drástica del engrosamiento de la retina, una disminución de las fugas de fluoresceína y una mejora visual, que puede ser notable en algunos pacientes. Aunque el efecto es temporal y suele durar de tres a seis meses o menos, la ME suele responder a la reinyección. Sin embargo, el uso de corticosteroides intravítreos se asocia con un riesgo de 30 a 40 por ciento de presión intraocular persistentemente elevada y un riesgo aproximado de 10 por ciento de cataratas que requieren cirugía. El Instituto Nacional del Ojo está inscribiendo actualmente a pacientes para SCORE, el estudio de atención estándar frente a corticosteroides para la oclusión venosa de la retina, que compara las inyecciones intravítreas de triamcinolona (en dosis de 1 y 4 mg) con la atención estándar (observación y/o tratamiento con láser de rejilla) en pacientes con EM secundaria a la oclusión venosa. El estudio seguirá a un total de 1.260 pacientes y continuará el tratamiento durante 36 meses.
La EM también se produce en la degeneración macular relacionada con la edad (véase la figura 5). Actualmente se está investigando la inyección intravítrea de acetónido de triamcinolona para su uso combinado con la terapia fotodinámica para el tratamiento de la DMAE neovascular (Visudyne con acetónido de triamcinolona intravítrea, VisTA). Un estudio destaca la importancia de la triamcinolona intravítrea que precede a la aplicación de la TFD en pacientes con edema macular y NVC.27 Los autores teorizan que la verteporfina puede filtrarse a los espacios intrarretinianos quísticos, lo que provoca daños en los fotorreceptores de la retina normal adyacente una vez que el fármaco se fotoactiva, mientras que la resolución previa del edema retiniano puede evitar esta complicación. La administración previa de corticosteroides también puede servir para atenuar cualquier elevación de los niveles de VEGF intraocular inducida por la TFD.
Las inyecciones intravítreas en sí mismas se asocian con riesgos pequeños, pero definitivos, de efectos secundarios graves y potencialmente cegadores, como endoftalmitis infecciosa, desprendimiento de retina, hemorragia, hipertensión ocular, cataratas e hipotonía.28 Las directrices recientemente publicadas para las inyecciones intravítreas intentan establecer un enfoque de mejores prácticas para esta técnica cada vez más utilizada. Las recomendaciones del panel de consenso abordan las consideraciones previas a la inyección, incluidos los antibióticos, la evaluación del glaucoma, el uso de guantes y el tratamiento de las anomalías preexistentes de los párpados, así como la importancia de evitar una manipulación excesiva de los párpados antes y durante el procedimiento. El régimen recomendado para la peri-inyección incluye el uso de anestesia tópica y/o subconjuntival, povidona yodada tópica y un espéculo para los párpados. Los autores destacaron la importancia de controlar la PIO y la visualización directa del fondo de ojo tras la inyección para verificar la perfusión del nervio óptico, la localización intravítrea de la triamcinolona y la ausencia de hemorragia o desprendimiento de retina asociados a la inyección. También destacaron la importancia de la educación del paciente ante los síntomas tempranos de posibles complicaciones y el seguimiento exhaustivo.29
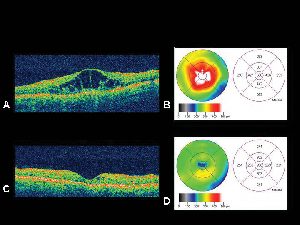
Figura 4. A. Imagen de tomografía de coherencia óptica de un ojo con edema macular diabético con el correspondiente mapa de espesor de la retinaB. generado por la OCT. C. OCT del mismo paciente un mes después de la inyección intravítrea de acetónido de triamcinolona con el correspondiente mapa de espesor de la retina. D. Resolución del edema macular. La agudeza visual mejoró de 20/200 a 20/80 tras el tratamiento.
Varios ensayos están investigando dispositivos alternativos de administración de corticosteroides a largo plazo para su uso dentro del ojo. Un estudio consiste en la colocación quirúrgica de un gránulo de acetónido de fluocinolona incrustado en un puntal de plástico con liberación controlada de esteroides durante tres años. Conocido como implante intravítreo Envision, de Bausch & Lomb y Control Delivery Systems, se coloca a través de la pars plana y se sutura a la esclerótica. En un estudio de fase II/III, aleatorizado y enmascarado, se comparó el implante Envision TD en 80 pacientes asignados aleatoriamente a acetónido de fluocinolona de 0,5 frente a 2,0 mg, frente al tratamiento estándar consistente en fotocoagulación con láser u observación. Después de seis meses, se observó una reducción estadísticamente significativa de la EM y la gravedad de la retinopatía diabética con el implante de 0,5 mg en comparación con el tratamiento estándar. Además, no hubo diferencias en la incidencia de efectos adversos graves. El brazo de 2,0 mg del estudio se detuvo antes de tiempo debido a los resultados observados en un segundo estudio en el que no se observó ninguna ventaja sobre 0,5 mg. En un segundo estudio se incluyeron 278 pacientes con uveítis posterior no infecciosa, aleatorizados para recibir un implante de Retisert de 0,59 mg o de 2,1 mg en el ojo afectado o, en los casos bilaterales, en el ojo más afectado. Tras dos dosis y 34 semanas, hubo una tasa de recidiva significativamente menor en los ojos con el implante (10 frente a 55,7 por ciento, p<0,0001) con una disminución del uso de corticosteroides sistémicos/tratamiento inmunosupresor (59,0 por ciento al inicio frente a 13,7 por ciento a las 34 semanas), así como del uso de esteroides subtenonianos y tópicos. Hubo una mejora significativa de la agudeza visual (p<0,05). Los efectos adversos más frecuentes fueron la progresión de las cataratas y el aumento de la presión intraocular, que requirió un procedimiento de filtrado en el 8,6%. (Jaffe G. Invest Ophthalmol Vis Sci. 2004; 44 ARVO E-Abstract #3369.)
Otro ensayo se refiere a Posurdex de Allergan, un gránulo de dexametasona bioerodable que se inyecta en el espacio vítreo y libera la medicación durante 50 a 160 días. Los resultados de un ensayo de fase II revelaron que tanto el gránulo de 350 µg como el de 700 µg mejoraron significativamente el porcentaje de pacientes con una mejora de dos líneas o más en la visión (27,2 por ciento y 35,7 por ciento 350 µg y 700 µg, respectivamente), así como una mejora de tres líneas o más en la visión (13 por ciento y 19,4 por ciento, para 350 µg y 700 µg, respectivamente) a los 180 días en comparación con el placebo. Hasta el momento, no se ha notificado un aumento de la incidencia de cataratas, aunque se observaron aumentos de la PIO en aproximadamente el 15 por ciento de los pacientes.
Tratamientos -Láser
Más recientemente, se estudió Macugen, de Eyetech y Pfizer, en un ensayo de fase II aleatorizado, con doble enmascaramiento, multicéntrico y controlado por dosis en 172 pacientes con ME diabética. El estudio investigó tres dosis (0,3 mg, 1,0 mg, 3,0 mg) frente a inyecciones simuladas administradas cada seis semanas durante tres inyecciones. Mientras que a los investigadores del láser focal/grid anterior se les pidió que inscribieran sólo a los pacientes en los que se sintieran cómodos aplazando el láser focal/grid durante al menos 12 semanas. Se administraron inyecciones adicionales y/o fotocoagulación focal/grid a discreción del investigador desde la semana 18 a la 30. Las evaluaciones finales se realizaron en la semana 36, seis semanas después de la última inyección prevista. En general, los sujetos asignados a recibir Macugen obtuvieron mejores resultados en cuanto a la visión, tuvieron más probabilidades de mostrar una reducción del grosor de la retina central y se consideró que era menos probable que necesitaran una terapia láser adicional en comparación con los pacientes simulados.31 Actualmente está previsto un estudio confirmatorio de fase III.
La fotocoagulación láser focal/en cuadrícula sigue siendo el estándar de atención para el tratamiento de la ME diabética. El Estudio de Tratamiento Temprano de la Retinopatía Diabética demostró que los pacientes tratados con láser de rejilla tenían una reducción del 50 por ciento en la pérdida visual moderada, definida como una duplicación del ángulo visual o una disminución de la visión de tres líneas, en comparación con la observación.30 Aunque se desconoce el mecanismo exacto por el que el láser disminuye la ME, se cree que promueve la formación de uniones estrechas entre las células del EPR, así como que reduce la demanda de oxígeno de los fotorreceptores y aumenta la perfusión de oxígeno de la coroides.31 El EDTRS identificó a los pacientes elegibles para la fotocoagulación con láser focal por tener una ME clínicamente significativa. Esto se definió como el cumplimiento de uno de los tres criterios siguientes 1) engrosamiento de la retina situado a menos de 500 µm de la fóvea; 2) exudados duros a menos de 500 µm de la fóvea asociados a un engrosamiento de la retina adyacente; o 3) un área de edema de 1 diámetro de disco o mayor, cualquier parte de la cual estuviera situada a menos de 1 diámetro de disco de la fóvea. Sin embargo, la EDTRS no distingue entre EM focal, que corresponde a un engrosamiento local de la retina adyacente a los microaneurismas, y EM difusa, que se refiere a un engrosamiento generalizado del polo posterior. La evidencia anecdótica muestra que la ME diabética focal responde bien al láser focal/de rejilla, mientras que la variedad difusa fracasa más frecuentemente en el tratamiento con láser y requiere un manejo alternativo.
 |
 |
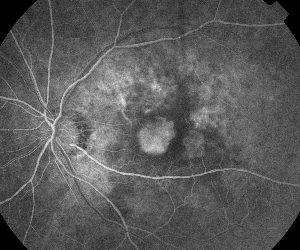
| Figura 5. A. Angiografía fluoresceínica temprana que muestra la clásica neovascularización subfoveal. | B. La correspondiente tomografía de coherencia óptica revela áreas de acumulación de líquido subretiniano e intrarretiniano, además de demostrar la neovascularización (flecha). |
Tratamientos -Cirugía
El primer grupo que informó de los beneficios de la vitrectomía y la separación de la hialoides posterior en pacientes con ME diabética sugirió que existe un subgrupo de pacientes en los que la tracción vítrea y los desprendimientos maculares poco profundos contribuyen al engrosamiento de la retina.32 Esto se ha confirmado posteriormente con la OCT, lo que ha llevado a perfeccionar las indicaciones de esta técnica.33,34 Las tres series más amplias35,36,37 de pacientes sometidos a vitrectomía por EM diabética que no respondían a tratamientos menos invasivos analizaron a 59, 58 y 65 pacientes, respectivamente. Informaron de que el 47%, el 53% y el 45%, respectivamente, de sus pacientes mejoraron su visión en dos líneas o más. El último de ellos informó de complicaciones postoperatorias graves desarrolladas en una minoría de pacientes, incluyendo desprendimiento de retina (1,5 por ciento), rubeosis iridis (4,6 por ciento) membrana epirretiniana (13,8 por ciento), hemorragia vítrea recurrente (1,5 por ciento) y depósitos foveales de exudado duro (4,6 por ciento), mientras que las complicaciones reveladas por el segundo grupo incluían membranas epirretinianas en el 10,2 por ciento y cataratas en el 63,2 por ciento de los ojos fáquicos. Varias otras series de casos han mostrado resultados similares; sin embargo, todas fueron no aleatorias, sin control de placebo y utilizando diferentes criterios de inclusión y exclusión. Además, las técnicas quirúrgicas también han diferido, dejando las indicaciones exactas para la vitrectomía en pacientes con EMC abiertas a la interpretación.
La EMC sigue siendo una causa importante de pérdida visual a pesar de la variedad de tratamientos disponibles. La fotocoagulación con láser sigue siendo una parte integral del tratamiento de la EM debido a la diabetes, la isquemia y las oclusiones vasculares. Los AINE y los corticosteroides tópicos son actualmente el método principal para controlar la ME postoperatoria, mientras que la acetazolamida sigue siendo un medio eficaz para tratar en pacientes seleccionados con ME secundaria a uveítis y retinitis pigmentaria. El papel de los corticosteroides intravítreos en el tratamiento de la ME se está ampliando, pero sigue estando limitado por los efectos secundarios y la duración del efecto. Los refinamientos en las técnicas quirúrgicas seguirán añadiendo una nueva dimensión a la ME que no responde a un tratamiento menos invasivo, mientras que los avances en la farmacoterapia y la administración de fármacos oculares prometen desempeñar un papel en la prevención y el manejo de todas las causas y tipos de ME.
El Dr. Ober es especialista en cirugía vitreorretiniana en el Instituto Oftalmológico Edward S. Harkness del Colegio de Médicos y Cirujanos de la Universidad de Columbia, y en el Centro de Investigación de la Retina LuEsther T. Mertz del Hospital de Ojos, Oídos y Garganta de Manhattan. Póngase en contacto con él en 210 East 64th St., 8th Fl, New York, NY 10021; correo electrónico: [email protected]; o (212) 605 3777 o fax (212) 605 3795.
La Dra. Klais es becaria de retina en el LuEsther T. Mertz Retinal Research Center. Póngase en contacto con ella en la misma dirección, números de teléfono o fax, o por correo electrónico en [email protected].
El Dr. Cunningham es profesor clínico de oftalmología y director del Servicio de Uveítis de la Facultad de Medicina de la Universidad de Nueva York. También es empleado de Eyetech Pharmaceuticals Inc. Póngase en contacto con él en Vitreous-Retina-Macula Consultants of New York, 460 Park Ave., Nueva York, N.Y. 10022, por correo electrónico [email protected], o por teléfono/fax al (212) 861 9797.
1. Spaide RF, Yannuzzi LA, Sisco LJ. Edema macular cistoide crónico y predictores de la agudeza visual. Ophthalmic Surg 1993;24:262-267.
2. Yannuzzi LA. Una perspectiva sobre el tratamiento del edema macular cistoide afáquico. Surv Ophthalmol 1984;28:540-553
3. Chang A, Spaide RF, Yannuzzi LA. Edema macular cistoide postquirúrgico. En: Guyer DR, Yannuzzi LA, Chang S, et al. Retina, Vitreous, Macula. Saunders. Philadelphia. 1999;1:239-255.
4. Nussenblatt RB, Kaufman SC, Palestina AG, et al. Engrosamiento macular y agudeza visual. Medición en pacientes con edema macular cistoide. Ophthalmology 1987;94:1134-9.
5. Markomichelakis NN, Halkiadakis I, Pantelia E, et al. Patrones de edema macular en pacientes con uveítis: evaluación cualitativa y cuantitativa mediante tomografía de coherencia óptica. Ophthalmology 2004;111:946-53.
6. Antcliff RJ, Stanford MR, Chauhan DS, et al. Comparación entre la tomografía de coherencia óptica y la angiografía con fluoresceína del fondo de ojo para la detección del edema macular cistoide en pacientes con uveítis. Ophthalmology 2000; 107:593-9.
7. Otani T, Kishi S, Maruyama Y. Patterns of diabetic macular edema with optical coherence tomography. Am J Ophthalmol 1999;127:688-93.
8. Hee MR, Puliafito CA, Wong C, et al. Evaluación cuantitativa del edema macular con tomografía de coherencia óptica. Arch Ophthalmol 1995;113:1019-29.
9. Nussenblatt RB, Kaufman SC, Palestine AG, et al. Macular thickening and visual acuity. Medición en pacientes con edema macular cistoide. Ophthalmology 1987;94:1134-9.
10. Ozdek SC, Erdinc MA, Gurelik G, et al. Evaluación tomográfica de coherencia óptica del edema macular diabético: comparación con los hallazgos angiográficos y clínicos de la fluoresceína. Ophthalmologica 2005;219:86-92.
11. Browning DJ, Fraser CM. Optical coherence tomography to detect macular edema in the presence of asteroid hyalosis. Am J Ophthalmol 2004;137:959-961.
12. Polito A, Shah SM, Haller JA et al. Comparación entre el analizador de espesor de la retina y la tomografía de coherencia óptica para la evaluación del espesor foveal en ojos con enfermedad macular. Am J Ophthalmol 2002;134:240-51.
13. Neubauer AS, Priglinger S, Ullrich S, et al. Comparación del espesor foveal medido con el analizador de espesor de la retina y la tomografía de coherencia óptica. Retina 2001;21:596-601.
14. Pires I, Bernardes RC, Lobo CL, Soares MA, Cunha-Vaz JG. Espesor de la retina en ojos con retinopatía no proliferativa leve en pacientes con diabetes mellitus tipo 2: comparación de las mediciones obtenidas por el análisis del espesor de la retina y la tomografía de coherencia óptica. Arch Ophthalmol 2002 Oct;120(10):1301-6.
15. Flach AJ. Cyclo-oxygenase inhibitors in ophthalmology. Surv Ophthalmol 1992;36:259-284.
16. Heier JS, Topping TM, Baumann W, Dirks MS, Chern S. Ketorolac versus prednisolona versus terapia combinada en el tratamiento del edema macular cistoide agudo pseudofáquico. Ophthalmology 2000;107:2034-8.
17. Cox SN, Hay E, Bird AC. Tratamiento del edema macular crónico con acetazolamida. Arch Ophthalmol 1988;106:1190-5.
18. Fishman GA, Gilbert LD, Fiscella RG, Kimura AE, Jampol LM. Acetazolamida para el tratamiento del edema macular crónico en la retinosis pigmentaria. Arch Ophthalmol 1989;107:1445-52.
19. Farber MD, Lam S, Tessler HH, Jennings TJ, Cross A, Rusin MM. Reducción del edema macular mediante acetazolamida en pacientes con iridociclitis crónica: un estudio cruzado prospectivo aleatorio. Br J Ophthalmol 1994;78:4-7.
20. Giusti C, Forte R, Vingolo EM, Gargiulo P. ¿Es eficaz la acetazolamida en el tratamiento del edema macular diabético? Un estudio piloto. Int Ophthalmol 2001;24:79-88.
21. Jennings T, Rusin MM, Tessler HH, Cunha-Vaz JG. Inyecciones subtenonianas posteriores de corticosteroides en pacientes con uveítis y edema macular cistoide. Jpn J Ophthalmol 1988;32:385-91.
22. Helm CJ, Holland GN. The effects of posterior subtenon injection of triamcinolone acetonide in patients with intermediate uveitis. Am J Ophthalmol 1995;120:55-64.
23. Benhamou N, Massin P, Haouchine B, Audren F, et al. Triamcinolona intravítrea para el edema macular pseudofáquico refractario. Am J Ophthalmol 2003;135:246-9.
24. Jonas JB, Kreissig I, Degenring RF. Acetónido de triamcinolona intravítreo como tratamiento del edema macular en la oclusión de la vena central de la retina. Graefes Arch Clin Exp Ophthalmol. 2002;240:782-3.
25. 25. Martidis A, Duker JS, Greenberg PB, Rogers AH, et al. Triamcinolona intravítrea para el edema macular diabético refractario. Ophthalmology 2002; 109: 920-7.
26. 26. Scott IU, Flynn HW Jr, Rosenfeld PJ. Acetónido de triamcinolona intravítrea para el edema macular cistoide idiopático. Am J Ophthalmol 2003;136:737-9.
27. 27. Freund KB, Klais CM, Eandi CM, et al. Terapia fotodinámica combinada y secuenciada de triamcinolona intravítrea y verde de indocianina guiada por angiografía para la proliferación angiomatosa de la retina. Arch Ophthalmol, In Press.
28. 28. Jager RD, Aiello LP, Patel SC, Cunningham ET Jr. Riesgos de la inyección intravítrea: una revisión exhaustiva. Retina. 2004 Oct;24(5):676-98.
29. 29. Aiello LP, Brucker AJ, Chang S, et al. Evolución de las directrices para las inyecciones intravítreas. Retina 2004 Oct;24(5 Suppl):S3-19.
30. .G.Jaffe, Fluocinolone Acetonide Uveitis Study Group. Implante intravítreo de acetónido de fluocinolona para la uveítis que afecta al segmento posterior del ojo. ARVO 2004, póster #3369.
31. El Grupo de Estudio de la Retinopatía Diabética de Macugen. A phase II randomized, double-masked trial of pegaptanib, an anti-vascular endothelial growth factor aptamer, for diabetic macular edema. Ophthalmology, In press.
32. 30. Fotocoagulación para el edema macular diabético. Early Treatment Diabetic Retinopathy Study report number 1. Arch Ophthalmol 1985;103:1796-806.
33. Christoforidis JB, D’Amico DJ. Tratamientos quirúrgicos y otros tratamientos del edema macular diabético: una actualización. Int Ophthalmol Clin 2004;44:139-60.
34. Lewis H, Abrams GW, Blumenkranz MS, Campo RV. Vitrectomía para la tracción macular diabética y el edema asociado a la tracción hialoidea posterior. Ophthalmology 1992;99:753-9.
35. Kaiser PK, Riemann CD, Sears JE, Lewis H. Macular traction detachment and diabetic macular edema associated with posterior hyaloidal traction. Am J Ophthalmol 2001;131:44-9.
36. Lewis H. The role of vitrectomy in the treatment of diabetic macular edema. Am J Ophthalmol 2001;131:123-5.
37. Pendergast SD. Vitrectomía para el edema macular diabético asociado a una hialoide premacular tensa. Curr Opin Ophthalmol 1998;9:71-5.
38. Tachi N, Ogino N. Vitrectomy for diffuse macular edema in cases of diabetic retinopathy. Am J Ophthalmol 1996;122:258-60.
39. Yamamoto T, Hitani K, Tsukahara I, Yamamoto S, et al. Early postoperative retinal thickness changes and complications after vitrectomy for diabetic macular edema. Am J Ophthalmol 2003;135:14-9.